Природные источники углеводородов
Базовый уровень сложности
1. Процессом первичной переработки нефти является
| 1) | ароматизация | 3) | пиролиз |
| 2) | крекинг | 4) | ректификация |
2. Бензиновая фракция нефти содержит алканы состава
| 1) | СН4 – С4Н10 | 3) | С8Н18 – С14Н30 |
| 2) | С5Н12 – С11Н24 | 4) | С5Н12 – С18Н38 |
3. Остаток от перегонки мазута называется
| 1) | гудроном | 3) | парафином |
| 2) | вазелином | 4) | соляровым маслом |
4. Наименьшей стойкостью к детонации обладают углеводороды
| 1) | ароматические |
| 2) | непредельные |
| 3) | предельные неразветвленного строения |
| 4) | предельные с разветвленной цепью |
5. Крекинг нефтепродуктов начинается с разрыва связей
| 1) | С – О | 2) | С – S | 3) | C – H | 4) | C – C |
6. Риформингом называется процесс
| 1) | разделения углеводородов на фракции |
| 2) | расщепления молекул углеводородов на более мелкие |
| 3) | превращения алканов и циклоалканов в ароматические соединения |
| 4) | обезвоживания, обессоливания и отгонки летучих углеводородов |
7. Основными продуктами коксования каменного угля являются
| 1) | газойль, вазелин, керосин, кокс |
| 2) | бензин, нафталин, метан |
| 3) | каменноугольная смола, аммиак, соляровое масло |
| 4) | кокс, каменноугольная смола, аммиачная вода, коксовый газ |
8. Какие из утверждений о нефти и способах ее переработки верны?
А. Основными компонентами нефти являются углеводороды различного строения.
|
|
|
Б. Фракционная перегонка нефти относится к химическим процессам.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
9. Какие из утверждений о продуктах переработки нефти верны?
А. Бензин, получаемый прямой перегонкой нефти, содержит большое количество непредельных углеводородов.
Б. Детонационная стойкость бензина возрастает при увеличении в его составе разветвленных и ароматических углеводородов.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
10. Какие из утверждений о продуктах переработки нефти верны?
А. Продукты термического крекинга содержат большое количество неразветвленных алканов.
Б. Бензин, получаемый в результате каталитического крекинга, имеет высокое октановое число.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
11. Какие из утверждений о продуктах переработки нефти верны?
А. В процессе каталитического риформинга образуются ароматические и разветвленные углеводороды.
Б. Бензин, получаемый в результате прямой перегонки нефти, имеет высокое октановое число.
|
|
|
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
12. Какие из утверждений о нефти и природном газе верны?
А. Крекинг нефти позволяет увеличить выход бензина.
Б. Основным компонентом природного газа является метан.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
13. Какие из утверждений о природном и попутном нефтяном газе верны?
А. Содержание метана в попутном нефтяном газе выше, чем в природном.
Б. Природный газ используют для получения синтез-газа.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
14. Какие из утверждений о природном газе и каменном угле верны?
А. В отличие от каменного угля природный газ является экологически чистым топливом.
Б. Коксовый газ применяют в качестве топлива и химического сырья.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
Повышенный уровень сложности
15. Основными продуктами пиролиза нефти являются
| 1) | н-октан | 4) | толуол |
| 2) | ацетилен | 5) | вазелин |
| 3) | бензол | 6) | метан |
|
|
|
16. Природный газ имеет состав (в объемных процентах): 94% метана, 2% этана, 2% пропана, 1% азота, 1% углекислого газа. Объем (н.у.) воздуха, который необходим для полного сгорания 100 л (н.у.) природного газа, равен _________ л. (Запишите число с точностью до целых.)
17. Из 400 л (н.у.) природного газа, объемная доля метана в котором составляет 95%, с выходом 80% получили ацетилен. Объем (н.у.) полученного ацетилена равен _________ л. (Запишите число с точностью до целых.)
18. В результате риформинга из 344 кг гексана с выходом 90% получили бензол, масса которого равна _________ кг. (Запишите число с точностью до десятых.)
19. В результате риформинга из 300 кг гептана с выходом 85% получили толуол, масса которого равна _________ кг. (Запишите число с точностью до десятых.)
Спирты. Фенолы
Базовый уровень сложности
1. Состав предельных одноатомных спиртов выражается общей формулой
| 1) | CnH2nО | 2) | CnH2n+2О | 3) | CnH2n-2О | 4) | CnH2n-6О |
2. Функциональной группой спиртов является
| 1) | ─ СООН | 2) | ─ СОН | 3) | ─ ОН | 4) | ─ NO2 |
3. Название спирта, структурная формула которого
СН3 – СН – СН2 – СН2 – ОН
|
|
|
|
СН3
| 1) | бутанол-1 | 3) | 2-метилбутанол-4 |
| 2) | 3-метилбутанол-1 | 4) | пентанол-1 |
4. Название спирта, структурная формула которого
СН3 ─ СН2 ─ СН ─ СН ─ СН3
│ │
СН3 ОН
| 1) | 3-метилпентанол-4 | 3) | 3-метилпентанол-2 |
| 2) | 1,3-диметилбутанол-2 | 4) | 3-метилпропанол-2 |
5. Название спирта, структурная формула которого
С2Н5 ─ СН ─ СН ─ СН3
│ │
СН3 ОН
| 1) | 2-метилбутанол-3 | 3) | 3-метилбутанол-2 |
| 2) | изобутанол | 4) | 3-метилпентанол-2 |
6. 3-Метилбутанолу-2 соответствует структурная формула
| 1) | СН3 ─ СН2─ С(СН3) ─ ОН │ СН3 | 3) | СН3 ─ СН2─ СНОН ─ СН3 |
| 2) | С2Н5 │ CH3 ─ CH ─ОН | 4) | СН3 ─ СН ─ СН ─ СН3 │ │ СН3 ОН |
7. Этиленгликоль относится к классу веществ
| 1) | предельные одноатомные спирты |
| 2) | предельные одноосновные кислоты |
| 3) | предельные двухатомные спирты |
| 4) | сложные эфиры |
8. Ароматическим спиртом является вещество, формула которого
| 1) | C6H5OН | 3) | C6H5СН2OН |
| 2) | CH3CH2ОН | 4) | СН3-СНОН-СН3 |
9. Предельным одноатомным спиртам изомерны
| 1) | карбоновые кислоты | 3) | простые эфиры |
| 2) | альдегиды | 4) | сложные эфиры |
10. Изомером этанола является
| 1) | диэтиловый эфир | 3) | этаналь |
| 2) | диметиловый эфир | 4) | метилформиат |
11. Изомером 2-метилбутанола-1 является
| 1) | 2- метилпропанол-1 | 3) | пентанол-2 |
| 2) | бутанол-1 | 4) | бутандиол-1,2 |
12. Число простых эфиров, изомерных бутанолу, равно
| 1) | 1 | 2) | 2 | 3) | 3 | 4) | 4 |
13. Гомологом пропанола-2 является:
| 1) | пропанол-1 | 3) | бутанол-2 |
| 2) | бутанол-1 | 4) | 2-метилпропанол-1 |
14. Гомологом 2-метилбутанола-1 является:
| 1) | бутанол-1 | 3) | 2-метилбутанол-2 |
| 2) | бутанол-2 | 4) | 2-метилпропанол-1 |
15. Гомологом 2-метилпропанола-2 является:
| 1) | 2-метилпропанол-1 | 3) | 2-метилбутанол-2 |
| 2) | 2-метилбутанол-1 | 4) | бутанол-2 |
16. Первичным спиртом является
| 1) | 2-метилпропанол-1 | 3) | 3-метилпентанол-3 |
| 2) | 2-метилбутанол-2 | 4) | 2-метилпропанол-2 |
17. Вторичным спиртом является
| 1) | 2-метилпропанол-1 | 3) | 2-метилбутанол-1 |
| 2) | бутанол-2 | 4) | 2-метилпентанол-2 |
18. Третичным спиртом является
| 1) | 2-метилпропанол-1 | 3) | 3-метилпентанол-2 |
| 2) | 2-метилбутанол-1 | 4) | 2-метилпентанол-2 |
19. Одноатомным спиртом является вещество, формула которого
| 1) | CH2ОН-CH2ОН | 3) | C6H5ОН |
| 2) | СН3-СНОН-CH2ОН | 4) | C6H5СН2ОН |
20. Многоатомным спиртом является
| 1) | бутанол-1 | 2) | этиленгликоль | 3) | этанол | 4) | толуол |
21. Ароматическим спиртом является вещество, формула которого
| 1) | C6H11ОН | 3) | C6H5ОН |
| 2) | С6Н13ОН | 4) | C6H5СН2ОН |
22. Фенолом является вещество, формула которого
| 1) | C6H11ОН | 3) | C6H5ОН |
| 2) | C6H5С2Н4ОН | 4) | C6H5СН2ОН |
23. В молекуле метанола между атомами существуют связи
| 1) | только ковалентные полярные |
| 2) | ковалентные полярные и неполярные |
| 3) | ковалентные полярные и ионные |
| 4) | ковалентные полярные и водородная |
24. В молекуле пентанола-1 между атомами существуют связи
| 1) | только ковалентные полярные |
| 2) | ковалентные полярные и неполярные |
| 3) | ковалентные полярные и ионные |
| 4) | ковалентные полярные и водородная |
25. В твердом агрегатном состоянии спирты образуют кристаллическую решетку
| 1) | ионную | 3) | атомную |
| 2) | молекулярную | 4) | металлическую |
26. Способность низших спиртов к образованию межмолекулярных водородных связей является причиной их
| 1) | летучести | 3) | химической активности |
| 2) | неэлектропроводности | 4) | хорошей растворимости в воде |
27. К образованию водородной связи способно вещество, формула которого
| 1) | СН4 | 3) | СН3 ─ O ─ CH3 |
| 2) | СН3 ─ CH3 | 4) | СН3 ─ OH |
28. Из перечисленных спиртов наиболее хорошо растворим в воде
| 1) | пентанол-2 | 3) | пропанол-1 |
| 2) | бутанол-1 | 4) | 2,2-диметилпропанол-1 |
29. В результате реакции гидратации алкена нельзя получить спирт, формула которого
| 1) | СН3 ─ СНОН ─ СН3 | 3) | CH3 ─ CH2 ─ ОН |
| 2) | СН3 ─ СНОН ─ СН2 ─ СН3 | 4) | CH3 ─ ОН |
30. Среда водного раствора этанола
| 1) | щелочная | 2) | нейтральная | 3) | кислая | 4) | слабокислая |
31. При окислении пропанола-1 образуется
| 1) | пропан | 3) | пропанон |
| 2) | пропионовый альдегид | 4) | пропен |
32. Метанол окисляется до формальдегида под действием
| 1) | водорода | 3) | оксида кальция |
| 2) | оксида меди(II) | 4) | хлорида алюминия |
33. Коэффициент перед формулой кислорода в уравнении реакции горения этанола равен
| 1) | 1 | 2) | 2 | 3) | 3 | 4) | 4 |
34. Сумма коэффициентов в уравнении реакции горения метанола равна
| 1) | 5 | 2) | 7 | 3) | 9 | 4) | 11 |
35. Продуктом окисления этанола оксидом меди (II) является
| 1) | этандиол-1,2 | 3) | этаналь |
| 2) | диэтиловый эфир | 4) | этановая кислота |
36. Продуктом внутримолекулярной дегидратации этилового спирта является
| 1) | уксусная кислота | 3) | этаналь |
| 2) | диэтиловый эфир | 4) | этен |
37. Продуктом межмолекулярной дегидратации этилового спирта является
| 1) | диметиловый эфир | 3) | этилацетат |
| 2) | диэтиловый эфир | 4) | этилен |
38. С метанолом взаимодействует каждое из двух веществ
| 1) | NaOH и H2SO4 | 3) | Н2 и CuO |
| 2) | C2H5OH и HCOOH | 4) | Cu и CH3COOH |
39. С этанолом взаимодействует каждое из двух веществ
| 1) | CH4 и HNO3 | 3) | Na2SO4 и Cu(OH)2 |
| 2) | H2 и H2SO4 | 4) | K и HBr |
40. С пропанолом-1 взаимодействует каждое из трех веществ
| 1) | C2H6, Аg, H2O | 3) | NaOH, CH3COOH, MgO |
| 2) | CuO, CH3OH, HCl | 4) | H2, H3PO4, KBr |
41. В водном растворе глицерина лакмус имеет окраску
| 1) | малиновую | 2) | красную | 3) | синюю | 4) | фиолетовую |
42. Глицерин реагирует с
| 1) | Na2СО3 | 2) | С6Н6 | 3) | Cu(OH)2 | 4) | КNO3 |
43. Глицерин взаимодействует с каждым из двух веществ
| 1) | C2H6 и CuO | 3) | Cu(OH)2 и CaCO3 |
| 2) | HCOOH и Na2SO4 | 4) | Na и HNO3 |
44. Этиленгликоль реагирует с
| 1) | NaСl | 2) | CH3COOH | 3) | CH4 | 4) | MgO |
45. Этиленгликоль образует сложный эфир при взаимодействии с
| 1) | HBr | 2) | HCOH | 3) | НCOOH | 4) | CH3OH |
46. Этиленгликоль реагирует с каждым из трех веществ
| 1) | C3H8, Сu, H2O | 3) | KOH, HCOOH, ZnO |
| 2) | Cu(OH)2, CH3COOH, HBr | 4) | H2, HNO3, SiO2 |
47. Пропантриол-1,2,3 не взаимодействует с
| 1) | Na | 2) | Cu | 3) | Cu(OH)2 | 4) | HNO3 |
48. Кислотные свойства наиболее выражены у
| 1) | метанола | 3) | пропанола |
| 2) | фенола | 4) | этиленгликоля |
49. Бромирование фенола относится к реакциям
| 1) | разложения | 2) | замещения | 3) | обмена | 4) | присоединения |
50. Фенол не взаимодействует с
| 1) | K | 2) | NaOH | 3) | C2H6 | 4) | HNO3 |
51. В реакции, схема которой
C6H5ОН + X → C6H5ONa + H2,
веществом Х может быть
| 1) | хлорид натрия | 3) | карбонат натрия |
| 2) | гидроксид натрия | 4) | натрий |
52. Слабые кислотные свойства фенола подтверждает реакция, схема которой
| 1) | C6H5ОН + Na→ | 3) | C6H5ОН + Br2→ |
| 2) | C6H5ОNa + CO2 + H2O→ | 4) | C6H5ОН + NaOH → |
53. Фенол вступает в реакцию поликонденсации с
| 1) | метаналем | 3) | метанолом |
| 2) | пропиленом | 4) | этиленгликолем |
54. Сумма коэффициентов в уравнении реакции взаимодействия фенола с натрием равна
| 1) | 4 | 2) | 5 | 3) | 6 | 4) | 7 |
55. Фенол взаимодействует с каждым из двух веществ
| 1) | CH4 и Сl2 | 3) | HCOH и HNO3 |
| 2) | O2 и H3PO4 | 4) | K и Na2SO4 |
56. С фенолом взаимодействует каждое из трех веществ
| 1) | C3H8, Аg, H2O | 3) | NaOH, Br2, H2 |
| 2) | Сu, KОН, H2SO4 конц. | 4) | H2O, HCl, АlBr3 |
57. Среда водного раствора этилата натрия
| 1) | щелочная | 2) | нейтральная | 3) | кислотная | 4) | слабокислая |
58. В водном растворе фенолята калия лакмус приобретает окраску
| 1) | желтую | 2) | красную | 3) | синюю | 4) | фиолетовую |
59. Фенол в отличие от глицерина взаимодействует с
| 1) | бромной водой | 3) | калием |
| 2) | азотной кислотой | 4) | гидроксидом меди(II) |
60. Этандиол-1,2 в отличие от фенола взаимодействует с
| 1) | азотной кислотой | 3) | гидроксидом калия |
| 2) | калием | 4) | гидроксидом меди(II) |
61. Глицерин в отличие от фенола взаимодействует с
| 1) | гидроксидом калия | 3) | азотной кислотой |
| 2) | бромоводородом | 4) | кислородом |
62. Фенолят калия можно получить в результате взаимодействия фенола с каждым из двух веществ
| 1) | К и КСl | 2) | КОН и К2SO4 | 3) | КBr и К2СО3 | 4) | К и КОН |
63. С каждым из трех веществ:
натрием, гидроксидом натрия, водородом –
может реагировать
| 1) | этанол | 2) | этиленгликоль | 3) | этилен | 4) | фенол |
64. Предельныеодноатомные спирты можно распознать с помощью
| 1) | оксида меди(II) | 3) | бромной воды |
| 2) | гидроксида меди(II) | 4) | раствора KMnO4 |
65. Фенол можно распознать с помощью
| 1) | оксида меди (II) | 3) | бромной воды |
| 2) | гидроксида меди (II) | 4) | фенолфталенина |
66. Многоатомные спирты можно отличить от одноатомных с помощью
| 1) | лакмуса | 3) | гидроксида калия |
| 2) | хлорида железа(III) | 4) | гидроксида меди(II) |
67. Этанол от глицерина можно отличить с помощью
| 1) | натрия | 3) | соляной кислоты |
| 2) | гидроксида натрия | 4) | гидроксида меди(II) |
68. Фенол от этанола можно отличить с помощью
| 1) | cульфата меди(II) | 3) | хлорида алюминия |
| 2) | хлорида железа(III) | 4) | гидроксида калия |
69. Раствор фенола можно отличить от раствора этиленгиколя с помощью
| 1) | натрия | 3) | бромной воды |
| 2) | хлорида натрия | 4) | фенолфталеина |
70. С гидроксидом натрия реагирует
| 1) | этанол | 2) | глицерин | 3) | фенол | 4) | ацетальдегид |
71. Гидроксид меди (II) взаимодействует с
| 1) | CH3ОН | 3) | CH2ОН ─ CH2ОН |
| 2) | СН3СН2ОН | 4) | СН3 ─ СНОН ─ СН3 |
72. И этанол, и глицерин взаимодействуют с
| 1) | раствором гидроксида натрия | 3) | гидроксидом меди(II) |
| 2) | натрием | 4) | медью |
73. И этанол, и фенол взаимодействуют с
| 1) | бромной водой | 3) | соляной кислотой |
| 2) | серебром | 4) | калием |
74. И глицерин, и фенол взаимодействуют с
| 1) | хлоридом железа(III) | 3) | гексаном |
| 2) | азотной кислотой | 4) | сульфатом меди(II) |
75. По реакции гидратации этанол можно получить из
| 1) | этилацетата | 3) | ацетилена |
| 2) | этаналя | 4) | этилена |
76. Основным способом получения этанола в промышленности является
| 1) | гидратация этилена | 3) | сухая перегонка древесины |
| 2) | окисление этана | 4) | гидролиз этилформиата |
77. Основным способом получения метанола в промышленности является
| 1) | сухая перегонка древесины |
| 2) | каталитическое взаимодействие Н2 с СО |
| 3) | гидролиз хлорметана |
| 4) | брожение углеводов |
78. Для смещения равновесия в сторону образования метанола
СО(г) + 2Н2(г)  СН3ОН(г) + Q
СН3ОН(г) + Q
необходимо одновременно
| 1) | увеличить температуру и уменьшить концентрацию исходных веществ |
| 2) | уменьшить температуру и уменьшить давление |
| 3) | увеличить температуру и уменьшить концентрацию метанола |
| 4) | уменьшить температуру и увеличить давления |
79. Какие из приведенных утверждений о промышленном способе получения метанола верны?
А. Применение катализатора в процессе синтеза метанола обусловлено необходимостью смещения равновесия в сторону продукта реакции.
Б. С целью значительного повышения выхода метанола применяют принцип циркуляции непрореагировавших исходных веществ.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
80. Пропанол-1 можно получить в результате реакции
| 1) | окисления пропаналя | 3) | гидратации пропена |
| 2) | гидрирования пропаналя | 4) | гидрирования пропанона |
81. Пропанол-2 можно получить в результате
| 1) | окисления пропанона | 3) | гидратации пропена |
| 2) | окисления пропаналя | 4) | гидрирования пропена |
82. Глицерин в промышленности получают в результате
| 1) | гидролиза крахмала | 3) | гидролиза жиров |
| 2) | гидрирования пропена | 4) | гидратации этилена |
83. Этиленгликоль образуется в результате гидролиза
| 1) | этилена | 3) | 1,1 дихлорэтана |
| 2) | 1,2-дихлорэтана | 4) | жиров |
84. Какие из утверждений о предельных одноатомных спиртах и их свойствах верны?
А. Спирты можно получить в результате гидратации алкинов.
Б. Температуры кипения и плавления спиртов выше, чем у углеводородов с тем же числом атомов углерода в молекуле.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
85. Какие из приведенных утверждений о спиртах верны?
А. Предельные одноатомные спирты изомерны карбоновым кислотам.
Б. При окислении первичных спиртов образуются альдегиды.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
86. Какие из утверждений о предельных одноатомных спиртах и их свойствах верны?
А. Спирты вступают в реакцию этерификации.
Б. В результате межмолекулярной дегидратации спиртов образуются простые эфиры.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
87. Какие из приведенных утверждений о предельных одноатомных спиртах и их свойствах верны?
А. При взаимодействии спиртов с карбоновыми кислотами образуются простые эфиры.
Б. Спирты способны вступать в реакции замещения.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
88. Какие из утверждений об этаноле и его свойствах верны?
А. Этанол вступает в реакцию с раствором гидроксида натрия.
Б. Среда водного раствора этанола нейтральна.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
89. Какие из утверждений о метаноле и его свойствах верны?
А. При окислении метанола оксидом меди(II) образуется формальдегид.
Б. Метанол чрезвычайно токсичен.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
90. Какие из утверждений о спиртах и их свойствах верны?
А. Водные растворы спиртов являются электролитами.
Б. В лаборатории спирты получают при нагревании галогеналканов со спиртовым раствором щелочи.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
91. Какие из утверждений о многоатомных спиртах и их свойствах верны?
А. Многоатомные спирты, как и одноатомные, реагируют активными металлами с выделением водорода.
Б. Качественной реакцией на многоатомные спирты является обесцвечивание бромной воды.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
92. Какие из утверждений об этиленгликоле и его свойствах верны?
А. Этиленгликоль смешивается с водой в любых соотношениях.
Б. Промышленным способом получения этиленгликоля является гидратация этилена.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
93. Какие из утверждений об этиленгликоле и его свойствах верны?
А. Этиленгликоль взаимодействует с гидроксидом меди(II) в щелочной среде с образованием раствора ярко-синего цвета.
Б. Этиленгликоль чрезвычайно ядовит.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
94. Какие из утверждений о глицерине и его свойствах верны?
А. При взаимодействии глицерина с азотной кислотой образуется сложный эфир.
Б. Глицерин можно отличить от этиленгликоля с помощью гидроксида меди(II).
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
95. Какие из приведенных утверждений о спиртах верны?
А. Многоатомные спирты в отличие от одноатомных реагируют с неорганическими и органическими кислотами
Б. Этиленгликоль – основной компонент антифризов.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
96. Какие из приведенных утверждений о спиртах верны?
А. Ароматические спирты содержат гидроксильную группу, непосредственно связанную с бензольным кольцом.
Б. Пропанол-1 образуется при гидратации пропена согласно правилу Марковникова.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
97. Какие из утверждений о феноле и его свойствах верны?
А. Атомы углерода в молекуле фенола находятся в состоянии sp2-гибридизации.
Б. Фенол взаимодействует с бромной водой.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
98. Какие из утверждений о феноле и его свойствах верны?
А. Фенол проявляет слабые кислотные свойства.
Б. Одним из промышленных способов получения фенола является щелочной гидролиз хлорбензола.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
99. Какие из утверждений о феноле и его свойствах верны?
А. Для фенола наиболее характерны реакции замещения.
Б. Фенол в отличие от этанола реагирует с бромоводородом.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
100. Какие из утверждений о феноле и его свойствах верны?
А. Фенол хорошо растворяется в холодной воде.
Б. При нитровании фенола образуется сложный эфир.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
101. Какие из утверждений о феноле и его свойствах верны?
А. Реакции замещения в бензольном кольце фенола протекают легче, чем у бензола.
Б. Фенол обладает антисептическими свойствами.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
102. Какие из утверждений о феноле и его свойствах верны?
А. Фенол – это бесцветная прозрачная жидкость с характерным запахом.
Б. Раствор фенола в воде называется карболовой кислотой.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
103. В схеме превращений
C2H2 → X→ C2H5OH
веществом Х является
| 1) | CH4 | 2) | C2H4 | 3) | C2H6 | 4) | C6H6 |
104. В схеме превращений
CО  X1
X1 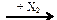 CH3ONa
CH3ONa
веществами Х1 и Х2 соответственно могут быть
| 1) | CH4 и NaOH | 3) | CH3OH и Na |
| 2) | CH3OH и NaCl | 4) | CH3OH и NaOH |
105. В схеме превращений
C2Н6  C2H5Cl
C2H5Cl  C2H5OH
C2H5OH
веществами Х1 и Х2 соответственно являются
| 1) | HCl и NaOH | 3) | Cl2 и Na |
| 2) | HCl и NaCl | 4) | Cl2 и NaOH |
106. В схеме превращений
С6Н5OH → Х  С6Н5OH
С6Н5OH
веществом Х является
| 1) | С6Н5Сl | 2) | С6Н5ONa | 3) | С6Н5СН3 | 4) | C6H6 |
107. В схеме превращений
С6Н5ONa  С6Н5OH
С6Н5OH  X2
X2
веществами Х1 и Х2 соответственно являются
| 1) | NaCl и С6Н11OН | 3) | H2O и С6Н13OН |
| 2) | НСl и С6Н11OН | 4) | H2O и С6Н6 |
108. В схеме превращений
бутанол-2 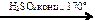 Х1
Х1 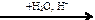 Х2
Х2
веществами Х1 и Х2 соответственно являются
| 1) | бутен-1 и бутанол-1 | 3) | бутен-2 и бутанол-2 |
| 2) | бутен-1 и бутаналь | 4) | бутен-2 и бутандиол-1,2 |
109. В схеме превращений
СН2=СН2  Х1
Х1  Х2
Х2
веществами Х1 и Х2 соответственно являются
| 1) | CH3CH2OH и CH3CH2ONa |
| 2) | CH3COH и CH3CH2ONa |
| 3) | СН≡СН и СNa≡СNa |
| 4) | СН2ОН-СН2ОН и СН2ОNa-СН2ОNa |
110. В результате реакции, термохимическое уравнение которой
С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1374 кДж,
выделилось 458 кДж теплоты. Объем (н.у.) вступившего в реакцию кислорода равен
| 1) | 72,2 | 2) | 67,2 л | 3) | 33,6 л | 4) | 22,4 л |
Повышенный уровень сложности
111. Установите соответствие между тривиальным названием спирта и его формулой
| ТРИВИАЛЬНОЕ НАЗВАНИЕ | ФОРМУЛА СПИРТА | ||||
| А) | древесный спирт | 1) | CH3CH2ОН | ||
| Б) | медицинский спирт | 2) | CH3ОН | ||
| В) | сорбит | 3) | CH2ОН─CHОН─CH2ОН | ||
| Г) | глицерин | 4) | CH2ОН─(CHОН)4─CH2ОН | ||
| А | Б | В | Г | ||
|
|
| ||||
112. Для этанола справедливы утверждения
| 1) | при обычных условиях – жидкость без запаха |
| 2) | является изомером диметилового эфира |
| 3) | водный раствор окрашивает лакмус в красный цвет |
| 4) | при дегидратации образует ацетилен |
| 5) | образуется в результате брожения глюкозы |
| 6) | обладает наркотическим действием |
113. Глицерин взаимодействует с
| 1) | хлороводородом | 4) | медью |
| 2) | водородом | 5) | уксусной кислотой |
| 3) | гидроксидом меди(II) | 6) | этаном |
114. Фенол взаимодействует с
| 1) | хлороводородом | 4) | бензолом |
| 2) | метаналем | 5) | гидроксидом натрия |
| 3) | азотной кислотой | 6) | метаном |
115. Химические свойства фенола неправильно описывают уравнения реакций
| 1) | C6H5ОН + NaОН→ C6H5ОNa + H2O |
| 2) | 2C6H5ОН + Na2CO3 → 2C6H5ОNa + CO2 + H2O |
| 3) | C6H5ОH + HCl → C6H5Cl + H2O |
| 4) | C6H5ОН + 3HNO3 → C6H2(NO2)3ОН +3 H2O |
| 5) | 2C6H5ОН + 2Na → 2C6H5ОNa + H2 |
| 6) | 2C6H5ОН + Cu(ОН)2 → (C6H5О)2Cu + 2H2O |
116. И фенол, и этиленгликоль взаимодействуют с
| 1) | хлороводородом | 4) | бензолом |
| 2) | хлоридом железа(III) | 5) | кислородом |
| 3) | азотной кислотой | 6) | калием |
117. И фенол, и глицерин взаимодействуют с
| 1) | азотной кислотой | 4) | натрием |
| 2) | гидроксидом меди(II) | 5) | гидроксидом натрия |
| 3) | бромной водой | 6) | кислородом |
118. Для этиленгликоля справедливы утверждения
| 1) | смешивается с водой в любых соотношениях |
| 2) | является изомером глицерина |
| 3) | водный раствор окрашивает лакмус в синий цвет |
| 4) | может быть получен из этилена по реакции Вагнера |
| 5) | обесцвечивает бромную воду |
| 6) | токсичен |
119. Для глицерина справедливы утверждения
| 1) | плохо растворяется в воде |
| 2) | окрашивает лакмус в красный цвет |
| 3) | способен к образованию простых и сложных эфиров |
| 4) | реагирует с гидроксидом меди(II) |
| 5) | обесцвечивает водный раствор перманганата калия |
| 6) | образуется в результате гидролиза жиров |
120. Для фенола справедливы утверждения
| 1) | при обычных условиях – кристаллическое вещество без запаха |
| 2) | все атомы углерода в молекуле находятся в sp2-гибридном состоянии |
| 3) | между молекулами образуются водородные связи |
| 4) | при взаимодействии с бромной водой образует осадок |
| 5) | устойчив к окислению на воздухе |
| 6) | в отличие от бензола не реагирует с азотной кислотой |
121. Установите соответствие между названием органического вещества и цвет лакмуса в его водном растворе
| НАЗВАНИЕ ВЕЩЕСТВА | ЦВЕТ ЛАКМУСА | ||||
| А) | фенол | 1) | фиолетовый | ||
| Б) | этиленгликоль | 2) | красный | ||
| В) | метанол | 3) | синий | ||
| Г) | фенолят натрия |
| |||
| А | Б | В | Г | ||
|
|
| ||||
122. При гидратации 44,8 л (н.у.) этилена с выходом 70% получили этанол, масса которого равна _________ г. (Запишите число с точностью до десятых.)
123. В результате гидратации пропилена с выходом 75% получили 300 г пропанола-2. Объем (н.у.) вступившего в реакцию пропилена равен _________ л. (Запишите число с точностью до целых.)
124. В результате межмолекулярной дегидратации 192 г метанола с выходом 60% получили простой эфир, масса которого составила _________ г. (Запишите число с точностью до десятых.)
125. При окислении 18, 4 г этанола оксидом меди(II) получили этаналь, масса которого составила _________ г. (Запишите число с точностью до десятых.)
126. Масса этанола, полученного в результате щелочного гидролиза 21,8 г бромэтана, равна _________ г. (Запишите число с точностью до десятых.)
127. Масса этиленгликоля, полученного в результате щелочного гидролиза 56,4 г 1,2-дибромэтана, равна _________ г. (Запишите число с точностью до десятых.)
128. Масса фенолята натрия, полученного при взаимодействии фенола массой 18,4 г с натрием массой 6,9 г, равна _________ г. (Запишите число с точностью до десятых.)
129. Объем (н.у.) водорода, который выделится при взаимодействии 73,6 г глицерина с избытком калия, равен _________ л. (Запишите число с точностью до сотых.)
130. При взаимодействии 0,94 г фенола с избытком бромной воды выпал осадок, масса которого равна _________ г. (Запишите число с точностью до сотых.)
131. При взаимодействии фенола с избытком бромной воды выпал осадок массой 13,24 г. Масса фенола, вступившего в реакцию, равна _________ г. (Запишите число с точностью до сотых.)
132. При полном сгорании 9,2 г этанола выделился углекислый газ, объем (н.у.) которого равен _________ г. (Запишите число с точностью до сотых.)
133. Для полного сгорания 12,8 г метанола необходим кислород, объем (н.у.) которого равен _________ л. (Запишите число с точностью до сотых.)
134. Для полного сгорания 23,5 г фенола необходим воздух, объем (н.у.) которого равен _________ л. (Запишите число с точностью до целых.)
135. Масса этиленгликоля, которая может полностью сгореть в кислороде объемом 11,2 л (н.у.), равна _________ г. (Запишите число с точностью до десятых.)
136. К 200 г 20%-ного раствора этанола добавили 150 г 30%-ного раствора того же вещества. Массовая доля этанола в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
137. Какой объем воды надо прилить к 300 г 20%-ного раствора этанола для получения 15%-ного раствора? Ответ: _________ мл. (Запишите число с точностью до целых.)
Высокий уровень сложности
138. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СО → СН3ОН → СН3Сl 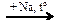 X → C2H4 → C2H5OH
X → C2H4 → C2H5OH
Укажите условия протекания реакций.
139. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al4С3 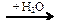 Х1 → CH3Cl
Х1 → CH3Cl  X2 → CH3-O-CH3 → CO2
X2 → CH3-O-CH3 → CO2
Укажите условия протекания реакций.
140. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
X1 → C2H2 → C2H4 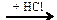 Х2
Х2  X3
X3 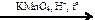 X4
X4
Укажите условия протекания реакций.
141. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
циклопропан → С3H8  Х1
Х1  Х2
Х2  X3 → X2
X3 → X2
Укажите условия протекания реакций.
142. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бутан  Х1
Х1 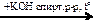 Х2
Х2  Х3
Х3  X4
X4  X5
X5
143. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C6H12O6 → C2H5OH 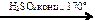 Х1
Х1 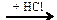 Х2 → X1
Х2 → X1 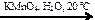 X3
X3
Укажите условия протекания реакций.
144. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С6H6  X1
X1  X2
X2 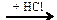 X3
X3  X4 → CO2
X4 → CO2
Укажите условия протекания реакций.
145. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
пропанол-1→ пропен  X1
X1 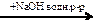 X2
X2 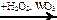 X3
X3  X4
X4
Укажите условия протекания 1-й реакции.
146. (С4) В результате дегидратации 13,8 г этанола с выходом 80% получили этен. Определите массу 5%-ного раствора перманганата калия, которую может обесцветить полученный в результате дегидратации этен.
147. (С4) Cмесь этанола и этиленгликоля массой 21,6 г при взаимодействии с избытком натрия выделяет водород, который способен полностью гидрировать фенол массой 9,4 г. Определите массовые доли этанола и этиленгликоля в исходной смеси.
148. (С4) К раствору фенола в бензоле добавили избыток бромной воды. Масса выпавшего осадка составила 3,31 г. Такую же массу раствора полностью сожгли. Минимальный объем 20%-ного раствора гидроксида натрия (плотность 1,22 г/мл), который необходим для поглощения образовавшегося углекислого газа, равен 108,2 мл. Определите массовую долю фенола в растворе.
149. (С4) К этанолу массой 2,3 г добавили 60 г горячего 15%-ного раствора перманганата калия, подкисленного серной кислотой. Раствор нагревали до полного окисления этанола в уксусную кислоту. Определите массовую долю перманганата калия в полученном после окончания реакции растворе.
150. (С5) Массовая доля кислорода в предельном двухатомном спирте равна 42,11%. Установите молекулярную формулу спирта.
151. (С5) Установите молекулярную формулу предельного двухатомного спирта, массовая доля углерода в котором в 1,5 раза больше массовой доли кислорода.
152.(С5) Для окисления предельного одноатомного спирта массой 3,7 г до альдегида потребовалось 4,0 г оксида меди(II). Определите молекулярную формулу спирта.
153.(С5) При взаимодействии предельного одноатомного спирта массой 3,52 г с избытком натрия выделилось 0,448 л водорода. Определите молекулярную формулу спирта.
154.(С5) При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определите молекулярную формулу спирта.
155. (С5) При сгорании предельного одноатомного спирта получили 26,4 г углекислого газа и 14,4 г воды. Установите молекулярную формулу спирта.
156. (С5) В результате межмолекулярной дегидратации предельного одноатомного спирта образовался простой эфир, массовая доля углерода в котором равна 52,17%. Установите молекулярную формулу спирта.
157. (С5) При сгорании предельного трехатомного спирта получили 1,12 л (н.у.) углекислого газа и 1,08 г воды. Установите молекулярную формулу спирта.
158.(С5) При взаимодействии гомолога фенола массой 9,76 г с избытком калия выделилось 0,896 л водорода. Определите молекулярную формулу гомолога фенола.
159. (С5) Установите молекулярную формулу органического вещества, если массовые доли углерода, водорода и кислорода в нем соответственно равны 60,00%, 13,33% и 26,67%. Плотность паров вещества по водороду равна 30.
160. (С5) При сгорании органического вещества массой 6,2 г получили 4,48 л углекислого газа (н.у.) и 5,4 г воды. Плотность паров вещества по азоту равна
2,214. Установите молекулярную формулу вещества.
161. При сгорании органического вещества массой 2,3 г получили 2,24 л углекислого газа (н.у.) и 2,7 г воды. Плотность паров вещества по метану равна 2,875. Установите молекулярную формулу вещества.
162. При сгорании органического вещества массой 4,8 г получили 3,36 л углекислого газа (н.у.) и 5,4 г воды. Плотность паров вещества по кислороду равна 1. Установите молекулярную формулу вещества.
Альдегиды и кетоны
Базовый уровень сложности
1. Состав предельных альдегидов выражается общей формулой
| 1) | CnH2n+2О | 2) | CnH2nО2 | 3) | CnH2nО | 4) | CnH2n-6О |
2. К карбонильным соединениям не относится
| 1) | этаналь | 2) | ацетон | 3) | бутанол | 4) | бутанон |
3. В молекуле пропаналя атомы углерода находятся в состоянии гибридизации
| 1) | только sp3 | 2) | только sp2 | 3) | sp3 и sp2 | 4) | sp3 и sp |
4.Число σ-связей в молекуле муравьиного альдегида равно
| 1) | 1 | 2) | 2 | 3) | 3 | 4) | 4 |
5. Число π-связей в молекуле муравьиного альдегида равно
| 1) | 1 | 2) | 2 | 3) | 3 | 4) | 4 |
6. Число π-связей в молекуле ацетона равно
| 1) | 1 | 2) | 2 | 3) | 3 | 4) | 4 |
7. Альдегиды изомерны
| 1) | предельным одноатомным спиртам |
| 2) | фенолам |
| 3) | предельным одноосновным карбоновым кислотам |
| 4) | кетонам |
8. Этаналь и ацетальдегид являются
| 1) | геометрическими изомерами | 3) | гомологами |
| 2) | межклассовыми изомерами | 4) | одним и тем же веществом |
9. При гидрировании альдегидов образуются
| 1) | первичные спирты | 3) | третичные спирты |
| 2) | вторичные спирты | 4) | карбоновые кислоты |
10. Продуктом восстановления кетонов являются
| 1) | карбоновые кислоты | 3) | вторичные спирты |
| 2) | первичные спирты | 4) | третичные спирты |
11. При восстановлении пропанона образуется
| 1) | пропанол-1 | 3) | пропановая кислота |
| 2) | пропанол-2 | 4) | пропаналь |
12. При восстановлении этаналя образуется
| 1) | этановая кислота | 3) | этанол |
| 2) | этиленгликоль | 4) | диэтиловый эфир |
13. При окислении бутаналя образуется
| 1) | масляная кислота | 3) | бутанол-1 |
| 2) | бутанон | 4) | бутанол-2 |
14. В реакции, схема которой
HCОН + X→ HCOOH + Cu2O + Н2О,
веществом Х может быть
| 1) | CuSO4 | 2) | CuO | 3) | Cu | 4) | Cu(OH)2 |
15. Реакция «серебряного зеркала» характерна для
| 1) | одноатомных спиртов | 3) | кетонов |
| 2) | многоатомных спиртов | 4) | альдегидов |
16. С аммиачным раствором оксида серебра взаимодействует каждое из двух веществ
| 1) | пропен и пропаналь | 3) | бутин-2 и пропанон |
| 2) | бутин-2 и бутаналь | 4) | бутин-1 и формальдегид |
17. С гидроксидом меди(II) взаимодействует каждое из двух веществ
| 1) | глицерин и бутанон | 3) | этиленгиколь и этаналь |
| 2) | бутанол-1 и бутаналь | 4) | пропин и пропаналь |
18. Уксусный альдегид взаимодействует с
| 1) | NaOH | 2) | Cu(OH)2 | 3) | C6H6 | 4) | SiO2 |
19. Метаналь взаимодействует с
| 1) | Na2SO4 | 2) | KCl | 3) | C6H5ОН | 4) | C3H8 |
20. И бутаналь, и бутанол-1 реагируют с
| 1) | Н2 | 2) | Cu(OH)2 | 3) | КОН | 4) | О2 |
21. И пропаналь, и пропанон реагируют с
| 1) | [Ag(NH3)2]OH | 2) | Н2 | 3) | Cu(OH)2 | 4) | С2Н6 |
22. С каждым из трех веществ:
Н2, [Ag(NH3)2]OH, Cu(OH)2 –
может реагировать
| 1) | изобутан | 2) | бутанол-1 | 3) | бутаналь | 4) | бутин-1 |
23. Для непредельного альдегида акролеина, формула которого
СН2=СН-СОН,
справедливо утверждение
| 1) | атомы углерода в молекуле находятся в sp3- и sp2-гибридном состоянии |
| 2) | вступает в реакцию полимеризации |
| 3) | продуктом гидрирования является пропанол-2 |
| 4) | наиболее характерны реакции замещения |
24. Для обнаружения альдегидов можно использовать каждое из двух веществ
| 1) | CuO и FeCl3 | 3) | Br2(водн.) и Cu(OH)2 |
| 2) | H2SO4 и NaOH | 4) | Cu(OH)2 и [Ag(NH3)2]OH |
25. Пропаналь можно отличить от пропанола-1 с помощью
| 1) | H2SO4 | 2) | NaOH | 3) | Cu(OH)2 | 4) | Br2(водн.) |
26. Метанол окисляется до формальдегида под действием
| 1) | водорода | 3) | хлорида железа(II) |
| 2) | оксида меди(II) | 4) | натрия |
27. Пропаналь можно получить в результате реакции
| 1) | гидрирования пропина | 3) | окисления пропанола-1 |
| 2) | гидратации пропина | 4) | восстановления пропанона |
28. Ацетон можно получить в результате реакции
| 1) | гидрирования ацетилена | 3) | окисления пропанола-1 |
| 2) | гидратации ацетилена | 4) | гидратации пропина |
29. Фенолформальдегидную смолу получают по реакции
| 1) | полимеризации | 3) | гидролиза |
| 2) | поликонденсации | 4) | гидратации |
30. Пропаналь в отличие от пропанона взаимодействует с
| 1) | Н2 | 2) | O2 | 3) | Cu(OH)2 | 4) | CuSO4 |
31. Какие из приведенных утверждений об альдегидах и кетонах верны?
А. Температуры кипения и плавления альдегидов и кетонов выше, чем у спиртов с тем же числом атомов углерода в молекуле.
Б. При гидрировании альдегидов и кетонов образуются карбоновые кислоты.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
32. Какие из приведенных утверждений об альдегидах и кетонах верны?
А. Атом углерода в карбонильной группе находится в sp2-гибридном состоянии.
Б. При окислении альдегидов и кетонов образуются спирты.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
33. Какие из приведенных утверждений об альдегидах и кетонах верны?
А. Альдегиды и кетоны – структурные изомеры одного класса.
Б. Качественной реакцией на альдегиды и кетоны является реакция «серебряного зеркала».
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
34. Какие из приведенных утверждений об альдегидах и их свойствах верны?
А. Альдегиды способны вступать в реакции восстановления и окисления.
Б. Формальдегид и ацетальдегид токсичны.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
35. Какие из приведенных утверждений об альдегидах и их свойствах верны?
А. Между молекулами альдегидов водородные связи практически не образуются.
Б. Низшие альдегиды вступают в реакцию полимеризации.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
36. Какие из приведенных утверждений о метанале и его свойствах верны?
А. Метаналь способен вступать в реакцию полимеризации.
Б. 40%-ный водный раствор метаналя называется формалином.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
37. Какие из приведенных утверждений о формальдегиде и его свойствах верны?
А. Формальдегид – газ с резким запахом.
Б. Формальдегид вступает в реакцию поликонденсации с фенолом.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
38. В схеме превращений
C2H2 → X → CH3COOH
веществом Х может быть
| 1) | этен | 2) | хлорэтан | 3) | этанол | 4) | этаналь |
39. В схеме превращений
CH2=CH─CH3 → X → CH3COCH3
веществом Х может быть
| 1) | CH2Сl─CH2─CH3 | 3) | CH2OH─CH2─CH3 |
| 2) | CH3─CHСl─CH3 | 4) | CH3─CHOH─CH3 |
40. В схеме превращений
C2H2  X1
X1  Х2
Х2
веществами Х1 и Х2 соответственно являются
| 1) | C2H5OH и СН3СОН | 3) | СН3СОН и С2Н4 |
| 2) | СН3СООН и СН3СОН | 4) | СН3СОН и C2H5OH |
41. В схеме превращений
C2H5ОН  X1
X1  X2
X2
веществами Х1 и Х2 соответственно могут быть
| 1) | СН3СООН и (СН3СОО)2Сu | 3) | СН3СОН и CH3COOH |
| 2) | CH2OH-CH2OH и CH3COOH | 4) | CH3COOH и CH3COOС2Н5 |
4 2 . В схеме превращений
СН3СОН  X1
X1 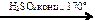 X2
X2
веществами Х1 и Х2 соответственно могут быть
| 1) | СН3СН2OH и C2H4 | 3) | СН3СОOН и CO2 |
| 2) | СН3СН2OH и CH3CH2-O-CH2CH3 | 4) | CH3COOH и CH3COOСН3 |
Повышенный уровень сложности
43. Установите соответствие между тривиальным названием органического вещества и его формулой
| ТРИВИАЛЬНОЕ НАЗВАНИЕ | ФОРМУЛА СПИРТА | ||||
| А) | муравьиный альдегид | 1) | CH3CН2ОН | ||
| Б) | уксусный альдегид | 2) | HCОН | ||
| В) | бензальдегид | 3) | CH3─CО─CH3 | ||
| Г) | ацетон | 4) | C6H5CОН | ||
|
| 5) | CH3CОН | |||
| А | Б | В | Г | ||
|
|
| ||||
44. Только в состоянии sp3-гибридизации атомы углерода находятся в молекулах
| 1) | пропанола-2 | 4) | пропана |
| 2) | пропаналя | 5) | циклогексана |
| 3) | фенола | 6) | пропанона |
45. В состоянии sp3- и sp2-гибридизации атомы углерода находятся в молекулах
| 1) | бутаналя | 4) | пропина |
| 2) | толуола | 5) | метаналя |
| 3) | фенола | 6) | бутанона |
46. В реакцию полимеризации способны вступать
| 1) | толуол | 4) | метаналь |
| 2) | стирол | 5) | бензол |
| 3) | фенол | 6) | хлорвинил |
47. С аммиачным раствором оксида серебра взаимодействуют
| 1) | бутин-1 | 4) | глицерин |
| 2) | бутанон | 5) | формальдегид |
| 3) | бутаналь | 6) | бутин-2 |
48. С гидроксидом меди(II) взаимодействуют
| 1) | пропанол-2 | 4) | пропен |
| 2) | бензальдегид | 5) | пропаналь |
| 3) | глицерин | 6) | пропанон |
49. Установите соответствие между схемой реакции и продуктом окисления органического вещества
| СХЕМА РЕАКЦИИ | ПРОДУКТЫ ОКИСЛЕНИЯ | ||
| А) | CH3CОН + KMnO4 + H2O 
| 1) | муравьиная кислота |
| Б) | CH3CОН + KMnO4 + H2SO4 
| 2) | СH2OH-СН2ОН |
| В) | CH3CОН + Сu(OН)2 
| 3) | СH2OК-СН2ОК |
| Г) | CH3CH2ОН + CuО 
| 4) | CH3CОН |
| 5) | CH3COОН | ||
| 6) | CH3CООК | ||
50. Формальдегид взаимодействует с
| 1) | Cu(OH)2 | 4) | С6Н6 |
| 2) | H2 | 5) | NaOH |
| 3) | K | 6) | С6Н5ОН |
51. Пропаналь взаимодействует с
| 1) | O2 | 4) | KMnO4 |
| 2) | [Ag(NH3)2]OH | 5) | CH3OCH3 |
| 3) | КСl | 6) | N2 |
52. Ацетальдегид взаимодействует с
| 1) | Cu | 4) | С6Н5CH3 |
| 2) | Cl2 | 5) | CaO |
| 3) | HCN | 6) | K2Cr2O7 |
53. И муравьиный, и прoпионовый альдегид могут взаимодействовать с
| 1) | гидроксидом кальция |
| 2) | хлоридом натрия |
| 3) | водородом |
| 4) | этаном |
| 5) | кислородом |
| 6) | аммиачным раствором оксида серебра |
54. Для метаналя справедливы утверждения
| 1) | при обычных условиях – жидкость с резким запахом |
| 2) | 40%-ный водный раствор называется формалином |
| 3) | окисляется с большим трудом |
| 4) | продуктом гидрирования является метановая кислота |
| 5) | вступает в реакцию поликонденсации с фенолом |
| 6) | является токсичным веществом |
55. Для ацетальдегида справедливы утверждения
| 1) | при обычных условиях – газ без запаха |
| 2) | между молекулами образуются водородные связи |
| 3) | является изомером ацетона |
| 4) | продуктом гидрирования является этанол |
| 5) | вступает в реакцию «серебряного зеркала» |
| 6) | окисляется гидроксидом меди(II) до уксусной кислоты |
56. И для пропаналя, и для пропанона справедливы утверждения
| 1) | относятся к классу карбонильных соединений |
| 2) | состав выражается формулой С3Н6О |
| 3) | могут быть получены по реакции Кучерова |
| 4) | при обычных условиях являются жидкостями |
| 5) | вступают в реакцию «серебряного зеркала» |
| 6) | окисляются гидроксидом меди(II) до пропановой кислоты |
57. При взаимодействии уксусного альдегида с избытком аммиачного раствора оксида серебра выпал осадок массой 2,16 г. Масса уксусного альдегида, вступившего в реакцию, равна _________ г. (Запишите число с точностью до сотых.)
58. При взаимодействии уксусного альдегида массой 1,32 г с избытком аммиачного раствора оксида серебра выпал осадок, масса которого равна _________ г. (Запишите число с точностью до сотых.)
59. По реакции Кучерова с выходом 70% получили 61,6 г ацетальдегида. Объем (н.у.) ацетилена, вступившего в реакцию, равен _________ л. (Запишите число с точностью до десятых.)
60. Для восстановления пропаналя массой 29 г необходим водород, объем (н.у.) которого равен _________ л. (Запишите число с точностью до десятых.)
61. Масса этаналя, которая может полностью сгореть в кислороде объемом 5,6 л (н.у.), равна _________ г. (Запишите число с точностью до десятых.)
62. Объем углекислого газа (н.у.), который выделяется при полном сгорании пропаналя массой 5,8 г, равен _________ л. (Запишите число с точностью до сотых.)
63. Объем кислорода (н.у.), который необходим для полного сгорания пропаналя массой 2,9 г, равен _________ л. (Запишите число с точностью до сотых.)
64. Объем воздуха (н.у.), который необходим для полного сгорания метаналя массой 60 г, равен _________ л. (Запишите число с точностью до целых.)
65. В 150 г воды растворили 17,92 л (н.у.) метаналя. Массовая доля метаналя в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
66. Для получения формалина – 40%-ного водного раствора формальдегида – в 120 г воды надо растворить формальдегид, масса которого равна _________ л. (Запишите число с точностью до целых.)
Высокий уровень сложности
67. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Х1 → С2Н2  X2
X2  Х3
Х3  X2
X2  X4
X4
68. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СН3СН2СН2СООNa → С3Н8  X1
X1  Х2
Х2  X3 → CO2
X3 → CO2
Укажите условия протекания реакций.
69. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al4C3 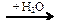 X1 → CH3Br → CH3OH → HCOH
X1 → CH3Br → CH3OH → HCOH  X2
X2
Укажите условия протекания реакций.
70. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2H5Br 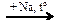 X1
X1  X2
X2  X3
X3  X4
X4 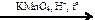 X5
X5
Укажите условия протекания реакций.
71. (С3) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бензол → метилбензол 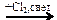 X1
X1  Х2
Х2  X3
X3  X4
X4
Укажите условия протекания первой реакции.
72. (С4) Бутаналь массой 28,8 г частично окислили в бутановую кислоту. Для нейтрализации полученной кислоты затратили 46,2 мл 24%-ного раствора гидроксида натрия (плотность 1,263 г/мл). Определите массу бутаналя, не подвергшегося окислению.
73. (С4) К 20 г водного раствора формальдегида добавили избыток аммиачного раствора оксида серебра и смесь слегка нагрели. Серебро, выделившееся в результате реакции, полностью растворили в концентрированной азотной кислоте, при этом выделилось 17,92 л (н.у.) газа. Определите массовую долю формальдегида в исходном растворе.
74. (С4) Смесь уксусного и пропионового альдегида массой 1,17 г полностью окислили до соответствующих кислот гидроксидом меди(II), который был получен в результате взаимодействия между 16%-ным раствором сульфата меди(II) массой 50 г и 10%-ным раствором гидроксида натрия массой 80 г. Определите массовые доли альдегидов в исходной смеси.
75. (С4) Уксусный альдегид массой 1,32 г обработали 5-%-ным раствором бихромата калия в сернокислотной среде массой 117,6 г. Определите массовую долю бихромата калия в растворе после окончания реакции.
76. (С5) Массовая доля углерода в предельном альдегиде равна 62,07%. Установите молекулярную формулу альдегида.
77. (С5) Массовая доля кислорода в предельном альдегиде равна 27,59%. Установите молекулярную формулу альдегида.
78. (С5) Установите молекулярную формулу предельного альдегида, массовая доля углерода в котором в 3,75 раза больше массовой доли кислорода.
79. (С5) Для окисления предельного альдегида массой 2,9 г до соответствующей кислоты потребовалось 9,8 г гидроксида меди(II). Определите молекулярную формулу альдегида.
80. (С5) При окислении 2,88 г предельного альдегида избытком аммиачного раствора оксида серебра выделилось 8,64 г серебра. Установите молекулярную формулу альдегида.
81. (С5) При полном сгорании 4,3 г предельного альдегида выделилось 4,5 г воды. Установите молекулярную формулу альдегида.
82. (С5) При сгорании органического вещества массой 6,6 г получили 6,72 л углекислого газа (н.у.) и 5,4 г воды. Плотность паров вещества по кислороду равна 1,375. Установите молекулярную формулу вещества.
83. (С5) При сгорании органического вещества массой 8,7 г получили 19,8 г углекислого газа (н.у.) и 8,1 г воды. Плотность паров вещества по азоту равна 2,071. Установите молекулярную формулу вещества.
84. При сгорании органического вещества массой 4,5 г получили 3,36 л углекислого газа (н.у.) и 2,7 г воды. Плотность паров вещества по метану равна 1,875. Установите молекулярную формулу вещества.
Дата добавления: 2019-01-14; просмотров: 8389; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
