Заключительный (городской) этап. Теоретический тур
Класс
№ 1
Решение:
Пример смеси: железные опилки, медные опилки, растительное масло, растворимая соль.
Последовательность действий:
1) действие магнитом – только железо притягивается магнитом;
2) добавление воды позволит отделить соль, растворитель впоследствии можно выпарить;
3) фильтрацией отделяем медные опилки, всё остальное остается в растворе;
4) отстаиваем полученную смесь и разделяем с помощью делительной воронки, так как масло и вода плохо смешиваются;
5) выпариваем воду на спиртовке, таким образом отделяем растворимую соль от воды.
Рекомендации к оцениванию:
1) Пример смеси 4 балла = 4 балла
2) Схема разделения 6 баллов = 6 баллов
ИТОГО 10 баллов
№ 2
Решение:
1) 6Li + 3N2 → 2Li3N;
2) 2ZnS + 3O2 → 2ZnO + 2SO2;
3) V2O5 + 5H2 → 2V + 5H2O; (или образование низших оксидов ванадия: VO, V2O3)
4) 2Al + 3Br2 → 2AlBr3.
Всего в записях уравнений химических реакций фигурирует 7 сложных веществ: Li3N (нитрид лития), V2O5 (оксид ванадия (V)), H2O (оксид водорода, вода), ZnS (сульфид цинка), ZnO (оксид цинка), SO2 (оксид серы (IV)), AlBr3 (бромид алюминия).
Рекомендации к оцениванию:
|
|
|
1) Верно определены продукты реакций по 0,75 балла 0,75∙4 = 3 балла
2) Каждая уравненная реакция по 1 баллу 1∙4 = 4 балла
3) Правильное название сложного вещества по 0,75 балла 0,75∙4 = 3 балла
ИТОГО 10 баллов
№ 3
Решение:
1) Молярная масса эквимолярной смеси газов A и B равна 1,125∙32 = 36 г/моль. Молярная масса одного оксида должна быть меньше 36. В его составе должен быть как минимум один атом кислорода, т.е. M(X) < 36 – 16 = 20. Только два элемента в этом диапазоне образуют газообразные оксиды – это углерод и азот:
| CO | CO2 | NO | N2O | NO2 | |
| M, г/моль | 28 | 44 | 30 | 44 | 46 |
Легко показать, что эквимолярная смесь оксидов будет иметь молярную массу 36 г/моль только в случае углерода: (28 + 44)/2 = 36. Таким образом, X – C, A – CO, B – CO2.
2) Вещества, состоящие только из атомов углерода: графит, алмаз, сажа (аморфный углерод), фуллерен и др. – аллотропные модификации углерода.
3) При сжигании углерода на воздухе образуется оксид углерода (IV):
|
|
|
С + O2 → СO2
Оксид углерода (II) может быть получен в недостатке кислорода при более высокой температуре (например, в печи при закрытой заслонке происходит неполное сгорание угля):
2С + O2 → 2СO
Рекомендации к оцениванию:
1) Обоснование, что элемент X – углерод 1 балл = 1 балл
2) X – 0,5 балла, A и B по 1 баллу 0,5 + 1∙2 = 2,5 балла
3) Понятие аллотропной модификации 0,75 балла = 0,75 балла
4) Примеры аллотропных модификаций по 0,75 баллу 0,75∙3 = 2,25 балла
5) Реакции образования CO и CO2 по 1 баллу 1∙2 = 2 балла
6) Указания образования на воздухе CO2 0,5 балла = 0,5 балла
7) Объяснение образования CO 1 балл = 1 балл
ИТОГО 10 баллов
№ 4
|
|
|
Решение
1 способ
Используем пропорциональность масс и молярных масс двух веществ.
1) Рассчитаем массу активной формы в одной таблетке:
m(FeSO4) = M(FeSO4)∙m(Fe)/M(Fe) = 152∙40/56 = 108,6 мг
Пациенту нужно принять 21 таблетку, т.е. 2,28 г FeSO4.
2) Рассчитаем массу активной формы по известной массе сырья, учитывая, что из 1 формульной единицы Fe2O3 можно получить 2 формульных единицы FeSO4:
m(FeSO4) = 2∙M(FeSO4)∙m(Fe2O3)/M(Fe2O3) = 2∙152∙0,9143/160 = 1,737 г.
Примечание. Можно вести расчет не напрямую, а по массе Fe2O3 рассчитать массу Fe, затем как в действии 1.
3) Рассчитаем число полученных таблеток: 1737/108,6 = 16.
Этого хватит на 5 дней + 1 таблетка.
2 способ: расчёты ведутся по количеству вещества.
Рекомендации к оцениванию:
1) Расчёт массы FeSO4 в 1 таблетке 2 балла = 2 балла
2) Расчёт числа назначенных таблеток 1 балл = 1 балл
3)Расчёт массы FeSO4 в назначенных таблетках 2 балла = 2 балла
4) Расчёт массы FeSO4 из массы сырья 3 балла = 3 балла
5) Расчёт числа полученных таблеток 1 балл = 1 балл
|
|
|
6) Оценка срока приёма 1 балл = 1 балл
ИТОГО 10 баллов
№ 5
Решение:
1) ω(Au) = 1,95/(1,95 + 0,26 + 0,39) = 0,75 (75%) соответствует 750 пробе.
Массу изделия 585 пробы будет определять количество золота, содержащегося в предыдущем изделии (1,95 г): 1,95∙100/58,8 = 3,33 г.
2) Золото – красивое, пластичное, ковкое, не окисляется, но очень мягкое, легко царапается. Украшения из чистого золота быстро изнашиваются, теряют свой вид, могут сломаться. Поэтому при производстве ювелирных изделий используют сплавы золота со специальными добавками (лигатурами). Золото 999 пробы используют Центробанки многих стран мира для формирования государственного золотого запаса.
3) Заметим, что еще 100 – 39,76 – 21,49 = 38,75% приходится на некий неизвестный элемент. Скорее всего, это кислород. Принимая формула соли AuxSeyOz, найдем отношение индексов элементов x : y : z = 47,9/197 : 28,8/79 : 23,3/16 = 0,243 : 0,365 : 1,456 = 1 : 1,5 : 6 = 2 : 3 : 12.
Соль – селенат золота (III) Au2(SeO4)3, кислота X – селеновая H2SeO4 (сильная кислота, аналог серной кислоты, и сильный окислитель).
Рекомендации к оцениванию:
1) Массовая доля золота, проба, новая масса сплава по 1 баллу 1∙3 = 3 балла
2) Объяснение добавки лигатур и использования золота 999 пробы по 1 баллу 1∙2 = 2 балла
3) Предположение о третьем элементе – кислороде 0,5 балла = 0,5 балла
4) Расчет индексов элементов в формуле соли 2 балла = 2 балла
5) Формулы соли и кислоты по 0,5 балла 0,5∙2 = 1 балл
6) Названия кислоты и соли по 0,75 балла 0,75∙2 = 1,5 балла
ИТОГО 10 баллов
№ 6
Решение:
Уравнение реакции, протекающей при смешивании растворов:
BaCl2 + H2SO4 → 2HCl + BaSO4↓
Количества исходных веществ:
ν(BaCl2) = 156∙0,08/208 = 0,06 моль
ν(H2SO4) = 49∙0,16/98 = 0,08 моль
ν(BaCl2) < ν(H2SO4), расчет ведем по BaCl2.
Вычислим количество выпавшего осадка и его массу ν(BaSO4) = ν(BaCl2) = 0,06 моль; m(BaSO4) = 0,06∙233 = 13,98 г ≈ 14 г.
После протекания реакции в растворе присутствует образовавшийся хлороводород и не полностью прореагировавшая серная кислота:
ν(HCl) = 2ν(BaCl2) = 0,12 моль; m(HCl) = 0,12∙36,5 = 4,38 г
ν(H2SO4) = 0,08 – 0,06 = 0,02 моль; m(H2SO4) = 0,02∙98 = 1,96 г
При вычислении массы раствора необходимо учесть массу выпавшего осадка, который не входит в раствор: 156 + 49 – 14 = 191 г.
ω(HCl) = 4,38∙100/191 = 2,3%
ω(H2SO4) = 1,96∙100/191 = 1,0%
Рекомендации к оцениванию:
1) Уравнение реакции 1,5 балла = 1,5 балла
2) Количества исходных веществ по 1 баллу 1∙2 = 2 балла
3) Вывод о расчете по BaCl2 0,5 балла = 0,5 балла
4) Масса осадка 1 балл = 1 балл
5) Вывод о составе раствора 0,5 балла = 0,5 балла
6) Количества веществ оставшихся в растворе по 0,75 балла 0,75∙2 = 1,5 балла
7) Расчет массовых долей растворенных веществ по 1,5 балла 1,5∙2 = 3 балла
* Правильные элементы решения с арифметическими ошибками, а также расчеты массовых долей без учета массы выпавшего осадка оцениваются в 50% баллов за соответствующий элемент решения.
ИТОГО 10 баллов
№ 7
Решение:
1) При электролизе воды водорода получается в 2 раза больше, чем кислорода. При плотности водорода 2/22,4 = 0,09 г/л, масса шарика с медведем 10000 + 0,09∙11200 = 11008 г, а масса воздуха, вытесненного шаром заметно больше: 11200∙1,29 = 14448 г. Шар с Винни-Пухом должен взлететь.
2) Электролиз протекает по уравнению реакции: 2H2O = 2H2 + O2, причем 11,2 м3 соответствует 11200/22,4 = 500 моль водорода, воды то же количество, а ее масса – 18∙500 = 9000 г (9 л).
3) Продувал в очаг, поджигая тлеющий уголь: C + O2 = CO2
4) См. выше.
Рекомендации к оцениванию:
1) Сможет ли медвежонок взлететь (с расчётом) 4 балла = 4 балла
2) Масса воды 4 балла = 4 балла
3) Использование кислорода 1 балл = 1 балл
4) Уравнения реакций по 0,5 балла 0,5∙2 = 1 балл
ИТОГО 10 баллов
Класс
№ 1
Решение:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn → 2NaOH → H2
Так как между диаметром шара и объемом кубическая зависимость, то при уменьшении диаметра шарика в 2 раза, объем, а значит, и масса шарика уменьшится в 8 раз. Масса оставшегося шарика: 12/8 = 1,5 г.
Масса вступившего в реакцию Zn: 12 – 1,5 = 10,5 г.
Масса вступившего в реакцию NaOH: (10,5/65,4)∙2∙40 = 12,84 г.
Масса выделившегося водорода: (10,5/65,4)∙2 = 0,32 г.
Пусть а – масса исходного раствора NaOH, тогда масса NaOH в исходном растворе: 0,2а.
Масса NaOH в конечном растворе: 0,15(а + 10,5 – 0,32) = 0,15а + 1,527
По условию: 0,2а – (0,15а + 1,527) = 12,84. Отсюда, а = 287,3 г.
Рекомендации к оцениванию:
1) Уравнение реакции 2 балла = 2 балла
2) Масса оставшегося шарика 2 балла = 2 балла
3) Масса растворившегося шарика 1 балл = 1 балл
4) Масса NaOH в конечном растворе 2 балла = 2 балла
5) Масса исходного раствора 3 балла = 3 балла
ИТОГО 10 баллов
№ 2
Решение :
1) В кислой среде:
10H2SO4+ 3SnCl2 + K2Cr2O7 = 3Sn(SO4)2 + Cr2(SO4)3 + K2SO4 + 6HCl + 7H2O
14Н+ + 3Sn2+ + Cr2O72– = 3Sn4+ + 2Cr3+ + 7H2O
темно-зеленый раствор
(возможно частичное выпадение SnО2 или Н2SnО3)
2) В щелочной среде:
12КОН + 3SnCl2 + K2Cr2O7 + 7H2O = 3K2[Sn(ОH)6] + 2К[Cr(OH)4] + 6KCl
12ОН– + 3Sn2+ + Cr2O72– + 7H2O = 3[Sn(ОH)6]2– + 2[Cr(OH)4]–
изумрудно-зеленый раствор
3) При недостатке SnCl2 в дополнение к реакции в п.2 протекает реакция:
K2Cr2O7 + 2КОН = 2K2CrO4 + H2O
Cr2O72– + 2ОН– = 2CrO42– + H2O
4) При недостатке K2Cr2O7 в дополнение к реакции в п.2 протекает реакция:
SnCl2 + 4КОН = К2[Sn(OH)4] + 2KCl
Sn2+ + 4ОН– = [Sn(OH)4]2–
Рекомендации к оцениванию:
1) За каждый вариант в молекулярном и ионном видах по 2,5 балла 2,5∙4 = 10 баллов
(если только в молекулярном виде, то за каждый вариант по 2 балла)
ИТОГО 10 баллов
№ 3
Решение:
1) Рассчитаем массовую долю MgSO4 в кристаллогидрате:
ω(MgSO4)к/г = M(MgSO4)/M(MgSO4∙7H2O) = 120/246 = 0,4878
Рассчитаем массовую долю MgSO4 в концентрате (раствор 1). Обозначим массу воды x г, тогда масса добавленного в неё кристаллогидрата – 4,55xг. Тогда:
ω(MgSO4)р-р1 = 0,4878∙4,55x/(x + 4,55x) = 0,4
2) Обозначим массу воды y г, тогда массовая доля MgSO4 в конечном растворе (раствор 2) будет рассчитываться следующим образом:
ω(MgSO4)р-р2 = m(MgSO4)/[mр-ра1 + y], откуда y = [m(MgSO4)/ω(MgSO4)р-р2] – mр-ра1
m(MgSO4) = 27∙0,4 = 10,8 г
Отсюда следует, что ymax = 27 г (для 20%), ymin = 18 г (для 24%).
Кристаллогидрат MgSO4∙7H2O – «английская» или «горькая» соль.
Рекомендации к оцениванию:
1) Расчёт массовой доли MgSO4 в кристаллогидрате 2 балла = 2 балла
2) Расчёт массовой доли MgSO4 в растворе-концентрате 2 балла = 2 балла
3) Расчёт массы вещества в порции кристаллогидрата 1 балл = 1 балл
4) Формула + расчёт массы воды для разбавления 4 балла = 4 балла
5) Английская соль 1 балл = 1 балл
ИТОГО 10 баллов
№ 4
Решение:
А) три осадка:
ВаS + ZnSO4 + CuSO4 → BaSO4↓ + ZnS↓ + CuS↓
CaCl2 + AgF + BaCl2 → CaF2↓ + AgCl↓ + BaF2↓
Б) четыре осадка:
CaCl2 + AgF + Pb(NO3)2 → CaF2↓ + AgCl ↓ + PbCl2↓ + PbF2↓
CaCl2 + AgF + BaS → CaF2↓ + CaS↓ + AgCl↓ + Ag2S↓
В) пять осадков:
CaCl2 + AgF + CuSO4 → CaF2↓ + AgCl↓ + CaSO4↓ + Ag2SО4↓ + CuF2↓
(необходима достаточная концентрация исходных растворов, чтобы малорастворимые CaSO4 и Ag2SО4 также выпадали в осадок)
Г) шесть осадков получится при сливании достаточно концентрированных растворов:
ВаS + ZnSO4 + AgF → BaSO4↓ + BaF2↓ + ZnS↓ + ZnF2↓ + Ag2S↓+ Ag2SО4↓
Рекомендации к оцениванию:
1) За каждый вариант ответа с комментарием по 2,5 балла 2,5∙4 = 10 баллов
ИТОГО 10 баллов
№ 5
Решение:
1) Пусть общая формула кислоты HX, где X – кислотный остаток. Т.к. кислота одноосновная, M(HX) = 100/2,13 = 47 г/моль. В натриевой соли NaX ω(Na) = 23·100/(47 – 1 + 23) = 33,33%.
2) Степень диссоциации α = 100·Nдисс./Nобщ., где Nдисс. – число продиссоциировавших молекул, Nобщ. – общее исходное число молекул.
Уравнение диссоциации в общем виде: HX = H+ + X-. Таким образом, в растворе будут присутствовать непродиссоциировавшая форма HX, и ионы H+ и X-. N(HX) + N(H+) + N(X-) = 3,34·1022 по условию. Количество кислоты ν = 250·0,01/47 = 5,32·10-2 моль. Nобщ. = 5,32·10-2·6,02·1023 = 3,20·1022 = N(HX) + N(X-). Nдисс. = N(H+) = N(X-) = 3,34·1022 – 3,20·1022 = 1,40·1021. α = 100·1,40·1021/3,20·1022 = 4,4%. Т.к. степень диссоциации небольшая, можно сделать вывод, что кислота слабая.
3) Молярная масса кислотного остатка M(X) = 47 – 1 = 46 г/моль. По всей видимости, искомая кислота кислородсодержащая. Представим ее формулу как HЭaOb. M(HЭaOb) = 1 + aM(Э) + 16b = 47. M(Э) = (46 – 16b)/a, причем заметим, что b может принимать только два значения: 1 и 2, иначе M(Э) < 0, чего быть не может.
| b | a | M( Э) | Формула кислоты |
| 1 | 1 | 30 | - |
| 1 | 2 | 15 | - |
| 1 | 3 | 10 | - |
| 2 | 1 | 14 | HNO2 |
| 2 | 2 | 7 | - |
Таким образом, искомая кислота – азотистая HNO 2.
Рекомендации к оцениванию:
1) Расчет молярной массы кислоты 1 балл = 1 балл
2) Расчет массовой доли натрия 1 балл = 1 балл
3) Уравнение диссоциации 1 балл = 1 балл
4) Формула для расчета степени диссоциации 1 балл = 1 балл
5) Расчет степени диссоциации 3 балла = 3 балла
6) Вывод о силе кислоты 1 балл = 1 балл
7) Вывод формулы азотистой кислоты 2 балла = 2 балла
Замечание: возможно установление формулы кислоты подбором, но в этом случае должна быть выполнена проверка на соответствие молярной массе, в противном случае ставится 0,5 балла).
ИТОГО 10 баллов
№ 6
Решение:
Выделение газа, образование осадка и одновременное изменение окраски возможно только при окислительно-восстановительном процессе.Возможные варианты:
1) Иодоводородная кислота (HI) – сильная кислота и восстановитель.
2Cu(NO3)2 + 16HI = 2CuI↓ + 4NO↑ + 7I2 + 8H2O
Голубая окраска соли меди изменится, так как получится бурый раствор иода.
2) Фосфорноватистая кислота – H3PO2
Cu(NO3)2 + 2H3PO2 = Cu↓ + 2NO↑ + 2H3PO4
Рекомендации к оцениванию:
1) Два варианта кислот по 3 балла 3∙2 = 6 баллов
2) Уравнения реакций по 2 балла 2∙2 = 4 балла
ИТОГО 10 баллов
№ 7
Решение:
1. Белый осадок в растворе азотной кислоты – сульфат бария.
Количество сульфата бария: 17,475/233 = 0,075 моль.
Если исходное вещество сульфат, то на долю кислотного остатка (SO42–) в исходной массе вещества должно приходиться: 96∙0,075 = 7,2 г, а на долю металла: 11,85 – 7,2 = 4,65 г.
Находим молярную массу металла:
а) для одновалентного металла: 0,5∙4,65/0,075 = 31 г/моль – такого металла нет;
б) для двухвалентного металла: 4,65/0,075 = 62 г/моль – такого металла нет;
в) для трехвалентного металла: 1,5∙4,65/0,075 = 93 г/моль. Эта молярная масса соответствует ниобию, но степень окисления +3 не характерна для ниобия.
Значит, исходное вещество не может быть сульфатом.
2. Вероятно, исходное вещество сульфит, который легко окисляется азотной кислотой до сульфата.
Масса кислотного остатка SO32– в исходной массе вещества: 80∙0,075 = 6,0 г. На долю металла: 11,85 – 6,0 = 5,85 г.
Находим молярную массу металла:
а) для одновалентного металла: 0,5∙5,85/0,075 = 39,0 г/моль. Эта молярная масса соответствует калию.
б) для двухвалентного металла: 5,85/0,075 = 78 г/моль – такого металла нет;
3. Масса остатка после прокаливания составила:
(2KCl): (К2SO3) = 149/158 = 0,943 или 94,3%, что соответствует условию.
Исходное вещество сульфит калия – К2 SO 3
4. Уравнения реакций:
К2SO3 + 2HNO3 = К2SO4 + 2NO2↑ + H2O
К2SO4 + BаCl2 = BаSO4↓ + 2КCl
К2SO3 + 2HCl = 2КCl + SO2↑ + H2O
Рекомендации к оцениванию:
1) Отсутствие сульфат-иона в исходном веществе 4 балла = 4 балла
2) Определение формулы исходного вещества 3 балла = 3 балла
3) Уравнения реакций по 1 баллу 1∙3 = 3 балла
ИТОГО 10 баллов
Класс
№ 1
Решение:
1. Обратим внимание на подсказки, присутствующие в 4-м вопросе задачи. Из них следует, что элемент Х образует несколько простых веществ, одно из которых имеет молекулярное строение, притом химические свойства этих модификаций, по-видимому, заметно различаются. Очевидно, что речь идет о неметаллах – сере, селене, фосфоре или мышьяке. В последнем случае высший хлорид неустойчив и не может быть использован при температурах выше 350 °С, в первом – восстановительная способность серы недостаточна для восстановления иона меди (2+) до металла. Проверка оставшихся двух вариантов позволяет сделать однозначный вывод о том, что искомый элемент Х – фосфор.
2. Газообразная молекула PCl5 имеет форму тригональной бипирамиды; тип гибридизации атомных орбиталей фосфора – sp3d. PCl5 кристаллический – [PCl4]+[PCl6]–, ионное соединение; катион – тетраэдр, анион – октаэдр. Газообразная молекула PCl3 – тетраэдр, в одной из вершин которого находится неподеленная электронная пара атома фосфора; тип гибридизации атомных орбиталей фосфора – sp3, валентный угол – 100,27о
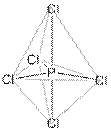
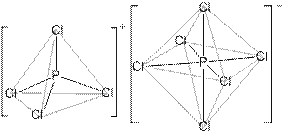

3. Y = AlPCl8 ([PCl4]+[AlCl4]–; и катион, и анион – тетраэдры). Для проверки найдём массовую долю хлора в этом комплексе: ω(Cl) = 100∙8∙35,5/(8∙35,5 + 27 + 31) = 83%, что соответствует условию.
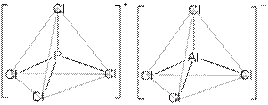
4. P4 – белый фосфор. Уравнение реакции:
P4 + 10CuSO4 + 16H2O = 10Cu + 4H3PO4 + 10H2SO4
Рекомендации к оцениванию:
1) Определение элемента Х 2 балла = 2 балла
2) Формулы хлоридов элемента Х, указание их агрегатного состояния
и определение пространственного строения – газообразные молекулы
по 1 баллу, кристаллический пентахлорид фосфора 2 балла 1∙2 + 2 = 4 балла
3) Формула комплекса Y и его пространственное строение 2 балла = 2 балла
4) Реакция восстановления меди до металла и определение
простого вещества, образуемого элементом Х 2 балла = 2 балла
ИТОГО 10 баллов
№ 2
Решение:
Вычислим молярную массу А:
(МА – 1 + 80)/МА = 1,805; 0,805МА = 79; МА = 98 г/моль
Тогда разумная брутто-формула для А – С7Н14. Исходя их химических свойств А, это циклоалкан. Причём он содержит третичный атом углерода, замещение атома водорода при котором будет происходить при бромировании преимущественно.
Дальнейшие выводы о структуре А следуют из свойств углеводорода Г. Реакция бромирования в присутствии катализатора бромида железа (III) явно говорит о наличии ароматического цикла в Г (учитывая наличие 7 атомов углерода, вещество Г – это метилбензол (толуол)), тогда и в А должен присутствовать 6-тичленный цикл => А – метилциклогексан.
Рекомендации к оцениванию:
1) Молярная масса А 1 балл = 1 балл
2) Брутто-формула А 1 балл = 1 балл
3) Структурные формулы веществ А – Г по 1,5 балла 1,5∙4 = 6 баллов
4) Реакции вещества Г по 1 баллу 1∙2 = 2 балла
Замечание: если нарисован только один из изомеров (орто- или пара-), то за реакцию ставится 0,5 балла.
ИТОГО 10 баллов
№ 3
Решение:
Образование светло-желтого осадка при взаимодействии с раствором нитрата серебра в азотной кислоте указывает на наличие в растворе бромид-иона. Студенистый бесцветный осадок, растворимый в щелочи, но вновь выпадающий при пропускании углекислого газа – амфотерный гидроксид металла. Таким образом, речь, скорее всего, идет о галогениде металла, образующего комплексные гидриды при взаимодействии с гидридом лития. Скорее всего, этот металл относится к 13 группе ПС.
Молярная масса соединения А составляет 1,03∙10-21∙6,02∙1023 = 620 г/моль. Такую молярную массу имеет димер бромида галлия – Ga2Br6.
Уравнения реакций:
Ga2Br6 + H2O → раствор GaBr3
GaBr3 + H2O = GaOHBr2 + HBr или в сокращённом ионном виде Ga3+ + H2O = GaOH2+ + H+
GaBr3 + 3NH3 + 3H2O = Ga(OH)3 + 3NH4Br
Ga(OH)3 + KOH = K[Ga(OH)4] (или K3[Ga(OH)6])
2K[Ga(OH)4] + CO2 = K2CO3 + 2Ga(OH)3 + H2O
GaBr3 + 3AgNO3 = Ga(NO3)3 + 3AgBr
AgBr + 2Na2S2O3 = NaBr + Na3[Ag(S2O3)2]
GaBr3 + 4LiH = LiGaH4 + 3LiBr
2 Pb(CH3COO)2*3H2O = CH3C(O)CH3 + (PbOH)2CO3 + 5H2O (или PbCO3)
4CH3C(O)CH3 + LiGaH4 + 4H2O = 4CH3CH(OH)CH3 + LiOH + Ga(OH)3
Рекомендации к оцениванию:
1) Определение вещества А 1 балл = 1 балл
2) Уравнения реакций по 1 баллу 1∙9 = 9 баллов
ИТОГО 10 баллов
№ 4
Решение:
Исходя из приведенных в задаче данных, нетрудно найти электрохимический эквивалент неизвестного вещества, т.е. такое его количество, которое способно отдать 1 моль электронов. 1 моль КMnO4 присоединяет в кислой среде 5 моль электронов. В реакцию вступило 20∙0,1/1000 = 2 ммоль перманганата калия, т.е. 10 ммоль-экв этого вещества. Следовательно, 0,343 г неизвестного соединения – это также 10 ммоль-экв, а молярная масса эквивалента этого вещества составляет 34,3 г/моль.
Рассмотрим возможные варианты:
| Число отдаваемых электронов | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Молярная масса (М) | 34,3 | 68,6 | 102,9 | 137,2 | 171,5 | 205,8 | 240,1 | 274,4 |
| 0,3107∙М | 10,65 (B) | 21,3 (3Li) | 31 ,95 (2O) | 42,6 (-) | 53,25 (-) | 63,9 (4O) | 74,55 (As) | 85,2 (-) |
| 0,6893∙М | 23,65 (2C?) | 47,3 (4C?) | 70,95 ( K + S ) | 94,6 | 141,9 (2 K + 2 S ) |
Как видно из полученных данных, простейшая формула искомого вещества, вероятнее всего, KSO2. Поскольку для серы, которая является элементом четной группы, характерны четные значения валентности, истинная формула вещества K2S2O4. Это дитионит калия:
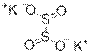
Реакция:
5K2S2O4 + 6KMnO4 + 4H2SO4 = 6MnSO4 + 8K2SO4 + 4H2O
Синтез:
2H2O (+ MgSO4) = 2H2 + O2 (электролиз)
2ZnS + 3O2 = 2ZnO + 2SO2
ZnO + C = Zn + CO
K2CO3 + 2SO2 + H2O = 2KHSO3 + CO2
2KHSO3 + SO2 + Zn = K2S2O4 + ZnSO3 + H2O
Рекомендации к оцениванию:
1) Определение дитионита калия 4 балла (простейшая формула – 3 балла) = 4 балла
2) Структурная формула 1 балл = 1 балл
3) Реакция с перманганатом калия 1 балл = 1 балл
4) Синтез дитионита калия из минерального сырья 4 балла = 4 балла
ИТОГО 10 баллов
№ 5
Решение:
Термохимическое уравнение реакции разложения пероксида водорода:
2H2O2 = 2H2O + O2 + 196 кДж,
где тепловой эффект реакции 196 кДж = 2∙Qобр(H2O) – 2∙Oобр(H2O2) = 2∙(286 – 188).
Теплотой образования химического соединения называется количество теплоты, которое выделяется (или поглощается) в процессе получения 1 моль этого соединения из простых веществ, устойчивых при данной температуре.
Завершение разложения пероксида водорода можно определить по прекращению выделения пузырьков газа (кислорода). В качестве катализатора разложения можно использовать порошок диоксида марганца, раствор солей железа, ржавчину или немного крови (за счет содержащегося в ней фермента каталазы). Наиболее активным катализатором является чистая каталаза. Наиболее доступным из активных катализаторов является порошкообразный MnO2 (пиролюзит) – активная масса из цинковых батареек, скорее всего, это вещество и использовал юный химик.
Изменением массы раствора за счет удаления газообразного кислорода можно пренебречь (масса раствора до начала разложения ПВ равна 412 г, даже если считать гидроперит на 100% состоящим из ПВ, то кислорода выделится максимум (0,5∙12/34)∙32 = 5,6 г, т.е. ожидаемая ошибка от неучета выделяющегося газообразного кислорода будет не более 1%).
Количество теплоты, выделившееся в реакции разложения:
Q = (400 + 12)∙4,184∙7,2 = 12411 Дж
Такое количество теплоты выделится при разложении 12411∙2/196000 = 0,127 моль ПВ. Значит в 12 г гидроперита содержится 0,127∙34 = 4,32 г ПВ и 12 – 4,32 = 7,68 г мочевины или 7,68/60 = 0,128 моль. Формула гидроперита (NH2)2CO∙H2O2.
Рекомендации к оцениванию:
1) Термохимическое уравнение 3 балла = 3 балла
2) Определение термина «теплота образования» 1 балл = 1 балл
3) Вывод формулы гидроперита 3 балла = 3 балла
4) Указание хотя бы одного из катализаторов 1 балл, если больше одного 2 балла = 2 балла
5) Ответы на дополнительны вопросы по 0,5 балла 0,5∙2 = 1 балла
ИТОГО 10 баллов
№ 6
Решение:
1) По описанию, а также по химическим свойствам (реакция с кислородом в присутствии серебра) становится ясно, что A – этилен. Для проверки можно вычислить массовую долю кислорода в соединении Е (этиленоксид): 16/(16 + 12∙2 + 4) = 0,3636 (36,36%), что сходится с условием. Установление остальных структур зашифрованных веществ, кроме G, проблем не представляет.
2) Судя по условию, брутто-формула вещества G – СnOnH(n+1), а брутто-формула этиленоксида – С2OH4. Сравнивая эти брутто-формулы, нетрудно заметить, что если прибавить к брутто-формуле этиленоксида СО2, получается брутто-формула С3O3H4, которая удовлетворяет условию задачи. Структурная формула соединения G становится понятной из дополнительной информации о синтезе (реакция фосгена с этиленгликолем). Тогда расшифрованная схема будет выглядеть следующим образом:
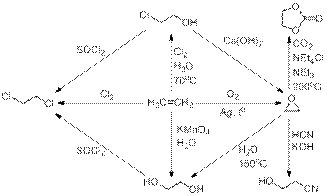
3) Реакции получения соединения G:
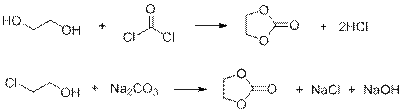
4) Из оксирана и этиленгликоля получают 1,4-диоксан (вещество К) по следующим реакциям:

Рекомендации к оцениванию:
1) Структурные формулы соединений A – G по 1 баллу 1∙7 = 7 баллов
2) Уравнения реакций получения G по 1 баллу 1∙2 = 2 балла
3) Структурная формула K 1 балл = 1 балл
ИТОГО 10 баллов
№ 7
Решение:
Вещество А дает характерную фиолетовую окраску с раствором FeCl3, что характерно для фенолов:
Ar-OH + [Fe(H2O)6]3+ = [Fe(OAr)n(H2O)6−n](3−n)+ + nH+
Также наличие фенольных гидроксильных групп в соединении А подтверждается его реакцией с метилиодидом в щелочной среде:
Ar-OH + CH3I + KOH = Ar-OCH3 + KI + H2O
Со спиртами такая реакция не идет, так как для получения алкоголята основности КОН недостаточно.
Тот факт, что метилирование А приводит только к двум продуктам, а разность молярных масс М(В) – М(А) и М(С) – М(В) одинакова, позволяет сделать вывод о том, что соединение А имеет две фенольные группы. Соответственно, В является монометилированным, а С – диметилированным продуктами.
Рассчитаем молярную массу А. Для этого представим его формулу в виде Х(ОН)2, а формулу С – как Х(ОСН3)2. Тогда
[M(X)+2M(OCH3)]/[M(X)+2M(OH)] = 1,226
где M(X) – молярная масса группы Х. Тогда
[M(X)+2·31,03]/[M(X)+2·17,01] = 1,226
Отсюда, M(X) = 90,05. Так как А – фенол, то его молекула должна содержать не менее 6 атомов углерода. Единственным разумным вариантом для группы Х является формула С7Н6, а формулу А можно представить в виде С7Н6(ОН)2. (Такой же результат можно получить при расчетах по монометилированному продукту В).
Рассмотрим возможные изомеры А. Их всего шесть:
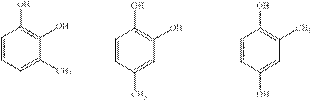
I II III
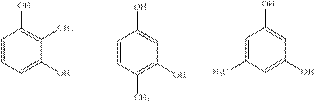
IV V VI
Из них изомеры I, II, III и V будут давать по 2 изомерных монометилированных продукта, что противоречит условию задачи.
Чтобы сделать выбор между изомерами IV и VI рассмотрим процесс их нитрования. Так как нитрование фенолов идет в орто- и пара-положения относительно гидроксильных групп, очевидно, что изомер IV даст динитропроизводное, а изомер VI – тринитропроизводное.
Определим число вошедших нитрогрупп, исходя из молярной массы D. Молярная масса А равна 124,13. Каждая вошедшая нитрогруппа увеличивает молярную массу на 45,00 (14,01 + 2·16,00 – 1,01). Предположим, что продукт нитрования содержит х нитрогрупп, тогда M(D)/M(A) = (124,13 + 45,00х)/124,13 = 2,088.
Отсюда х = 3. Следовательно, соединению А соответствует формула VI. Это соединение называется орцин.
Реакции орцина:

А В С
A D
Рекомендации к оцениванию:
1) За отнесение А к классу фенолов 1 балл = 1 балл
2) За реакцию метилирования 1 балл = 1 балл
3) За установление двухатомности фенола А 1 балл = 1 балл
4) За определение молярной массы А 2 балла = 2 балла
5) За определение количества NO2-групп в D 1 балл =1 балл
6) За установление структуры А (VI) 2 балла = 2 балла
7) За написание реакций метилирования и нитрования А по 1 баллу 1∙2 = 2 балла
ИТОГО 10 баллов
Класс
№ 1
Решение:
А – NH3; Б – NO; В – NO2; Г – HNO3; Д – NH4NO3
1) 4NH3 + 5O2 = 4NO + 6H2O
2) 2NO + O2 = 2NO2
3) 3NO2 + H2O = 2HNO3 + NO
4) 5KMnO4 + 3NH3 = 5KOH + 3NO + 5MnO2 + 2H2O
5) NH3 + HNO3 = NH4NO3 (белый туман)
Димеризуется бурый газ NO2 в N2O4 (бесцветный), структурные формулы:
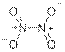 и
и 
Рекомендации к оцениванию:
1) Определение веществ по 0,5 балла 0,5∙5 = 2,5 балла
2) Уравнения реакций 1, 2, 5 по 1 баллу 1∙3 = 3 балла
3) Уравнения реакций 3 и 4 по 1,5 балла 1,5∙2 = 3 балла
4) Ответ на дополнительный вопрос 1,5 балла = 1,5 балла
(0,5 балла за вещество, по 0,5 балла за структурные формулы)
ИТОГО 10 баллов
№ 2
Решение:
Возможные варианты решений:
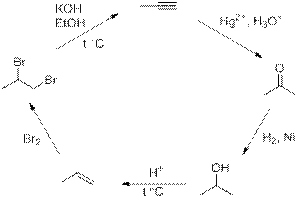
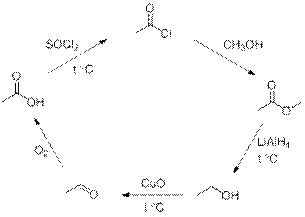
Рекомендации к оцениванию:
1) За каждую правильную реакцию по 2 балла 2∙5 = 10 баллов
(если цепочка не замкнута по 0,5 балла)
ИТОГО 10 баллов
№ 3
Решение:
Согласно условию, вещества X и Y взаимодействует с хлороводородом. Этому условию соответствуют оксиды металлов, карбонаты, сульфиты металлов (и т.п.), а также некоторые окислители. Поскольку оба вещества взаимодействует с кислородом, то маловероятно, чтобы это был окислитель, окисляющий HCl. Уменьшение массы в инертной атмосфере (азот) в условиях, когда можно работать с кварцевым стеклом, а также уменьшение массы при взаимодействии с кислородом указывают на то, что исходное вещество – карбонат (в случае оксида и сульфита происходило бы увеличение массы в токе кислорода вследствие окисления соответственно до высшего оксида или до сульфата). Таким образом, формулы веществ X и Y – M(CO3)n.
M(CO3)n = MOn + nCO2
Для вещества Х получаем:
44n/(МX + 60n) = 0,245, где MX – молярная масса металла МX.
В карбонатах металлы могут иметь валентность от 1 до 4.
| Валентность | 1 | 2 | 3 | 4 |
| n | 0,5 | 1 | 1,5 | 2 |
| Мм, г/моль | 59,8 | 119,6 | 179,4 | 239,2 |
Наиболее вероятным кандидатом является олово, имеющее молярную массу 118,7 г/моль, Х – карбонат олова (II).
Для вещества Y получаем:
44n/(МY + 60n) = 0,165, где MY – молярная масса металла МY.
Проводя аналогичные вычисления для вещества Y , получаем
| Валентность | 1 | 2 | 3 | 4 |
| n | 0,5 | 1 | 1,5 | 2 |
| Мм, г/моль | 103,3 | 206,6 | 310 | 413,2 |
По-видимому, в данном случае речь идет о карбонате свинца.
Уравнения реакций:
SnCO3 = SnO + CO2
3SnCO3 + 2NH3 = 3Sn + N2 + 3H2O + 3СО2
2SnCO3 + O2 = 2SnO2 + 2СО2
SnCO3 + 2HCl = SnCl2 + H2O + СО2
PbCO3 = PbO + CO2
3PbCO3 + 2NH3 = 3Pb + N2 + 3H2O + 3СО2
6PbCO3 + O2 = 2Pb3O4 + 6CO2
PbCO3 + 2HCl = PbCl2 + H2O + СО2
Поглотитель, как следует из условия задачи, должен поглощать водяной пар, кислотные газы и хлор. Примером такого поглотителя может быть твердый гидроксид натрия.
Обработка карбоната олова смесью хлороводорода и хлора приведет к образованию тетрахлорида олова, который будет частично гидролизоваться водяным паром до диоксида. В случае карбоната свинца получится дихлорид свинца.
Рекомендации к оцениванию:
1) Обоснование того, что исходные вещества – карбонаты 1 балл = 1 балл
2) Определение веществ X и Y по 1,5 балла 1,5∙2 = 3 балла
3) Уравнения реакций по 0,5 балла 0,5∙8 = 4 балла
4) Выбор осушителя 1 балл = 1 балл
5) Взаимодействие со смесью хлора и хлороводорода по 0,5 балла 0,5∙2 = 1 балл
ИТОГО 10 баллов
№ 4
Решение:
Оптически активными являются несколько типов октаэдрических комплексов: МХ3, МХ2AB, МХ2A2 (где Х – хелатообразующий лиганд), цис-МА2В2С2 и MABCDEF. Учитывая, что комплекс, о котором идёт речь в задаче, содержит три типа лигандов, то это МХ2AB или цис-МА2В2С2.
Бурый цвет оксида иода обусловлен, вероятно, выделением иода. Взаимодействие оксида иода с газом с образованием молекулярного иода – известный способ количественного определения угарного газа:
I2O5 + 5CO = I2 + 5CO2
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Количество выделившегося угарного газа, n(CO) = 5n(I2) = 5/2∙0,2∙10,2∙10-3 = 5,10 ммоль.
Если искомый комплекс МХ2AB, в его состав входит одна молекула СО и его молярная масса равна 1,000/0,0051 = 196 г/моль, что слишком мало (на металл и оставшиеся лиганды, кроме СО, приходится 145 г/моль). Следовательно, наш комплекс, вероятно, цис-МА2В2С2 и было взято 2,55 ммоль комплексной соли.
При кипячении с сульфатом цинка в осадок могло выпасть либо 2,55 ммоль (если осадок образовался только с участием одного типа лигандов), либо 5,10 ммоль соли (если осадок образовался с участием всех оставшихся лигандов, кроме СО). В первом случае молярная масса аниона составит 0,3:0,00255 – 65,4 = 52,2 г/моль, что соответствует двум цианид-анионам. Во втором – масса аниона составит 0,3:0,0051 – 65,4 < 0, что не имеет физического смысла.
При кипячении с перхлоратом серебра в осадок могло выпасть 5,10 ммоль цианида серебра (он малорастворим), т. е. 0,0051∙133,9 = 0,683 г, но осадка выпало больше, следовательно, третий лиганд комплекса также образовал осадок. Молярная масса второй выпавшей соли равна (1,414 – 0,683)/0,0051 = 143,3 г/моль. На анион приходится 143,3 – 107,8 = 35,5 г/моль – это хлор.
Исходная соль – Na[M(CO)2(CN)2Cl2]
Определим центральный атом. Его молярная масса М равна:
М = 1:0,00255 – 23 – 2∙(28 + 26 + 35,5) = 190 г/моль. Неизвестный металл – осмий. Комплекс – Na[Os(CO)2(CN)2Cl2] (при округлении промежуточных цифр может также получиться иридий). Два энантиомера (оптических изомера) комплекса:
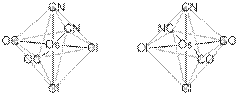
Рекомендации к оцениванию:
1) Обсуждение оптически активных комплексов 2 балла = 2 балла
2) Выход на угарный газ 1 балл = 1 балл
3) Уравнения реакций с угарным газом 1 балл = 1 балл
4) Расчет количества угарного газа 1 балл = 1 балл
5) Выход на конкретный тип комплекса 2 балла = 2 балла
6) Определение цианида 1 балла = 1 балл
7) Определение хлора 1 балла = 1 балл
8) Определение неизвестного металла 1 балл = 1 балл
ИТОГО 10 баллов
№ 5
Решение:
1) Узнаем, что за газ выделился на аноде: Mr = 16∙2,75 = 44 – это могут быть CO2, C3H8, N2O. Так как при электролизе пропан не может являться единственным продуктом реакции, а закись азота таким образом получить нельзя, то это углекислый газ. Найдем его количество: n(CO2) = 1,12/22,4 = 0,05 моль. Найдем количество водорода, выделившегося на катоде: n(H2) = 0,56/22,4 = 0,025 моль. Рассчитаем количество электричества, затраченного на электролиз F: q = 5∙(32∙60 + 10) = 9650 Кл, то есть через электрохимическую ячейку прошло 9650/96500 = 0,1 моль электричества.
На выделение водорода на катоде было израсходовано 0,025∙2 = 0,05 моль электричества, тогда на электроосаждение металла С было затрачено 0,1 – 0,05 = 0,05 моль электричества, откуда есть возможность узнать молярную массу С: если металл одновалентный, то M(С) = 1,588/0,05 = 31,76 г/моль – таких металлов нет; если С – двухвалентный металл, то M(С) = 1,588/0,025 = 63,52 г/моль – это медь. Так как на аноде выделяется единственный газ – CO2, а на катоде выделяется водород, и к тому же электролиз проводили при больших плотностях тока, то логично заключить, что исходная соль F – формиат меди (II).
Отсюда рассчитаем количество молекул воды в кристаллогидрате. Молярная масса кристаллогидрата равна 4,737/0,025 = 189,5 г/моль, на воду приходится 189,5 – 63,5 – 45∙2 = 36 г/моль, это две молекулы воды. Значит, кристаллогидрат имеет состав Cu(OOCH)2∙2H2O.
2) Реакция электролиза: Cu(OOCH)2 = Cu + H2 + 2CO2
Катодные процессы:
Cu2+ + 2e = Cu0
2H+ + 2e = H2
Анодный процесс:
2HCO2– – 4e = 2H+ + 2CO2
Использование платинового анода для проведения процесса, описанного в задаче, принципиально, так как на нем возможна адсорбция водорода на поверхность электрода. Уменьшение плотности тока приведет к наличию двух реакций на аноде:
2HCO2- - 4e = 2H+ + 2CO2
2HCO2- - 2e = H2 + 2CO2
Замена платинового анода на углеродный вовсе изменит ход реакции: водород будет выделяться на аноде, а не на катоде.
3) Средняя молярная масса газовой смеси равна 30 г/моль. Если обратить внимание на молярную массу соли за вычетом массы меди (она равна 90 г/моль), то можно заметить, что она как раз кратна 30. Отсюда можно сделать вывод, что одним из продуктом реакции является медь, а вся остальная часть формиата меди образует 3 моль неизвестных газов.
Возможные варианты: H2 + 2CO2 или Н2О + СО + СО2. Однако при повышенной температуре угарный газ может реагировать с водой, давая водород и углекислый газ. Таким образом, наиболее вероятно, что при термическом разложении соли протекает та же самая реакция, что и при электролизе: Cu(OOCH)2 = Cu + H2 + 2CO2
Рекомендации к оцениванию:
1) Вывод о том, что газ на аноде – CO2 1 балл = 1 балл
2) Вывод о том, что С – медь 2 балла = 2 балла
3) Вывод о том, что F – формиат 2 балла = 2 балла
4) Нахождение формулы исходного кристаллогидрата 1 балл = 1 балл
5) Реакция электролиза 1 балл, катодные процессы, 1 + 0,5∙2 = 2 балла
анодный процесс по 0,5 балла
6) Ответ на вопрос про замену электрода 1 балл = 1 балл
7) Реакция термолиза 1 балл = 1 балл
ИТОГО 10 баллов
№ 6
Решение:
Исходя из легкости взаимодействия А с AgNO3, можно предположить, что исходное соединение очень легко гидролизуется даже холодной водой, образуя раствор, содержащий хлоридные ионы. Сжигание А в кислороде приводит к образованию твердого остатка, вероятнее всего, оксида некоторого элемента Э. Низкая температура кипения А указывает на небольшую молярную массу, что позволяет предположить, что молекула исходного соединения, вероятнее всего содержит по одному атому хлора и неизвестного элемента Э.
При взаимодействии А с AgNO3 образовалось 1,129:143,32 = 7,877·10−3 моль AgCl (вещество В).
Масса 1,000 мл А равна 0,856 г. Если принять предположение, что молекула А содержит только один атом хлора, то молярная масса А равна 0,856:7,877·10−3 = 108,67 г/моль. (Присутствие в молекуле А нескольких атомов хлора соответствует кратному увеличению молярной массы, что маловероятно).
Для определения элемента Э, образующего оксид D, запишем его формулу в виде ЭОх/2, где х – целое число. Тогда, молярная масса оксида будет равна 0,4735:7,877·10−3 = 60,11 г/моль. Тогда молярная масса Э будет равна М(Э) = 60,11 – 8х. Для определения неизвестного элемента составим таблицу:
| х | М(Э) г/моль | Элемент Э |
| 1 | 52 | (Cr) |
| 2 | 44 | - |
| 3 | 36 | (Cl) |
| 4 | 28 | Si |
| 5 | 20 | - |
| 6 | 12 | (C) |
| 7 | 4 | (He) |
Из всех вариантов проходит только кремний. Действительно, диоксид кремния (соединение D) является белым твердым веществом, легко растворяющимся в плавиковой кислоте.
Таким образом, молярная масса органической части молекулы А составляет 108,67 – 35,45 – 28,09 = 45,13 г/моль. Такая молярная масса соответствует формуле С3Н9 или трем группам СН3. Разумной формулой для соединения А является (СH3)3SiCl. Действительно, триметилхлорсилан легко гидролизуется водой, а наличие в нем эквивалентных атомов водорода подтверждается их эквивалентностью в продукте С.
Чтобы определить строение С нужно обратить внимание на то, что все водороды в нем (по данным 1Н-ЯМР) эквивалентны и, следовательно, принадлежат группам СН3. Это заставляет отказаться от предположения, что С является силанолом (аналогом спиртов). Действительно, силанолы являются малоустойчивыми соединениями и стремятся превратиться в силоксаны (аналоги простых эфиров). Тогда процесс гидролиза описывается следующим уравнением:
2R3SiCl + Н2О → R3Si-О-SiR3 + 2HCl
Такое предположение подтверждается расчетом молярной массы продукта гидролиза:
М(С) = 0,640:(7,877·10−3:2) = 162,50 г/моль. Эта величина равна молярной массе гексаметилдисилоксана (СH3)3Si-О-Si(СH3)3 (вещество С).
Приведенные в условии задачи химические превращения описываются, таким образом, следующими уравнениями реакций:
2(СH3)3SiCl + Н2О → (СH3)3Si-О-Si(СH3)3 + 2HCl (1)
HCl + AgNO3 = AgCl + HNO3 (2)
(СH3)3SiCl + 6O2 = 3CO2 + HCl + SiO2 + 4H2O (3)
SiO2 + 6HF = H2SiF6 + 2H2O (4)
Триметилхлорсилан является классическим реагентом для введения триметилхлорсилильной защитной группы в спирты и фенолы в ходе органического синтеза. Введенная защита легко снимается с помощью кислотного гидролиза или под действием фторид-аниона
ROH + ClSi(CH3)3 = ROSi(CH3)3 + HCl (для связывания выделяющегося HCl добавляют слабое основание, например, триэтиламин, пиридин и т.д.)
2ROSi(CH3)3 + Н2О → 2ROH + (СH3)3Si-О-Si(СH3)3
Гексаметилдисилоксан (СH3)3Si-О-Si(СH3)3 является одним из простейших представителей силоксанов, в том числе полимерных, типа
(−SiR2−O− SiR2−O−)n
Такие полисилоксаны представляют собой вязкие высококипящие жидкости и широко применяются в качестве устойчивых при высоких температурах масел, смазок, гидрофобизирующих покрытий и т.д.
Рекомендации к оцениванию:
1) За определение присутствия в А хлора 1 балл = 1 балл
2) За определение присутствия в А кремния 2 балла = 2 балла
3) За определение молярной массы и брутто-формулы А 1 балл = 1 балл
4) За определение строения веществ А – D по 0,5 0,5∙4 = 2 балла
5) За реакции 1 – 4 по 0,5 0,5∙4 = 2 балла
6) За применение А в синтезе 1 балл = 1 балл
7) За класс силоксанов и применения полисилоксанов 1 балл = 1 балл
ИТОГО 10 баллов
№ 7
Решение:
1) Очевидно, что числа, соответствующие соединениям, эквиваленты молярным массам веществ. Это видно, например, по реакции 85→111,где разность 111 – 85 = 26 соответствует молярной массе ацетилена. Тогда можно найти молярную массу соединения Х: M(X) = 104 – 32 = 72 г/моль, что соответствует 5 или менее атомам углерода в соединении. Если в X имеется 5 атомов углерода, то это C5H12, но оно не удовлетворяет условию лёгкого присоединения кислорода. Пусть в X 4 атома углерода, значит, на остальные атомы в молекуле приходится масса 24 г/моль. Если степень непредельности равна 0, то это C4H10N – несуществующее соединение; если степень непредельности 1, то это C4H8O – вполне возможное соединение (бутаналь, этилвиниловый эфир и др.). Из соединений, которые используются в качестве органических растворителей под условие задачи подходит тетрагидрофуран, который легко образует перекиси при стоянии на воздухе, поэтому пусть X – оксалан. Тогда запишем все уравнения реакций:
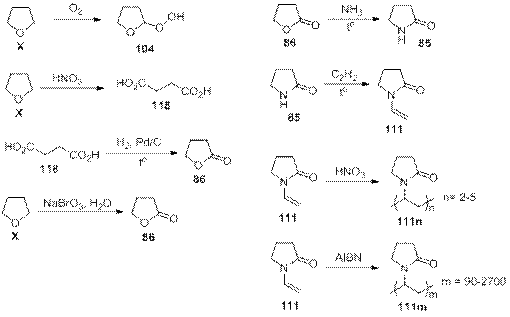
Проверка по всем молярным массам соединений даёт положительный результат, значит, исходное предположение было верным.
2) Если рассмотреть фрагмент олигомера 111 n или полимера 111 m, то можно заметить возможность кето-енольной таутомерии, которая, к тому же, будет выгодна из-за образования внутримолекулярной водородной связи, стабилизирующей енольную форму:
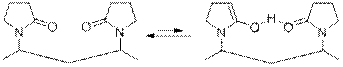
3) Соединение Z является основным компонентом лекарственного препарата «Йокс». В этом случае 111 m определяет долгое антисептическое действие лекарства: трииодид анион постепенно высвобождается из структуры полимера.
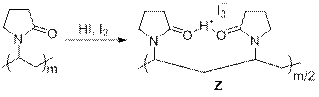
Рекомендации к оцениванию:
1) Структуры соединений по 1 баллу 1∙9 = 9 баллов
2) Объяснение слабокислой реакции 111 n и 111 m 0,5 балла = 0,5 балла
3) Объяснение роли 111 m в препарате Z 0,5 балла = 0,5 балла
ИТОГО 10 баллов
Дата добавления: 2019-01-14; просмотров: 404; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
