Отборочный (районный) этап. Практический тур
Класс
I вариант
Вещество Х реагирует, по крайней мере, с двумя из трёх галогенидов с выделением осадка. Такие свойства указывают на растворимые соли свинца, ртути, серебра. Под условие задачи подходит серебро.
Возьмём для примера нитрат серебра. В первом эксперименте протекают следующие реакции:
№1 3AgNO3 + Na3PO4 = Ag3PO4↓ + 3NaNO3 жёлтый осадок
№2 AgNO3 + NaI = AgI↓ + NaNO3 жёлтый осадок
№3 2AgNO3 + Na2SO3 = Ag2SO3↓ + 2NaNO3 белый осадок
№4 AgNO3 + KF → реакция не протекает, нет видимых изменений
№5 AgNO3 + KCl = AgCl↓ + KNO3 белый творожистый осадок
№6 2AgNO3 + 2KOH = Ag2O↓ + 2KNO3 + H2O бурый осадок
Таким образом, в пробирке №4 – KF, в пробирке №6 – KOH.
При добавлении серной кислоты происходят следующие реакции:
№3 Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H2O выделение газа с резким запахом
№5 KCl + H2SO4 → реакция не протекает, нет видимых изменений
Таким образом, в пробирке №3 – Na 2 SO 3, в пробирке №5 – KCl.
Наконец, при добавлении гидроксида кальция происходят следующие реакции:
№1 3Ca(OH)2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaOH выделение белого осадка
№2 Ca(OH)2 + NaI → реакция не протекает, нет видимых изменений
Таким образом, в пробирке №1 – Na 3 PO 4, в пробирке №2 – NaI.
Рекомендации к оцениванию:
1) Корректное сопоставление каждого вещества
с номером пробирки по 0,75 балла 0,75∙6 = 4,5 балла
2) 7 уравнений реакций по 0,5 баллов 0,5∙7 = 3,5 баллов
|
|
|
ИТОГО 8 баллов
II вариант
Вещество Х реагирует, по крайней мере, с двумя из трёх галогенидов с выделением осадка. Такие свойства указывают на растворимые соли свинца, ртути, серебра. Под условие задачи подходит серебро.
Возьмём для примера нитрат серебра. В первом эксперименте протекают следующие реакции:
№1 3AgNO3 + K3PO4 = Ag3PO4↓ + 3KNO3 жёлтый осадок
№2 2AgNO3 + Na2CO3 = Ag2CO3↓ + 2NaNO3 белый осадок
№3 AgNO3 + KF → реакция не протекает, нет видимых изменений
№4 AgNO3 + KI = AgI↓ + KNO3 жёлтый осадок
№5 AgNO3 + NaCl = AgCl↓ + NaNO3 белый творожистый осадок
№6 2AgNO3 + Na2S = Ag2S↓ + 2NaNO3 чёрный осадок
Таким образом, в пробирке №3 – KF, в пробирке №6 – Na 2 S.
При добавлении серной кислоты происходят следующие реакции:
№2 Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O выделение газа без запаха
№5 NaCl + H2SO4 → реакция не протекает, нет видимых изменений
Таким образом, в пробирке №2 – Na 2 CO 3, в пробирке №5 – NaCl.
Наконец, при добавлении гидроксида кальция протекает реакция:
№1 3Ca(OH)2 + 2K3PO4 = Ca3(PO4)2↓ + 6KOH выделение белого осадка
№4 Ca(OH)2 + KI → реакция не протекает, нет видимых изменений
|
|
|
Таким образом, в пробирке №1 – K 3 PO 4, в пробирке №4 – KI.
Рекомендации к оцениванию:
1) Корректное сопоставление каждого вещества
с номером пробирки по 0,75 балла 0,75∙6 = 4,5 балла
2) 7 уравнений реакций по 0,5 баллов 0,5∙7 = 3,5 баллов
ИТОГО 8 баллов
Класс
I вариант
В первом эксперименте протекают следующие реакции:
№1 2NaOH + Cr2O72- = Na2CrO4 + H2O + CrO42-
оранжевый раствор бихромата становится жёлтым из-за перехода в хромат
№1 NaOH + NH4+ = NH3+ Na+ + H2O
выделяется аммиак, имеющий резкий запах нашатырного спирта
Химик поднёс смоченную бумажку, так как в воде аммиак претерпевает реакцию
№1 (на лакмусовой бумажке) NH3 + H2O = NH4+ + OH-
pH возрастает и лакмусовая бумажка окрашивается в синий цвет.
Таким образом, в пробирке №1 – ( NH 4 )2 Cr 2 O 7.
Из последнего эксперимента можно сделать вывод о наличии Na+ в пробирке №2 – этот катион окрашивает пламя горелки в яркий жёлтый цвет.
|
|
|
При добавлении соляной кислоты протекают следующие процессы:
№2 HCl + ? → выделение газа
№3 HCl + ? → реакция не протекает, нет видимых изменений
Возможные варианты реакций в пробирке №2:
№2 Na2SO3 + 2H+ = 2Na+ + SO2 + H2O
№2 NaHSO3 + H+ = Na+ + SO2 + H2O
№2 Na2CO3 + 2H+ = 2Na+ + CO2 + H2O
№2 NaHCO3 + H+ = Na+ + CO2 + H2O
SO2 имеет запах, но если проводить реакцию с соляной кислотой (которая сама имеет сильный запах), его очень трудно почувствовать. С нелетучей серной кислотой различить карбонаты и сульфиты намного проще.
Раз запаха SO2 в эксперименте с серной кислотой не наблюдалось, значит, был взят карбонат или гидрокарбонат.
При добавлении хлорида кальция:
№2 CaCl2 + NaHCO3 → реакция не протекает, нет видимых изменений
Осадок не выпадает, так как гидрокарбонат кальция относительно хорошо растворим.
Впоследствии, может протекать такая реакция:
№2 CaCl2 + 2NaHCO3 = 2NaCl + CaCO3 + H2O + CO2
с выпадением белого осадка карбоната кальция, но идёт она гораздо медленнее, чем, если бы в пробирке был карбонат натрия.
Таким образом, в пробирке №2 – NaHCO 3.
Перейдём к пробирке №3.
При добавлении нитрата серебра протекает реакция:
№3 AgNO3 + Cl- = AgCl + NO3- белый творожистый осадок
При добавлении же щёлочи выпадает розово-бурый осадок гидроксида марганца (II), очень быстро буреющий на воздухе:
|
|
|
№3 Mn2+ + 2NaOH = Mn(OH)2 + 2Na+
№3 4Mn(OH)2 + O2 = 4MnO(OH) + 2H2O
(один из вариантов, принимаются также другие формы гидроксидов Mn(III), Mn(IV) или MnO2)
Тиоцианат калия добавили, чтобы убедиться, что в растворе нет катиона Fe3+, который также даёт бурый осадок со щёлочью. Если бы он присутствовал, появилось бы кроваво-красное окрашивание, но такого не наблюдалось.
Таким образом, в пробирке №3 – MnCl 2.
Рекомендации к оцениванию:
1) Корректное сопоставление ионов с номерами пробирок по 0,75 балла 0,75∙6 = 4,5 балла
2) 6 уравнений реакций (щёлочь с бихроматом и катионом аммония,
кислота с гидрокарбонатом, хлорид с нитратом серебра,
две реакции с Mn2+) по 0,5 балла 0,5∙6 = 3 балла
3) Ответы на два дополнительных вопроса по 0,25 балла 0,25∙2 = 0,5 балла
ИТОГО 8 баллов
II вариант
В первом эксперименте протекают следующие реакции:
№1 NaOH + NH4+ = NH3+ Na+ + H2O
выделяется аммиак, имеющий резкий запах нашатырного спирта
Химик поднёс смоченную бумажку, так как в воде аммиак претерпевает реакцию
№1 (на лакмусовой бумажке) NH3 + H2O = NH4+ + OH-
pH возрастает и лакмусовая бумажка окрашивается в синий цвет.
№2 Fe3+ + 3NaОН = Fe(OH)3 + 3Na+
бурый осадок
При добавлении серной кислоты к пробе, отобранной из пробирки № 1:
№1 2H+ + 2CrO42- = Cr2O72- + H2O
жёлтый раствор хромата становится оранжевым из-за перехода в бихромат
Таким образом, в пробирке №1 – ( NH 4 )2 CrO 4.
Из последнего эксперимента можно сделать вывод о наличии Na+ в пробирке №3 – этот катион окрашивает пламя горелки в яркий жёлтый цвет.
При добавлении серной кислоты к пробе из пробирки № 3 происходит реакция:
№3 H2SO4 + ? → выделение газа
Возможные варианты реакции в пробирке №3:
№3 Na2SO3 + 2H+ = 2Na+ + SO2 + H2O
№3 NaHSO3 + H+ = Na+ + SO2 + H2O
№3 Na2CO3 + 2H+ = 2Na+ + CO2 + H2O
№3 NaHCO3 + H+ = Na+ + CO2 + H2O
SO2 имеет запах, но если проводить реакцию с концентрированной уксусной кислотой (которая сама имеет сильный запах), его очень трудно почувствовать. С нелетучей серной кислотой различить карбонаты и сульфиты намного проще.
Раз запах в эксперименте с серной кислотой наблюдался, значит, был взят сульфит или гидросульфит.
При добавлении хлорида кальция:
№3 CaCl2 + NaHSO3 → реакция не протекает, нет видимых изменений
Осадок не выпадает, так как гидросульфит кальция относительно хорошо растворим.
Впоследствии, может протекать такая реакция:
№3 CaCl2 + 2NaHSO3 = 2NaCl + CaSO3 + H2O + SO2
с выпадением белого осадка сульфита кальция, но идёт она гораздо медленнее, чем, если бы в пробирке был сульфит натрия.
Таким образом, в пробирке №3 – NaHSO 3.
Вернёмся к пробирке №2.
Чтобы убедиться в присутствии железа (III) добавили тиоцианат калия:
Fe3+ + 3 SCN- = Fe(SCN)3 (или комплексный анион [Fe(SCN)6]3-)
кроваво-красное окрашивание раствора
При добавлении нитрата серебра протекает реакция:
№2 AgNO3 + Br- = AgBr + NO3-
выпадает лимонно-жёлтый творожистый осадок
В жёлтом растворе трудно определить желтизну осадка, но другие типичные жёлтые осадки с серебром (иодид, ортофосфат) невозможны в данном случае (из-за наличия в растворе Fe3+, FePO4 – малорастворим, FeI3 – крайне нестабилен).
Таким образом, в пробирке №2 – FeBr 3.
Рекомендации к оцениванию:
1) Корректное сопоставление ионов с номерами пробирок по 0,75 балла 0,75∙6 = 4,5 балла
2) 6 уравнений реакций (щёлочь с катионом аммония и Fe3+,
кислота с гидросульфитом и хроматом, бромид с нитратом серебра,
тиоцианат с Fe3+) по 0,5 балла 0,5∙6 = 3 балла
3) Ответы на два дополнительных вопроса по 0,25 балла 0,25∙2 = 0,5 балла
ИТОГО 8 баллов
Класс
I вариант
В первом эксперименте протекают реакции кислот с гидрокарбонатом натрия:
№1, №4, №5 RCOOH + NaHCO3 = RCOONa + CO2 + H2O выделение газа
№2, №3 → реакция не протекает, нет видимых изменений
Реакция с аммиачным раствором оксида серебра — это качественная реакция на альдегидную группу (“серебряное зеркало”), которая присутствует в открытой форме глюкозы:
№3 RCHO + 2[Ag(NH3)2]OH = RCOONH4 + 2Ag + 3NH3 + H2O серый осадок или серебряная плёнка
Таким образом, в пробирке №2 – пара-метилфенол, в пробирке №3 – глюкоза.
К пробиркам №1, №4, №5 сначала добавили бромную воду (это реакция на кратные связи и фенолы):
№4
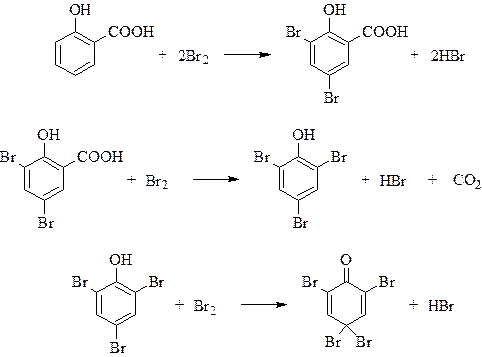
обесцвечивание бромной воды, выпадение белого осадка, желтеющего в избытке брома
Таким образом, в пробирке №4 – 2-гидроксибензойная кислота.
Затем проводят реакцию со свежеосаждённым Cu(OH)2 (качественная реакция на многоатомные спирты):
№1, №5 2RCOOH + Cu(OH)2 = (RCOO)2Cu +H2O растворение осадка
№5 
раствор становится фиолетовым
Таким образом, в пробирке №1– пропионовая кислота, в пробирке №5 – 2,3-дигидроксибутандиовая кислота.
Различить глюкозу и пара-метилфенол можно ещё по образованию комплекса фенола с Fe3+ фиолетового цвета, реакцией глюкозы со свежеосаждённым Cu(OH)2 с образованием фиолетового раствора и другими.
Рекомендации к оцениванию:
1) Корректное сопоставление каждого вещества
с номером пробирки по 0,5 баллов 0,5∙5 = 2,5 балла
2) Уравнения реакций (с карбонатом, с оксидом серебра,
с гидроксидом меди (x2)) по 0,5 баллов 0,5∙4 = 2 балла
3) Каждая из реакций с бромом по 0,5 баллов 0,5∙3 = 1,5 баллов
4) Верные реагенты с объяснением в доп. вопросе по 1 баллу 1∙2 = 2 балла
ИТОГО 8 баллов
II вариант
В первом эксперименте протекают реакции кислот с гидрокарбонатом натрия:
№1, №2, №3 RCOOH + NaHCO3 = RCOONa + CO2 + H2O выделение газа
№4, №5 → реакция не протекает, нет видимых изменений
Реакция с аммиачным раствором оксида серебра — это качественная реакция на альдегидную группу (“серебряное зеркало”), которая присутствует в открытой форме рибозы:
№4 RCHO + 2[Ag(NH3)2]OH = RCOONH4 + 2Ag + 3NH3 + H2O серый осадок или серебряная плёнка
Таким образом, в пробирке №4 – рибоза, в пробирке №5 – мета-метилфенол.
К пробиркам №1, №2, №3 сначала добавили бромную воду (это реакция на кратные связи и фенолы):
№2
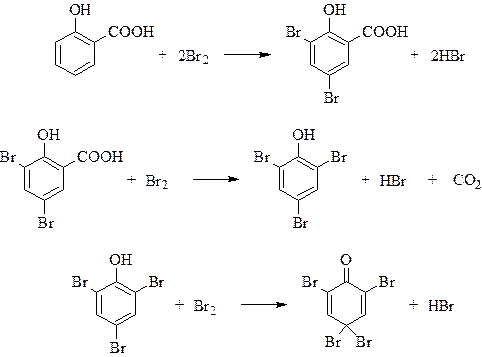
обесцвечивание бромной воды, выпадение белого осадка, желтеющего в избытке брома
Таким образом, в пробирке №2 – 2-гидроксибензойная кислота.
Затем проводят реакцию со свежеосаждённым Cu(OH)2 (качественная реакция на многоатомные спирты):
№1, №3 2RCOOH + Cu(OH)2 = (RCOO)2Cu +H2O растворение осадка
№3 
раствор становится фиолетовым
Таким образом, в пробирке №1– уксусная кислота, в пробирке №3 – 2,3-дигидроксипропановая кислота.
Различить рибозу и мета-метилфенол можно ещё по образованию комплекса фенола с Fe3+ фиолетового цвета, реакцией рибозы со свежеосаждённым Cu(OH)2 с образованием фиолетового раствора и другими.
Рекомендации к оцениванию:
1) Корректное сопоставление каждого вещества
с номером пробирки по 0,5 баллов 0,5∙5 = 2,5 балла
2) Уравнения реакций (с гидрокарбонатом, с оксидом серебра,
с гидроксидом меди (x2)) по 0,5 баллов 0,5∙4 = 2 балла
3) Каждая из реакций с бромом по 0,5 баллов 0,5∙3 = 1,5 баллов
4) Верные реагенты с объяснением в доп. вопросе по 1 баллу 1∙2 = 2 балла
ИТОГО 8 баллов
Дата добавления: 2019-01-14; просмотров: 261; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
