ФОТОДИНАМИЧЕСКАЯ ТЕРАПИЯ С ВИЗУДИНОМ В ЛЕЧЕНИИ ХОРИОИДАЛЬНОЙ НЕОВАСКУЛЯРИЗАЦИИ ПРИ МАКУЛЯРНОЙ ПАТОЛОГИИ
Клинические испытания
Исследования на животных показали, что фотодинамическая терапия с вертепорфином (коммерческое название визудин) приводит к поражению эндотелиальных клеток новообразованных сосудов. В результате можно получить окклюзию индуцированной лазером экспериментальной области ХНВ с прекращением пропотевания на флюоресцентной ангиографии (ФА) и тромботической блокадой сосудов, определяемой при гистологическом исследовании (58,61). Путем комбинирования дозы препарата, дозы облучения (энергии излучения и плотности потока), а также временного интервала от введения препарата до воздействия облучения, можно добиться получения относительно селективных результатов с минимальным воздействием на ткани хориоидеи и прилегающей сетчатки. В ходе доклинических исследований было продемонстрировано, что применение более высокой мощности облучения является безопасным, так как стандартная процедура ФДТ ранее обычно проводилась при плотности мощности в диапазоне от 150 до 200 мВт/см2 или ниже, что приводило к увеличению времени лазерного облучения. Это представляется непрактичным при лечении субретинальной неоваскулярной мембраны. Получить термальную денатурацию коллагеновых волокон хориоидеи не удалось даже при плотности мощности излучения в 1800 мВт/см2, а 600 мВт/см2 были выбраны в качестве терапевтического параметра клинических исследований (136). Кроме того, в ходе доклинических исследований была показана возможность восстановления нормальных структур ретинального пигментного эпителия (РПЭ) и хориокапилляров после единичного и повторного проведения ФДТ по дозозависимому принципу (137). Окружающие ХНВ сосуды хориоидеи оставались проходимыми, а структуры сетчатки интактными. Это послужило предпосылкой для изучения влияния ФДТ с визудином на людях.
|
|
|
Испытания визудина (Visudine, Novartis Pharmaceuticals, Basel, Switzerland) были разделены на I/II и III фазы.
I/II фаза была выполнена 128 пациентам с сенильной макулодистрофией (СМД). Была поставлена цель - определить наиболее безопасные режимы лечения. Пациентов отбирали с преимущественно классическими компонентами ХНВ, максимальным линейным размером очага поражения ≤ 5400 мкм, остротой зрения 0,5 или менее. У всех больных мембрана попадала под определение субфовеальная и лазерной коагуляции не подлежала (63,138).
За 1-7 дней до ФТД и через 1, 4 и 12 недель после нее, в соответствии со стандартными протоколами, были проведены: рефрактометрия, определение остроты зрения, комплексное офтальмологическое обследование, цветное фотографирование глазного дна и ФА. Повторное тестирование остроты зрения проводилось в день лечения и на следующий день после него. Дополнительное обследование проводили через 2 недели в том случае, если при обращении через 1 неделю или в любой момент контакта между осмотрами выявлялись какие-либо побочные эффекты терапии или возникали клинические показания. В начале исследования и на 12 неделе выполнялось измерение общесоматических показателей каждого больного и электрокардиографическое обследование. Лабораторные тесты, включающие общий анализ крови, содержание в плазме холестерина и триглицеридов, содержания азота мочевой кислоты в крови, содержание в крови креатинина и электролитов, глюкозы, общего белка, альбумина и билирубина, функциональные печеночные пробы и анализ мочи, проводили в начале исследования и через 1 и 12 недель после процедуры.
|
|
|
Острота зрения с максимальной коррекцией считалась индикатором безопасности терапии, а не эффективности, принимая во внимание отсутствие контрольной группы, короткий период наблюдения и известную вариабельность естественной природы заболевания. В тоже время изменение остроты зрения и характера пропотевания на ФА использовались для сравнения результатов применения режимов ФДТ.
|
|
|
Исследование было нерандомизированным, многоцентровым, открытым и охватывало изучение 5 различных дозовых режимов. Наблюдение продолжалось 12 недель. Каждый режим лечения был предназначен для определения максимально переносимых доз без потери остроты зрения, развития побочных эффектов в глазах или системных побочных эффектов. Увеличение дозы не вызывало развития значимых признаков токсичности, но также и не давало преимуществ в виде отсутствия пропотевания флюоресциина в зоне ХНВ к 12 неделе. Таким образом, были изучены дополнительные режимы, в которых изменяли дозу вертепорфина, скорость инфузии вертепорфина и время от начала инфузии до воздействия светом, а также проводили повторные сеансы ФДТ для оценки их влияния на остроту зрения и степень флюоресцентного пропотевания в области СНМ.
Был определен наиболее эффективный режим ФДТ, который приводил к быстрому прекращению пропотевания по данным ФА на протяжении 1 – 4 недель без явного повреждения надлежащей сетчатки, ее сосудов и подлежащей хориоидеи. Эти эффекты были достигнуты без снижения остроты зрения. Стабилизация или улучшение остроты зрения составили к 4-ой неделе 96%, к 12-ой - 72% (63). Кроме того, эта группа пациентов имела самый низкий процент (20%) прогрессирования leakage (пропотевания флюоресциина) из классической СНМ к 12-ой неделе.
|
|
|
Оптимальный режим включал внутривенное введение вертепорфина в течение 10 минут в дозе 6 мг/м2 поверхности тела в 30 мл раствора. Лазерное воздействие начинали через 15 минут от начала инфузии. Размер лазерного пятна устанавливался по максимальному линейному размеру очага ХНВ плюс 600 мкм. Лазерное воздействие на СНМ осуществлялось лазером с длиной волны 689 нм, плотностью мощности 500 мВт/см2, длительностью 83 секунды. Общая доза составила 50 Дж/ см2.
36 пациентам с сохраняющейся активностью СНМ провели повторный сеанс ФДТ, который оказался так же безопасным (138).
Фаза I/II показала хорошую переносимость вертепорфина. На самых высоких световых дозах (150 Дж/см2) у 3 пациентов на фоне отсутствия ретинальной перфузии в значительной степени снизилась острота зрения (63). При более низких дозах неселективных эффектов не наблюдалось. Во всех группах системные проявления были редки, кожной фотосенсибилизации не зарегистрировано.
III фаза исследования ФДТ с вертепорфином при субфовеальной ХНВ включала лечение ХНВ ФДТ (TAP - the Treatment of Age-related macular degeneration with Photodynamic therapy) и исследование вертепорфина в ФДТ при патологической миопии и СМД (VIP - the Verteporfin In Photodynamic therapy).
Оба исследования были международными и многоцентровыми, проводились в 22 (ТАР) и в 28 (VIP) офтальмологических центрах Европы и северной Америки со строгим соблюдением протоколов и аккредитацией всего персонала, принимающего участие в испытаниях. Контроль за проведением исследований осуществлялся независимым комитетом по мониторингу данных и информации.
ТАР исследование было рандомизированным, плацебоконтролируемым, дважды скрытым, мультицентровым. Цель исследования - определить, может ли ФДТ с вертепорфином снизить риск снижения зрения при ХНВ на фоне СМД по сравнению с естественным течением.
Было отобрано 609 пациентов в возрасте ≥ 50 лет с ХНВ на фоне СМД. У всех были признаки классической ХНВ не менее 50% от общей площади очага поражения, максимальный линейный размер был ≤ 5400 мкм. Острота зрения определялась с особой тщательностью и составила 0,1 – 0,5. Больные с массивными субретинальными кровотечениеми и с кровотечениями в области пигментного ретинального эпителия, а также пациенты с выраженной отслойкой нейроэпителия исключались из исследования.
Две трети пациентов получали лечение с визудином (6 мг/м2 площади поверхности тела), треть – плацебо лечение (5% водный раствор декстрозы). Обе группы получали лечение ФДТ согласно схеме, определенной на I/II фазе исследования.
Все больные проходили обследование каждые три месяца в течение 2 лет. При каждом осмотре проводилась рефрактометрия, определение остроты зрения и контрастной чувствительности, офтальмологическое обследование, стереоскопическое фотографирование глазного дна и ФА. В случае выявления признаков выпота в области ХНВ больные проходили повторный сеанс ФДТ. Состояние больных контролировалось по телефону в течение 2-4 дней после процедуры. В случае возникновения побочных зрительных или системных эффектов они подвергались обследованию.
В ряде случаев наблюдались побочные явления в ходе лечения. Транзиторное нарушение МКОЗ встречалось в 18% случаях при проведении ФДТ с вертепорфином и в 12% случаях при лечении плацебо, реакции в месте инъекции в - 13% и 3% соответственно, транзиторные реакции фотосенсибилизации - в 3% и 0%, связанный с инфузией болевой синдром в - 2% и 0%.
Через год снижение зрения в группе пациентов, получавших ФДТ с вертепорфином, было значительно меньше (8). Потеря менее 3 строк или 15 знаков отмечена у 61% пролеченных и 46% в плацебогруппе. При наличии преимущественно классической ХНВ эта разница была еще более явной – 67% и 39%. Напротив, у пациентов с минимальной классической ХНВ потеря менее 3 строк или 15 знаков составила в группе пролеченных 56%, а в плацебогруппе 55%.
ТАР исследование показало пользу ФДТ при преимущественно классической ХНВ (8). Было отмечено уменьшение пропотевания из очага ХНВ и темпов развития патологического процесса после ФДТ. Через год вероятность того, что площадь ХНВ будет более 6 площадей диска зрительного нерва, была в два раза выше в плацебогруппе.
Через два года в группе пациентов с преимущественно классической ХНВ (242 человека) сохранялись хорошие результаты (73,139,140). У 59% пациентов, получавших ФДТ с вертепорфином, отмечена потеря зрения менее 3 строк или 15 знаков, в то время как в плацебо группе всего у 31%.
Таким образом, проведенные исследования показали, что большинство пациентов нуждалось в повторных сеансах ФДТ. В среднем, количество сеансов на одного больного составило 3,4 в первый год наблюдения и 5,5 за два года.
Цель проведения VIP исследования - определение безопасности ФДТ с вертепорфином в различных группах пациентов с ХНВ. В исследовании больные были разбиты на две большие группы. В одной изучалось влияние ФДТ на скрытую субфовеальную ХНВ и на классическую при исходной остроте зрения выше 0,5, во второй – влияние ФДТ при субфовеальной ХНВ на фоне осложненной близорукости.
В исследование были включены 339 человека. Характеристики исходных очагов были статистически сбалансированы между терапевтической и плацебо группами, как для исследуемой популяции в целом, так и для подгруппы со скрытой ХНВ без элементов классической (141). Лечение проводилось аналогично ТАР исследованию. Наблюдение осуществлялось 24 месяца.
При выявлении активности ХНВ на ФА проводили повторные сеансы ФДТ. В подгруппе со скрытой формой ХНВ без элементов классической было проведено, в среднем, 4.9 сеансов лечения на человека (3,1 в первый год и 1,8 во второй год) из возможных восьми.
Через год в группе с патологической близорукостью количество пациентов, потерявших менее 3 строк или 15 знаков при проведении ФДТ с вертепорфином, составило 86%, а в плацебогруппе - 67%. Отмечена зависимость успеха лечения от исходных размеров патологического очага.
У пациентов со скрытой субфовеальной ХНВ и с классической ХНВ, при наличии высокой остроты зрения, достоверной разницы между пролеченными ФДТ с вертепорфином и плацебо пролеченными в первый год наблюдения выявлено не было. Через 24 месяца успех терапии стал статистически значимым: 54% обработанных глаз против 67% контрольных (р = 0,023) имели потерю остроты зрения менее 3 строк.
Процентная доля глаз с тяжелой потерей зрения в 6 строк или 30 букв и более через 24 месяца также оказалась значительно более низкой в глазах, пролеченных с вертепорфином, по сравнению с глазами, получавшими плацебо, как для популяции в целом, так и для подгруппы со скрытой формой ХНВ без элементов классической : 30% пролеченных глаз против 47% глаз плацебо контроля (р = 0.001) и 29% обработанных глаз против 47% контрольных глаз (р = 0.004), соответственно. Число сеансов лечения через 24 месяца, необходимых для предотвращения развития тяжелой потери зрения, на одного больного со скрытой ХНВ без классических областей составило 5.6.
Сохранение зрительных функций напрямую не связано с уменьшением пропотевания из области ХНВ на ФА. Через 12 месяцев наблюдения отсутствие выпота как в классической, так и в скрытой форме ХНВ встречалось редко (14% пролеченных глаз против 4% контрольных, р = 0.02), но к 24 месяцу эти цифры возросли (35% пролеченных глаз против 14% контрольных, р = 0.001). Через 24 месяца в глазах, обработанных с вертепорфином, очаги поражения были значительно меньших размеров, чем в глазах плацебо-контроля.
При проведении анализа в популяции подгруппы со скрытой формой ХНВ без элементов классической было установлено, что на исход лечения оказывали влияние как исходная острота зрения, так и размер очага поражения в начале исследования.
Безопасность фотодинамической терапии с применением вертепорфина при наблюдении в течение 24 месяцев и проведении повторных сеансов лечения в обоих исследованиях (ТАР и VIP) была высокой. Лечение переносилось хорошо, а побочных эффектов, связанных с ним, было выявлено немного. Вертепорфин является фотосенсибилизирующим красителем, что требует особенной осторожности при поведении процедуры, чтобы не допустить экстравазации препарата в ткани во время инфузии и воздействия яркого света в течение 48 часов после лечения. В обоих исследованиях реакции фотосенсибилизации и реакции области инъекции наиболее часто выявлялись в терапевтической группе, нежели в группе плацебо-контроля. Природа возникавшей во время введения препарата боли в нижней части спины неясна. Она проходит без назначения дополнительного лечения.
Данные, полученные в ходе этих клинических испытаний, показали, что использование стандартного протокола лечения вертепорфином может в значительной степени снизить риск потери зрения у ряда больных с субфовеальной ХНВ.
На основании этих исследований были прояснены многие ключевые вопросы. Во-первых, успех терапии, учитываемый по остроте зрения, удается получить независимо от наличия пропотевания флюоресциина, а зачастую и при его увеличении, в особенности во время первого года лечения. Стало очевидным, что ангиографическую картину (в частности на первом году) не следует интерпретировать, как указывающую на провал или на отсутствие ответа на лечение, а также не следует на ее основании прекращать терапию.
Во-вторых, на терапевтический успех ФДТ с применением вертепорфина оказывает влияние ангиографическая классификация компонентов очага ХНВ в начале исследования. Было показано, что при большей доле классических областей, представленных в очаге, эффект лечения выше.
Данные, полученные в исследованиях ТАР и VIP, дают новую стартовую точку для последующей работы. Можно предположить, что дополнительное понимание влияния ФДТ на ХНВ дадут ангиография с индоцианин зеленым и оптическая когерентная томография, которые активно применяются во многих офтальмологических центрах, занимающихся этой проблемой. Возможность классификации ХНВ на клеточном и микробиологическом уровне углубят понимание эффектов лечения и будут способствовать оптимизации терапевтических подходов. Также вероятно, что существует возможность изменения протокола лечения с вертепорфином или комбинирования вертепорфиновой терапии с другими методами лечения с целью расширения диапазона категорий больных, у которых лечение окажется успешным. Между тем в исследованиях ТАР и VIP было получено клиническое подтверждение практичности и эффективности применения ФДТ с вертепорфином при лечении больных с субфовеальной ХНВ при СМД.
МЕТОДИКА ВЫПОЛНЕНИЯ ФДТ
Фотодинамическая терапия включает в себя два этапа. На первом этапе в организм вводится фотосенсибилизатор, который, двигаясь в кровотоке, избирательно накапливается в тканях-мишенях. На втором этапе ткань-мишень облучается светом с длиной волны возбуждения препарата (141,142). В результате светового воздействия происходит активация фотосенсибилизатора и повреждение биологических структур в этой области.
В качестве фотосенсибилизатора при проведении ФДТ субретинальной неоваскулярной мембраны используется визудин. Международное непатентованное название – вертепорфин.

Химическая структура вертепорфина.
Вертепорфин активно поглощает свет длиной волны 689 нм (красный). Этот свет глубоко проникает в ткани, проходит через кровь, жидкости, меланин, фиброзную ткань. Низкая мощность используемого светового источника обеспечивает безопасность облучаемых тканей.
In vivo ветрепорфин быстро метаболизируется в неактивные формы и выводится в пределах 24 часов, в основном с калом.
Визудин выпускается в виде стерильного, лиофилизированного порошка для инъекций зеленого цвета на липидной основе. Хранится при комнатной температуре (20 - 25ºС) в защищенном от света месте. Разводится в 7 мл воды для инъекций. Общий объем раствора составляет 7,5 мл с концентрацией вертепорфина 2,0 мг/мл. Согласно расчетным данным необходимый объем этого раствора смешивается затем с 5% раствором глюкозы. Окончательный объем составляет 30 мл и содержит действующего вещества 6 мг/м2 поверхности тела. Попадание солнечного света на препарат исключается. Для разведения препарата не следует применять солевые растворы, так как в них визудин преципитируется. Готовый раствор хранится не более 4 часов.
Проведению ФДТ предшествует длительная и обстоятельная беседа с больным: указывается на широкое распространение данного заболевания, частоту возникновения слепоты. Особое внимание уделяется причинам возникновения неоваскуляризации. Следует в беседе также отметить, что вызывающие развитие ХНВ недостаток кровотока и дистрофические изменения в заднем полюсе глаза ФДТ не устраняет. Подробно описывается методика выполнения ФДТ и механизм ее действия. Обстоятельно даются рекомендации по поведению пациента после лечения.
До начала ФДТ проводится измерение массы тела и роста больного, определяется максимальный линейный размер (МЛР) субретинальной неоваскулярной мембраны по данным флюоресцентной ангиографии. Данные вводятся в лазерную установку, на которой выполняется ФДТ. Автоматически определяется необходимый объем визудина и раствора глюкозы. Информация появляется на табло прибора.
Размер пятна лазерного воздействия определяется с учетом данных флюоресцентной ангиографии. По фотографиям в артериальной фазе, где границы СНМ видны наиболее отчетливо, определяется максимальный линейный размер мембраны. Некоторые системы регистрации ФА имеют программное обеспечение, позволяющее архивировать полученные изображения в цифровом виде и проводить их анализ. При анализе изображения можно изменять его яркость, контрастность и другие показатели, делать подписи и производить измерения. Полученные размеры учитывают кратность увеличения камеры и близки к естественным. К МЛР прибавляется 1000 мкм. В результате получается исходный размер лазерного пятна, позволяющий воздействовать на всю площадь патологической неоваскуляризации при относительно неподвижном взгляде (в запатентованных приборах пятно выставляется автоматически при введении МЛР). При отсутствии программного обеспечения, позволяющего измерить размеры очага, можно использовать как единицу измерения диск зрительного нерва (ДЗН). Диаметр ДЗН принимается за 1,5 мм.
Если предполагается наличие скрытых элементов ХНВ, МЛР может определяться в венозную фазу. Рекомендуется выполнять ФА за неделю до проведения ФДТ.
Готовый раствор визудина вводится в течение 10 минут внутривенно со скоростью 3 мл в минуту. Используется, как правило, локтевая вена. Использование крупных вен на тыльной стороне кисти нежелательно, так как эта область подвержена световому воздействию. После введения препарата вена становится крайне светочувствительной, и даже перчатки не дают полной защиты от солнечных лучей.
Попадание визудина в подкожную клетчатку может вызвать боль, воспаление, отек ткани, обесцвечивание места инъекции. При обнаружении экстравазации инфузию следует немедленно прекратить. На место инъекции накладывается холодный компресс или лед. Руке придается приподнятое положение в течение дня. Место инфузии защищается от света не менее чем на 2 суток, до исчезновения отека и обесцвечивания кожи.
Все время введения препарата рядом с больным должен находиться врач. При первых признаках экстравазации, как было сказано выше, следует немедленно прекратить инфузию. Система введения препарата снова подключается к вене. Инфузия возобновляется. Воздействие лазера начинается через 15 минут после начала реинфузии несмотря на то, что она может быть меньше 10 минут. Если после неоднократных попыток попасть в вену не удалось, проведение ФДТ должно быть отложено не менее чем на 24 часа.
Через 15 минут после начала введения визудина начинается пяти минутный отрезок времени, в течение которого необходимо провести лазерное облучение ХНВ. Доставка излучения осуществляется с помощью щелевой лампы и контактных линз. У каждой контактной линзы имеется свое увеличение, на которое необходимо делать поправку при введении размеров светового пятна в прибор. В наиболее часто применяемых линзах 3 Mirror Universal Laser и Mainster Wide Field (Ocular) увеличение составляет 1,08 и 1,50 соответственно.
Лазерные установки для проведения ФДТ выпускают следующие производители: Zeiss, Coherent и Quantel Medical. Во всех установках размер пятна и плотность мощности лазерного излучения определяется автоматически после ввода основных показателей (МЛР ХНВ, увеличение контактной линзы).
Световое пятно наводится таким образом, чтобы была покрыта вся площадь ХНВ. При необходимости дополнительного освещения глазного дна используют свет щелевой лампы с включенным бескрасным или рассеивающим фильтром. При поиске мембраны ориентируются на основные крупные структуры глазного дна.
После нажатия на педаль лазерной установки, находящейся в активированном состоянии, начинается автоматический отсчет 83 секунд. За это время происходит облучение очага светом с длиной волны 689 нм с общей дозой облучения 50 Дж/см2. Если во время сеанса облучения педаль отжата, отсчет времени прекращается. При последующем нажатии на педаль установки начинается отсчет оставшегося времени, необходимого для экспозиции 83 секунды.
При необходимости проведения ФДТ обоих глаз лазерное облучение проводится поочередно в интервале времени между 15 и 20 минутами после начала введения препарата.
Во время лазерного облучения видимых изменений на глазном дне не происходит.
Не допускается попадание светового пятна на зону 200 мкм вокруг ДЗН. Элементы ХНВ, находящиеся в этой зоне, остаются необработанными.
Повторный сеанс ФДТ, как правило, проводится не ранее 3 месяцев после предыдущего. Параметры лазерного излучения рассчитываются по свежим данным ФА.
После проведения ФДТ можно ожидать возникновения побочных эффектов. Это может быть нарушение зрения в виде затуманивания или вспышек в первые 7 дней после ФДТ (8%), снижение остроты зрения (4,5%), появление дефектов поля зрения, таких как серые или темные ореолы, скотомы, черные точки (3,7%), слезотечение (1,0%), субретинальное кровоизлияние (1,0%), кровоизлияние в стекловидное тело (0,5%). У большинства пациентов со снижением зрения в первые 7 дней зрение постепенно восстанавливается полностью или частично.
К системным побочным эффектам относятся тошнота (2,7%), светочувствительные реакции (2,2%), боль в спине во время инъекции (2,0%), астения (2,0%), повышение холестерина в сыворотке крови (1,2%), повышение креатинина в сыворотке крови (1,0%). Светочувствительные реакции проявляются в виде солнечных ожогов. Это может быть связано с несоблюдением пациентом рекомендаций после ФДТ.
Вертепорфин накапливается в желчи и выводится из организма с калом. Средний период полувыведения изомера BPD-MAD составляет, примерно, 6,5 часов у людей с хроническим вирусным гепатитом и 4,7 часов у людей, не страдающих заболеваниями печени. Фотосенсибилизация тканей ожидается в течение 48 часов. В этот период прямые солнечные лучи и свет галогеновых ламп не должны попадать на незащищенную кожу или глаза. При необходимости покинуть помещение, необходимо тщательно защититься от возможного солнечного света (шляпа с широкими полями, солнцезащитные очки, плотная, свободная одежда, перчатки). Солнцезащитный крем не применяется в виду его неэффективности после ФДТ. С другой стороны, обычный свет внутри помещений не опасен и способствует выведению препарата через кожу («фотоотбеливанию»).
Пациентам, у которых произошло значительное снижение зрения после сеанса ФДТ, повторное лечение назначается при хотя бы частичном восстановлении зрения. В данном случае врач должен с особой тщательностью взвесить возможную пользу и вред от повторного сеанса.
СОБСТВЕННЫЕ НАБЛЮДЕНИЯ
В Международном центре охраны зрения Игоря Медведева фотодинамическая терапия с визудином выполняется в течение 4-х лет на установке Quantel medical (Франция). Отбор пациентов на ФДТ осуществлялся из потока первичных обращений, а также благодаря целевому направлению из других офтальмологических учреждений.

Внешний вид лазерной установки
Целью нашей работы стало изучение эффективности и безопасности методики ФДТ для лечения различных видов ХНВ. В ходе наблюдения мы сравнили результаты лечения ХНВ традиционными методами и с использованием ФДТ, оценили эффективность и безопасность комбинированной терапии, выработали методологию и постарались оптимизировать показания и противопоказания к выполнению данной методики.
Материалы и методы лечения.
В исследование включено 376 пациентов (376 глаз) в возрасте от 23 до 84 лет, средний возраст – составил 49,2 года, 167 мужчин и 209 женщин.
Все пациенты были с различными видами макулярной патологии, осложненной ХНВ. По нозологическим формам изменений в макулярной области пациенты распределились следующим образом.
Диаграмма 1.

Из диаграммы видно, что в большинстве случаев ХНВ встречалась у пациентов с сенильной макулодистрофией – 234 пациентов (62%), 35% исследуемых глаз имели осевую миопию и только у 3% пациентов была ХНВ на фоне центральной серозной хориоретонопатии.
Таблица 1.
Распределение пациентов по нозологиям и методам лечения
| Нозологические формы патологии макулы | Основная группа | Контрольная группа | |
| ФДТ | Комбинированная терапия | Традиционные методы | |
| СМД | 18 (64%) | 47 (52%) | 169 (66%) |
| МВС | 10 (36%) | 41 (45%) | 80 (31%) |
| Другая патология | 0 | 3 (3%) | 8 (3%) |
| Всего | 28 (100%) | 91 (100%) | 257 (100%) |
По методам проведенного лечения пациенты распределены в две группы. Основную группу составили 119 пациентов (119 глаз), в лечение которых была включена ФДТ. Среди них мы выделили две подгруппы: первая подгруппа - 28 пациентов (28 глаз) получали только сеансы ФДТ; вторая подгруппа - 91 пациент (91 глаз) получали ФДТ в комбинации с ангиопротекторами и ретробульбарными инъекциями дипроспана.
Контрольная группа - 257 пациентов (257 глаз), которым лечение проводилось без ФДТ, по традиционным методикам (консервативная терапия, лазерная коагуляция).
Перед проведением всех видов лечения пациенты проходили стандартное диагностическое обследование:
· Визометрию;
· Рефрактометрию;
· Тонометрию;
· Осмотр глазного дна с фундус линзой;
· Флюоресцентную ангиографию.
· Оценивались результаты оптической когерентной томографии.
При проведении предварительного диагностического обследования были выявлены сходные изменения на другом глазу 171 пациента (45%).
У пациентов с сенильной макулодистрофией второй глаз был поражен «сухой» формой дистрофии у 78 пациентов (33%), «влажная» форма патологии диагностирована у 30 пациентов (13%) и рубцовая у 47 обследуемых (20%). У 16 пациентов (12%) с осевой миопией на втором глазу был выявлен исход ХНВ в виде дисковидного пигментированного рубца (пятно Фукса).
ХНВ располагалась субфовеально в 115 наблюдениях и только в четырех случаях юкстафовеально и экстрафовеально. Размер ХНВ, определяемый по данным ФА, в 98-ми глазах был менее одного диаметра диска, в 7-ми равнялся ему и в 14-ти превышал.
По форме ХНВ была классической (СНМ) в 29 случаях, преимущественно классической (площадь классических элементов ХНВ в очаге более 50%) в 61 глазу и скрытой в 29 (фиброваскулярная отслойка пигментного эпителия в 22 случаях и просачивание из неопределяемого источника в фазу рециркуляции красителя в 7).
В контрольной группе соотношения форм ХНВ было сходным.
В основной группе исходная острота зрения вдаль с максимальной коррекцией составила 0,28. Могли читать 10% пациентов, 50% различали крупные буквы, 40% способности к чтению не имели.
В контрольной группе острота зрения вдаль не превышала 0,09. Способность читать вблизи диагностирована у 9% пациентов, 41% различали крупные буквы и 50% не могли читать.
Методика проведения
После определения массы и роста пациента данные вносили в память прибора. Автоматически определялось необходимое количество раствора визудина и 5% раствора глюкозы. Раствор готовили непосредственно перед введением. Инфузию выполняли только в присутствии анестезиолога.
Мидриаз достигался с использованием 1% раствора мидриацила, а местную анестезию перед постановкой фундус линзы выполняли инокаином (0,4% раствор оксибупрокаина).
Как средство доставки лазерного излучения к ткани-мишени использовалась щелевая лампа Haag-Streit (Швейцария).

Выполнение облучения очага ХНВ
На 15 минуте после начала введения визудина пациента усаживали за щелевую лампу, выполняли поиск места расположения ХНВ и наведение на патологический очаг пилотного луча лазера. Увидеть в деталях глазное дно без использования дополнительной подсветки было затруднительно из-за нахождения на пути «глаз врача – сетчатка пациента» полупрозрачного зеркала, использующегося для подачи излучения. В своей работе мы использовали дополнительное освещение щелевой лампы с включенным бескрасным фильтром. Световое пятно устанавливалось автоматически после внесения в аппарат максимального линейного размера ХНВ.
Воздействие лазерным светом с длиной волны 689 нм на патологический очаг осуществлялось в течение 83 секунд. Общая доза облучения составляла 50 Дж/см2.
Видимых изменений на глазном дне во время проведения ФДТ не зафиксировано.
Пациентам подгруппы комбинированной терапии после сеанса ФДТ выполняли парабульбарно инъекцию дипроспана трехкратно по 2 мг с интервалом в 1 неделю, внутрь назначали ангиопротекторы (дицинон по 0,25 3 раза в день 2 месяца).
Результаты
Все сеансы ФДТ прошли без осложнений.
Процедура пациентами переносилась хорошо.
Из побочных действий отмечались:
· боль в проекции вены во время введения препарата у 12 пациентов (10%);
· явления астении в течение недели после сеанса лечения у 20 (17%).
У остальных больных при тщательном опросе жалоб, связанных с лечением, не обнаружено.
Результаты лечения оценивались через 1, 2 недели, 1 месяц и далее каждые 3 месяца. Период наблюдения составил от 6 месяцев – до 4-х лет.
Необходимо отметить, что у всех пациентов основной группы в первые две недели после лечения существенно повышались зрительные функции при этом нами была замечена разница в изменении остроты зрения в нозологических подгруппах, что представлено на диаграмме.
Диаграмма 2

Наиболее эффективна ФДТ с визудином в случаях ХНВ на глазах с миопией и после лазерного лечения ЦСХ.
В конце периода наблюдения средняя острота зрения с максимальной коррекцией составила 0,33. Повышение остроты зрения вдаль у пациентов с СМД было на 27-ми глазах (41%), снижение у 25-ти пациентов (39%), без динамики у 13-ти больных (20%). У пациентов с осевой миопией зрение улучшилось на 31-м глазу (61%), ухудшилось в 16-и случаях (31%), осталось прежним у 4-х пациентов (8%). У пациентов с СНМ после лазерного лечения центральной серозной хориоретинопатии острота зрения поднялась в среднем с 0,3 до 0,9, жалобы на искажения предметов и пятно перед глазом прошли.
При анализе результатов лечения в основной группе мы оценили динамику остроты зрения вблизи, что также говорит об эффективности данного метода лечения. Как видно из диаграммы, смогли читать текст вблизи 30% пациентов, что на 20% больше, чем до лечения, 30% могли различать крупные буквы. Отсутствие у 40% пациентов способности к чтению обусловлено тяжестью дистрофических изменений в макулярной зоне.
Диаграмма 3


У пациентов контрольной группы после лечения мы не отметили значительной положительной динамики в остроте зрения вблизи.
Данные ФА сочетались с данными остроты зрения. При сохранении и улучшении зрения площадь мембраны не увеличивалась, ее сосудистый компонент уменьшался, пропотевание отсутствовало. При снижении зрения ухудшалась и картина ФА. Второй этап ФДТ с визудином не выполнялся в большинстве случаев по материальным причинам и только у одного пациента из-за бесперспективности повторного лечения.
Сравнительный анализ результатов лечения в основной и контрольной группах позволил заключить, что ФДТ с визудином в комбинации с ангиопротекторами и инъекциями дипроспана позволяет получить лучшие результаты в прибавке остроты зрения, чем лечение только ФДТ. После традиционных методов лечения результаты были значительно хуже и нестабильны.
Повторные сеансы ФДТ.
Среди пациентов, которые находились под наблюдением была группа больных, получивших несколько сеансов ФДТ с визудином.
Четыре пациента прошли два курса ФДТ и один пациент лечился трижды. Интервалы между обработками варьировали от 3 до 6 месяцев с последующим наблюдением в указанном выше порядке. Повторные курсы проводились пациентам с успехом после предыдущего сеанса и наступившим ухудшением впоследствии. У троих из пяти удалось достичь стабилизации остроты зрения и отсутствия активности ХНВ. Во всех случаях не было выявлено повреждающего действия проведенного лечения на сетчатку, пигментный эпителий или сосудистую оболочку.
Далее мы описываем наиболее показательные случаи лечения пациентов ФДТ с визудином.
Наблюдения
Пациентка О., 57 лет обратилась с жалобами на снижение зрения на единственном видящем глазу, потерей способности выполнять работу на близком расстоянии.
Острота зрения на правом глазу с максимальной коррекцией 0,5, на левом 0,01. С коррекцией +3,5 дптр с хорошим освещением могла прочитать текст № 9 (острота зрения 0,2). На глазном дне определялись «мягкие» друзы в большом количестве в правом глазу, обширная географическая атрофия в левом.
При проведении ФА выявлена двухкомпонентная СНМ с высокой активностью. Проведен сеанс ФДТ, назначен дицинон внутрь.
Через 1 неделю после лечения отметила значительное улучшение качества зрения, а через 2 недели острота зрения с максимальной коррекцией вдаль составила 0,9, вблизи 0,8.
Через месяц состояние оставалось без отрицательной динамики.
Через три месяца при повторном обследовании пациентка отметила снижение контрастности зрения, появление пятна перед правым глазом. Острота зрения вдаль с максимальной коррекцией составила 0,4, вблизи 0,4. Проведена ФА. Первоначально выявленная СНМ полностью запустела, появились два новых очага СНМ.
Проведен повторный сеанс ФДТ, парабульбарно выполнена инъекция дипроспана (2 мг). Через неделю пациентка отметила искажение предметов, острота зрения повысилась на одну десятую вдаль и на близком расстоянии. Выполнена инъекция дипроспана. Через неделю жалобы на искажения стали меньше, через месяц прошли. Острота зрения с максимальной коррекцией вдаль составила 0,5, на близком расстоянии 0,6. Показатели остаются стабильными в течение года. Каждые три месяца принимает дицинон и лютеин в таблетированой форме курсом по 1 месяцу. (Рисунок 34 – 37)
Пациентка С., 27 лет. Близорукость с 8 лет. Четыре месяца назад заметила пятно перед правым глазом. Получала тканевую, ангиопротекторную терапию. За последний месяц отметила быстрое снижение зрения на правом глазу. При обследовании острота зрения с коррекцией -6,5 дптр составила на правом глазу 0,1, на левом 1,0. Способность к чтению на близком расстоянии на правый глаз отсутствовала. На глазном дне в правом глазу выявлена СНМ, осложненная интраретинальным кровоизлиянием. Максимальный линейный размер мембраны 1,5 мм. Через неделю после ФДТ отметила уменьшение ощущения пятна перед правым глазом, острота зрения повысилась до 0,4. Через 1 месяц после лечения острота зрения с максимальной коррекцией вдаль составила 0,7, вблизи 0,5 с искажениями. Получала курсы ангиопротекторной, тканевой терапии. Через 6 месяцев острота зрения с максимальной коррекцией вдаль повысилась до 0,9 - 1,0, стала читать текст № 4 (острота зрения 0,7). Состояние правого глаза остается стабильным 3,5 года. (Рисунок 23, 24)
Заключение
Фотодинамическая терапия с применением визудина позволяет безопасно получать повышение и стабилизацию зрения у больных с ХНВ, вторичной по отношению к сенильной макулодистрофии, патологической миопии и другой патологии макулярной области. При этом результаты лечения ФДТ превышают показатели после проведения традиционных методов терапии ХНВ. Обращают на себя внимание более высокие и стабильные показатели повышения остроты зрения после ФДТ у пациентов с миопией высокой степени и в случаях возникновения ХНВ после лазерного лечения ЦСХ. Наиболее эффективна методика в случаях:
· классической хориоидальной неоваскуляризации (субретинальной неоваскулярной мембраны) с субфовеальным расположением;
· скрытой хориоидальной неоваскуляризации, расположенной суб- и юкстафовеально, размер которой не превышает 4 площадей диска зрительного нерва.
Методика безопасна, так как не имеет осложнений и легко переносится пациентами.
Обращает на себя внимание простота выполнения процедуры фотодинамической терапии, однако требуется детальное предварительное обследование и грамотная его интерпретация для выявления точных показаний. Особенно важно исключить вялотекущие воспалительные процессы сетчатки и хориоидеи, которые протекают по типу развития ХНВ. ФДТ с визудином в таких случаях приводит к обострению процесса и резкому снижению зрительных функций.
На основании данных остроты зрения для дали и вблизи, а также по данным ФАГ можно заключить, что сочетание ФДТ с назначением курсов ангиопротекторов и инъекциями кортикостероидов позволяет прогнозировать более высокие и стабильные результаты лечения.
Принятие решения в отношении необходимости проведения вторичного сеанса ФДТ является сложным и требует рассмотрения ряда критериев: динамики зрительных функций, состояния зоны рецидивирующей неоваскуляризации и данных ФА. В результате наблюдений было выявлено, что многократная обработка очагов ХНВ с использованием визудина является безопасной и эффективной для пациентов. Повторные сеансы ФДТ с визудином позволяют добиться повышения или сохранения остроты зрения и не сопровождаются существенными повреждениями прилегающей здоровой сетчатки и хориокапилляров.
ФДТ с визудином представляет собой важный шаг в терапии глазных болезней. Однако, отсутствие значительного повышения остроты зрения, нестабильность результатов и высокий процент рецидивов неоваскуляризации говорит о том, что данный метод требует дальнейшего усовершенствования. Повышение селективности процедуры посредством применения фотосенсибилизаторов направленного транспорта, а также с комбинированием данного метода лечения с введением антиангиогенных препаратов и апоптозных модуляторов, может, наравне с селективностью, повысить эффективность и уменьшить частоту рецидивирования после проведения ФДТ. Разработка стратегий местного, долгосрочного, минимально инфазивного введения препаратов позволит нам в будущем повысить эффективность и предсказуемость этого метода терапии.
ИЛЛЮСТРАЦИИ

Рисунок 1. Нормальная картина глазного дна на ФА.

Рисунок 2. Артериовенозная фаза ФА у пациента с единичными друзами. Нормальная структура глазного дна.
Рекомендован контроль состояния глазного дна не реже одного раза в шесть месяцев.

Рисунок 3. Локальная отслойка пигментного ретинального эпителия. Поздняя фаза ФА.
Показана ангиопротекторная терапия.
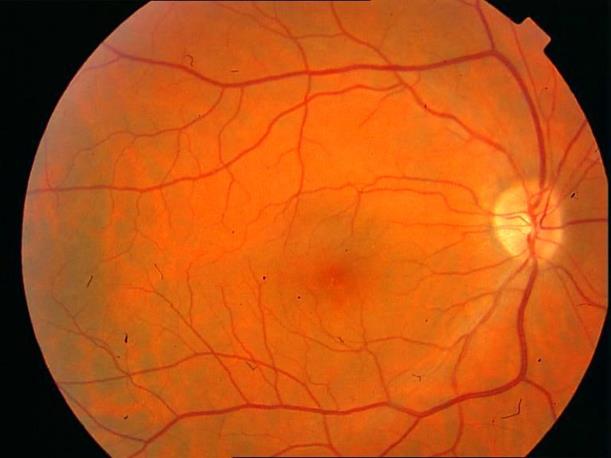
Рисунок 4. Мелкие интраретинальные друзы в заднем полюсе.

Рисунок 5. На ФА этого же больного гиперфлюоресценция в области скопления друз парамакулярно на 10.30. Изменена нормальная структурность центральной аваскулярной зоны.
Показан контроль АД, уровня холестерина крови. Назначаются препараты, улучшающие трофику сетчатки. Контроль состояния глазного дна не реже одного раза в шесть месяцев.

Рисунок 6. Географическая атрофия пигментного ретинального эпителия.
Показана консервативная терапия, направленная на улучшение микроциркуляции. Развития СНМ не ожидается. Острота зрения – 0,09 – 0,1 с максимальной коррекцией. Чтение с лупой текста №8. Риск дальнейшего снижения остроты зрения умеренный.

Рисунок 7. Атрофический очаг хориоидеи и пигментного ретинального эпителя в исходе перенесенного врожденного центрального хориоретинита.
Развития СНМ не ожидается.

Рисунок 8. Центральная хориоретинальная дистрофия. Отек сетчатки, дезорганизация пигмента в фовеа. Твердые друзы в заднем полюсе.

Рисунок 9. На ФА этого же больного видны дефекты пигментного эпителия в области дистрофии и дефекты мембраны Бруха в верхнем сегменте фовеа.
Показана консервативная ангиопротекторная и ноотропная терапия. Вероятность развития СНМ высокая.

Рисунок 10. Большой очаг атрофии пигментного эпителия, интраретинальный фиброз в макуле. По краю очага старые твердые экссудаты.
Острота зрения – сотые. Лечебные мероприятия малоперспективны.
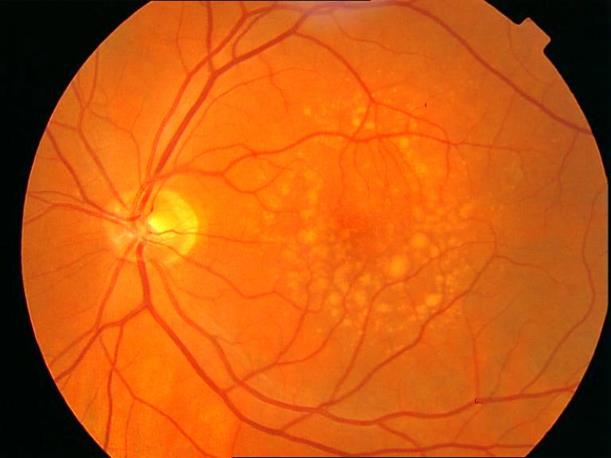
Рисунок 11. Мягкие сливные друзы в заднем полюсе на фоне сенильной макулодистрофии. Острота зрения с максимальной коррекцией 0,7.

Рисунок 12. ФА этого же больного.
Показано консервативное лечение, направленное на улучшение трофических процессов в заднем полюсе. Вероятность развития СНМ высокая. Рекомендован контроль состояния глазного дна один раз в 3 – 6 месяцев. Возможна прямая (субпороговая, микроимпульсная) лазеркоагуляция мягких друз.
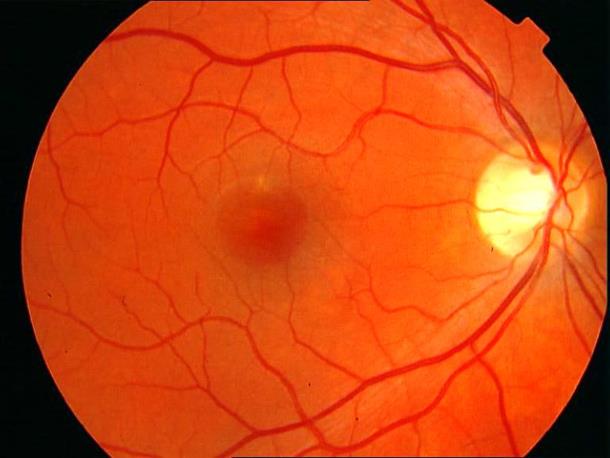
Рисунок 13. Центральная серозная хориоретинопатия. Отслойка нейроэпителия в фовеа.
Острота зрения с максимальной коррекцией 0,4. Жалобы на «пятно» перед глазом, искажения предметов.
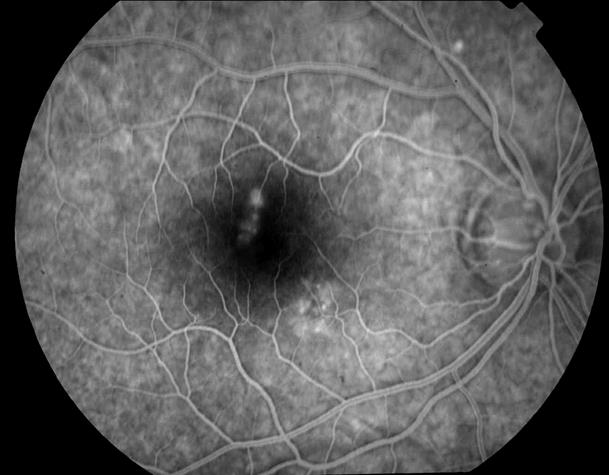
Рисунок 14. Этот же больной. Очажки просачивания по ходу веточки верхнее-височной артерии на ФА.
Показано длительное назначение ангиопротекторов (дицинон, добезилат кальция и т.п.). Возможна прямая лазеркогуляция наиболее яркой точки просачивания по краю центральной аваскулярной зоны на 12 часах.

Рисунок 15. Центральная серозная хориоретинопатия. Отслойка нейроэпителия в фовеа.
Жалобы на «пятно» перед глазом, искажение предметов. Острота зрения 0,8, коррекции не поддается.
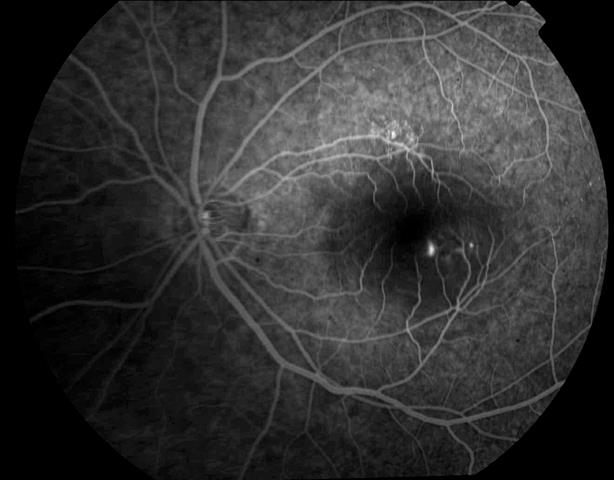
Рисунок 16. На ФА этого же больного определяются две точки просачивания.
Выполнена прямая лазеркоагуляция точек просачивания, назначены ангиопротекторные препараты. Зрение поднялось до1,0 (исходного), жалобы на искажения и «пятно» перед глазом исчезли.
Вероятность развития СНМ и значительного снижения центрального зрения без лазерного лечения высокая.

Рисунок 17. Отек сетчатки в маклярной зоне, скопления твердых и мягких экссудатов по краю. В фовеа предположительно скрытая хориоидальная неоваскуляризация.
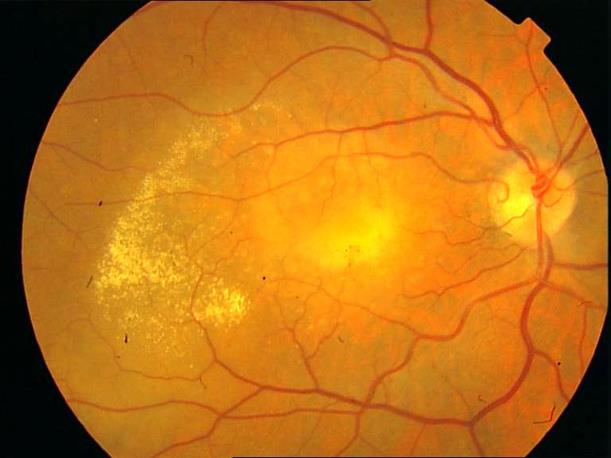
Рисунок 18. Влажная форма сенильной макулодистрофии. Обширная зона отека сетчатки, множественные интраретинальные включения.

Рисунок 19. На ФА этого же больного признаки ишемического отека сетчатки и формирующегося интраретинального рубца в макуле.
Показана консервативная терапия ишемических изменений. Острота зрения 0,05 с максимальной коррекцией. Прогноз неблагоприятный.
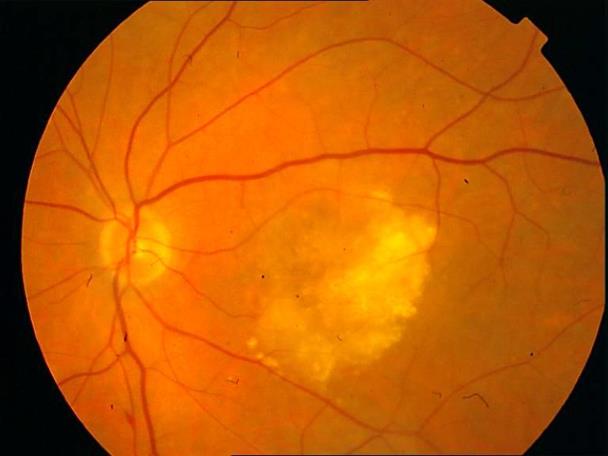
Рисунок 20. Влажная форма сенильной макулодистрофии. Отек сетчатки в макулярной зоне, сливные интраретинальные экссудаты в большом количестве, дезорганизация пигмента.

Рисунок 21. ФА того же больного. Ишемический отек и скопления экссудатов экранируют свечение центральной части макулярной зоны.
Острота зрения – сотые. Лечебные мероприятия малоперспективны.

Рисунок 22. Глазное дно пациента с близорукостью высокой степени. Подозрение на субфовеальную СНМ. Показано проведение ФА.
При выявлении СНМ – проведение ФДТ. Показана ангиопротекторная терапия и местное введение стероидных препаратов (дипроспан, кеналог парабульбарно).
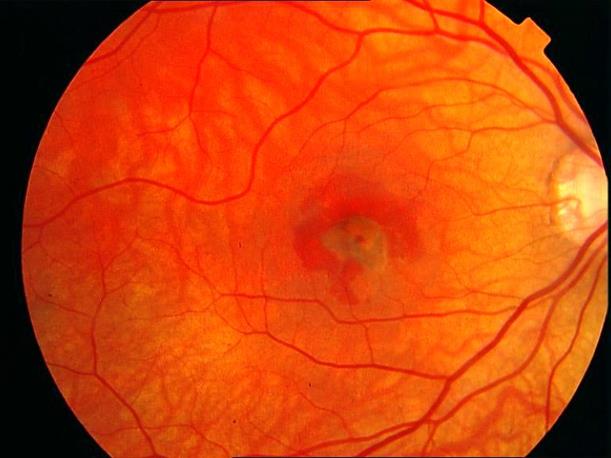
Рисунок 23. Субретинальная неоваскулярная мембрана, интраретинальное кровоизлияние.
Покзано выпонение ФА и ФДТ в ближайшее время (проведено).
Острота зрения с максимальной коррекцией 0,1. Ранее пациент получал консервативное лечение, на фоне которого зрение прогрессивно снижалось.

Рисунок 24. Фотография глазного дна этого же пациента через 2 года.
Полный регресс неоваскулярной мембраны. В фовеа определяется дезорганизация пигмента и нежный интраретинальный рубчик.
Острота зрения с максимальной коррекцией 0,9 – 1,0 (миопия высокой степени).

Рисунок 25. Субфовеальная СНМ, отслойка нейроэпителия в фовеа с геморрагическим компонентом.
Показано выполнение ФА с последующей ФДТ.

Рисунок 26. Серозная отслойка пигментного и нейроэпителия, субретинальная неоваскулярная мембрана, осложненная интраретинальным кровоизлиянием.
Показано проведение ФА. Выполнение ФДТ возможно. Прогноз по остроте зрения неблагоприятный.

Рисунок 27. Венозная фаза ФА. Субретинальная неоваскулярная мембрана с видимым питающим сосудом.

Рисунок 28. Тот же больной. Венозная фаза ФА.

Рисунок 29. Тот же больной. Фаза рециркуляции ФА.
Выполнена ФДТ с визудином. Острота зрения с 0,02 поднялась до 0,2. Читает с расстояния 10см текст №7. Функции остаются стабильными 2 года.

Рисунок 30. Миопическое глазное дно. Субретинальная неоваскулярная мембрана. Острота зрения с максимальной коррекцией 0,2.
Показано выполнение ФА с последующей ФДТ.

Рисунок 31. Серозная отслойка нейроэпителия, субретинальная неоваскулярная мембрана, осложненная интраретинальным кровоизлиянием.

Рисунок 32. ФА этого больного. Поздняя венозная фаза.

Рисунок 33. Тот же больной при естественном течении заболевания через 7 месяцев. Серозная отслойка нейроэпителия, геморрагическая отслойка пигментного эпителия, субретинальная неоваскулярная мембрана, осложненная интраретинальным кровоизлиянием, мелкие интраретинальные друзы.

Рисунок 34. Большое количество интраретинальных друз. Отсутствие физиологических световых рефлексов. Рыхлость, отечность сетчатки в фовеа и парафовеа в верхне-наружном сегменте. Участок гиперпигментации хориоидеи на 6 – 6.30 на границе макулы.
Острота зрения вдаль 0.1, с коррекцией +1,0 дптр 0,5. С +3,5 дптр при хорошем освещении читает вблизи текст № 9.

Рисунок 35. ФА этого же пациента. Множественные мелкие учатки гипо и гиперфлюоресценции в проекции друз. СНМ на 10.30 в фовеа-парафовеа. Участок гипофлюоресценции в области гиперпигментации хориоидеи.
Проведена ФДТ с визудином.
Через 2 недели острота зрения вдаль с коррекцией +1,0 дптр 0,9, читает текста № 3 с плюсовой коррекцией.

Рисунок 36. Картина глазного дна этого же пациента через 3 месяца после ФДТ.
Жалобы на появление «пятна» перед глазом. Острота зрения вдаль с максимальной коррекцией 0,4, вблизи может прочитать текст №7, ощущает искажения.
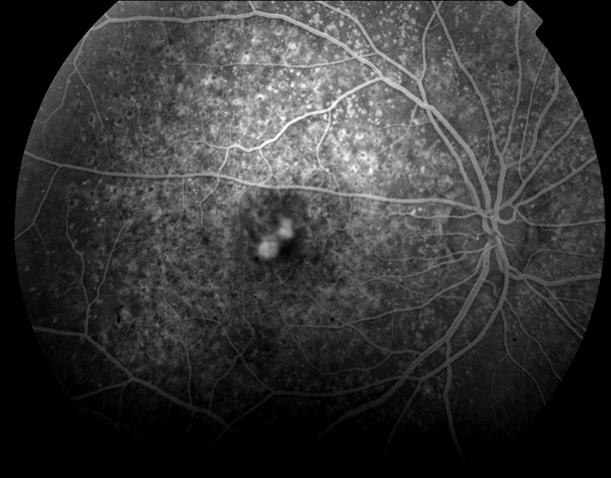
Рисунок 37. На ФА в фовеа видны два новых очага СНМ. Пролеченные ФДТ очаги СНМ, запустели. Выполнен повторный сеанс ФДТ.
В течение 12 месяцев сохраняется зрение вдаль с максимальной коррекцией 0,5, вблизи при хорошем освещении читает текст № 5 (острота зрения 0,6).

Рисунок 38. Центральная хориоретинальная дистрофия, осложненная субретинальной неоваскулярной мембраной и интраретинальным кровоизлиянием. Острота зрения – сотые.

Рисунок 39. ФА этого больного в венозную фазу. ХНВ более 1 ДД в заднем полюсе.
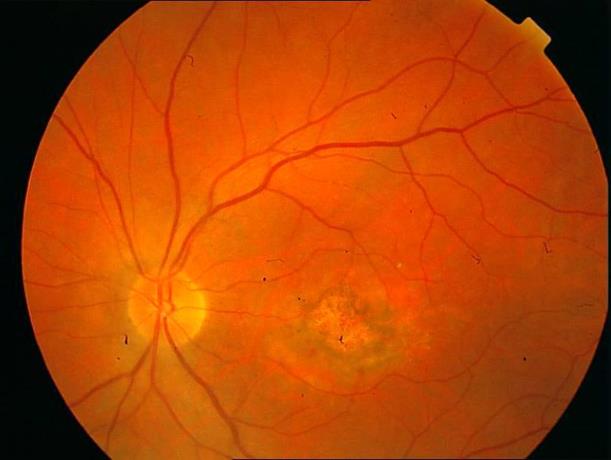
Рисунок 40. Глазное дно этого больного через 3 месяца после ФДТ. Зрительные функции повысились, вдаль зрение до 0,3, но способности к чтению нет.

Рисунок 41. На ФА в фазу рециркуляции остатки неактивной СНМ.
Показано консервативное лечение центральной хориоретинальной дистрофии, контроль состояния глазного дна и выполнение ФА (по показаниям) каждые 3 месяца.
Состояние остается стабильным 12 месяцев.

Рисунок 42. Сенильная макулодистрофия, влажная форма с геморрагическим компонентом.
Острота зрения 0,04.

Рисунок 43. На ФА у этого больного признаки скрытой ХНВ в наружной части макулы (35 секунда).
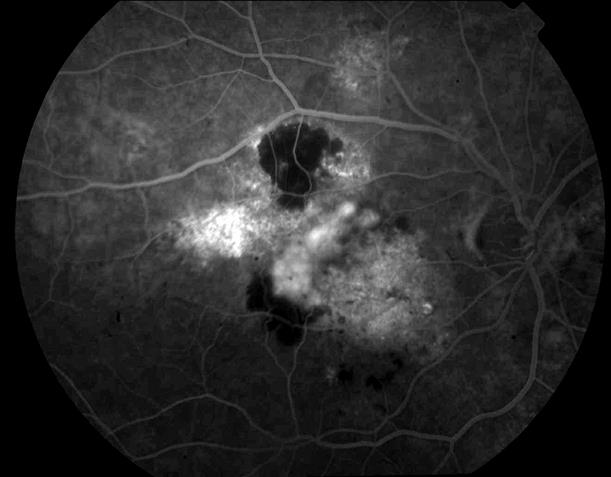
Рисунок 44. Со временем свечение в области ХНВ увеличивается (60 секунда).
Показано консервативное лечение, направленное на поддержание трофических процессов в сетчатке, назначение кортикостероидов местно. Возможно проведение ФДТ. Прогноз неблагоприятный.

Рисунок 45. Исход СНМ в миопическом глазу. Интраретинальный, частично пигментированный рубец в фовеа (пятно Фукса).
Остаточное центральное зрение.

Рисунок 46. На фоне атрофических явлений в заднем полюсе пигментированный очаг в нижнее-внутреннем сегменте фовеа с интраретинальными кровоизлияниями по его краю.
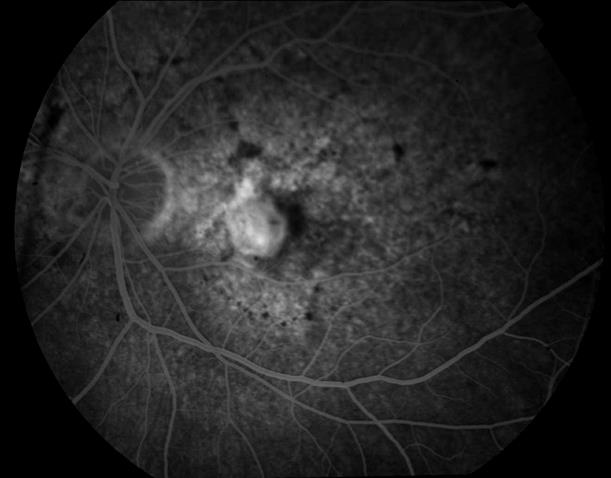
Рисунок 47. На ФА этого же больного признаки интраретинального рубца и скрытой СНМ.
Показана консервативная ангиопротекторная и ферментная терапия. Эффективность ФДТ сомнительна. Острота зрения – сотые. Прогноз неблагоприятный.

Рисунок 48. Интраретинальный фиброз, кровоизлияния в макуле при естественном течении ХНВ на фоне СМД.
Остаточная острота зрения. Лечебные мероприятия малоперспективны.

Рисунок 49. Обширная зона атрофии пигментного ретинального эпителия в заднем полюсе. По его краю в нижнее-наружной полусфере интраретинальный фиброз в исходе кровоизлияния.
Острота зрения - сотые. Лечебные мероприятия малоперспективны.

Рисунок 50. В заднем полюсе виден интраретинальный очаг грязно-зеленого цвета и интраретинальные кровоизлияния вокруг него.

Рисунок 51. На ФА этого же больного определяется большой интраретинальный рубец, признаки скрытой ХНВ. Области гипофлюоресценции соответствуют интраретинальным кровоизлияниям.
Показана консервативная ангиопротекторная и ферментная терапия. Эффективность ФДТ сомнительна. Острота зрения – сотые. Прогноз неблагоприятный.

Рисунок 52. Интраретинальный рубец в макулярной зоне. Интраретинальное кровоизлияние над нижнее височной веной.

Рисунок 53. Неоваскуляризация рубца на ФА у этого же пациента.
ФДТ не показана.

Рисунок 54. Рубцовая форма СМД. Сетчатка в заднем полюсе резко утолщена, интраретинальный фиброз, интраретинальные кровоизлияния, твердые экссудаты по краю.
Остаточная острота зрения. Лечебные мероприятия малоперспективны.

Рисунок 55. Фотография глазного дна пациента с жалобами на «пятно» перед глазом в течение 4 месяцев. Лечения не получал. Острота зрения 0,7. Коррекции не поддается. В фовеа темпоральнее фовеолярного рефлекса виден интраретинальный очаг с грязно зеленым оттенком и снижением плотности пигмента вокруг него. На 11 – 12 часах под уплотненной артерией видны хориоретинальные дистрофические очажки. На 4 – 4.30 парамакулярно определяется очаг гиперпигментации хориоидеи.
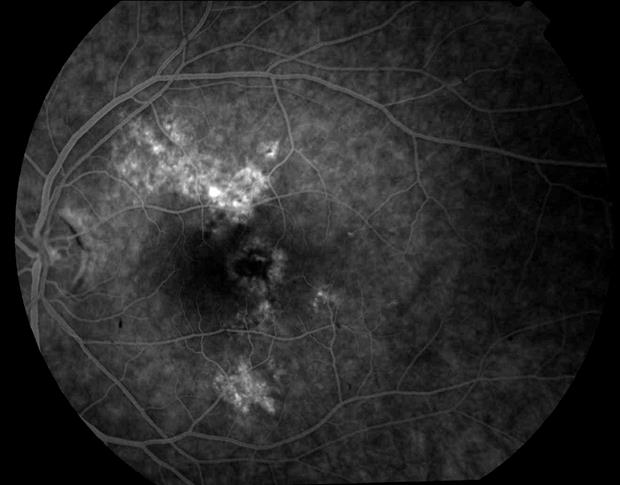
Рисунок 56. ФА этого же больного.
Участки гиперфлюоресценции в заднем полюсе (дефекты пигментного эпителия сетчатки). В области фовеального очага и гиперпигментации хориоидеи определяются зоны гипофлюоресценции.
Представлен случай самопроизвольного рубцевания субфовеальной СНМ.
Больному показаны курсы тканевой, нейропротекторной терапии.
Литература
1. Тhe Macular Photocoagulation Studу Group. Тhе use of fundus photographs and fluorescein angiograms in thе identification and treatment of choroidal neovascularization in thе Macular Photocoagulation Study. Ophthalmology 1989;96: 1526-1534.
2. Macular Photocoagulation Study Group. Subfoveal neovascular lesions in age-related macular degeneration. Guidelines for evaluation and treatment in the Macular Photocoagulation Study. Arch Ophthalmol 1991;109:1242-1257.
3. Macular Photocoagulation Study Group. Occult choroidal nеоvascularization. Influence оn visual outcome in patients with age-related macular degeneration. Arch Ophthalmol 1996; 114: 400-412.
4. Coscas G, Glaser B, Green WA. et al. Dégénerescences maculaires liées à l’âge et néovaisseaux rétiniens. Paris: Masson, 1991.
5. Gass JDM. Pathogenesis of disciform detachment of the neuroepithelium. IV. Fluorescein angiographic study of senile disciform macular degeneration. Аm J Ophthalmol 1967;63: 644-659.
6. Scheider А, Kaboth А, Neuhauser L. Detection of subrertinal nеоvascular membranes with indocyanine green and аnd infrared scanning laser ophthalmoscope. Аm J Ophthalmol 1992;113: 45-51.
7. Soubrane G, Arnold J, Quaranta М. Atteintes dégénératives de l'épithélium pigmentaire. In: Soubrane G, ed. Les affections acqиises de l'épithélium pigmeпtaire. Marseille: Fuery-Lamy, 1995: 169-204.
8. Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (ТАР) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin. One-year results of 2 randomized clinical trials – TAP Report 1. Arch Ophthalmol 1999; 117: 1329-1345.
9. Patz A, Flover RW, Klein ML, et al. Clinical applications of indocyanine green angiography. Doc Ophthalmol Proc Series 1976;9:245-251.
10. Cherrick GR, Stein SW, Leevy CM, et al. Indocyanine green: observations on its physical properties, plasma decay. And hepatic extraction. J Clin Invest 1960;39:592.
11. Baker KJ. Binding of sulfobromophthalein (BSP) sodium and indocyanine green (ICG) by plasma al-lipiproteins. Proc Soc Exp Biol Med 1966;122:957.
12. Leevy CM, Bender J, Silverberg M, et al. Physiology of dye extraction by the liver: comparative studies of sulfobrophthalein and indocyanine green. Ann NY Acad Sci 1963;111:161.
13. Yannuzzi LA, Slakter JS, Sorenson JS, еt al. Digital indocyanine green videoangiography and choroidal neovascularization. Retina 1992; 12: 191-223.
14. Yannuzzi LA, Sorenson JS, Spaide RF еt al. Idiopathic polypoidal choroidal vasculopathy. Retina 1990;10:1-8.
15. Yannuzzi LA, Ciardella AP, Spaide RF, еt al. The expanding clinical spectrum of idiopathic polypoidal choroidal vasculopathy. Arch Ophthalmol 1999;115:478-485.
16. Kuhn D, Meunier I, Soubrane G, et al. Imaging а chorioretinal anastomoses in vascularized retinal pigment epithelium detachments. Arch Ophthalmol 1995; 113: 1392-1398.
17. Yannuzzi LA, Negrao S, Iida T, et al. Retinal angiomatous proliferation in age-related macular degeneration. Retina 2001;21:416-434.
18. Slakter JS, Yannuzzi LA,Scheider U, et al. Retinal choroidal anastomosis and occult choroidal neovascularization. Ophthalmology 2000;107:742-753.
19. Schwartz S, Guyer DR, Yannuzzi LA, et al. Indocyanine green videoangiography guided laser photocoagulation of primary occult choroidal neovascularization in age-related macular degeneration. Invest Ophthalmol Vis Sci 1995;36:186.
20. Guyer DR, Yannuzzi LA, Slakter JS, et al. Digital indocyanine-green videoangiography of occult choroidal neovascularizayion. Ophthalmology 1994;101:1727-1737.
21. Guyer DR, Yannuzzi LA, Slakter JS, et al. Classification of choroidal neovascularizayion by digital indocyanine green videoangiography. Ophthalmology 1996;103:2054-2060.
22. Giovanni А, Аmаto GP, Mariotti С, et al. ОСТ imaging of сhоroidal neovascularization and its role in thе determination of patients' eligibility for surgery. Br J Ophthalmol 1999;83:438-442.
23. Измайлов А.С., Балашевич Л.И. Хориоидальная неоваскуляризация (диагностика и лечение). С.-Петербург:СПбМАПО, 2001, C24-29.
24. Mainster M.A., Reichel E. Transpupillary thermotherapy for age-related macular degeneration: long-pulse photocoagulation, apoptosis, and heat shock proteins. Ophthalmic Surgery and Lasers 2000;vol. 31, № 5:359-373.
25. Thomas МА, Dickinson JD, Melberg NS, et аl. Visual results after surgical rеmоvаl оf subfoveal choroidal neovascular mеmbranes. Ophthalmology 1994;101:1384-1396.
26. Machemer R, Steinhorst UH. Retinal separation, retinotomy, and macular relocation, I: experimental studies in the rabbit еyе. Graefes Arch Clin Ехр Ophthalmol 1993;231 :629-634.
27. Machemer R, Steinhorst UH. Retinal separation, retinortomy, and macular relocation II: surgical approach fоr age-related macular degeneration? Graefes Arch Clin Еxр Ophthalmol 1993;231 :635-641.
28. Lindsey Р, Finkelstein D, D'Аnnа S. Experimental retinal rеlосаtion. ARVO аbstасts. Invest Ophthalmol Vis Sci 1983;24:242.
29. Tiedeman J, de Juan Е Jr, Machemer R, еt al. Surgical relocation оf the macula. ARVO abstracts. Invest Ophthalmol Vis Sci 1985;26:59.
30. Ninomiya Y, Lewis JM, Hasegawa Т, еt аl. Rerinotomy and fоvеаl translocation for surgical management оf subfoveal choroidal neovascular membranes. Аm J Ophthalmol 1996;I22:613-621.
31. Imai К, de Juan Е Jr. Experimental surgical macular relocation by scleral shortening. ARVO abstracts. Invest Ophthalmol Vis Sci 1996;37:S116.
32. de Juan Е Jr, Lowenstein А, Bressler NM, еt аl. Translocation оf the retina for management оf subfoveal choroidal neovascularization,II: а preliminary rероrt in humans. Аm J Ophthalmol 1998; 125:635-646.
33. Imai К, Loewenstein А, de Juan Е Jr. Translocation оf the retina for management оf subfoveal choroidal neovascularization. I: Experimental studies in the rabbit еуе. Аm J Ophthalmol 1998; 125:627-634.
34. Fujikado Т, Ohji M, Saito Y, еt аl. Visual function after Visual translocation with scleral shortening in patients with myopic neovascular maculopathy. Аm J Ophthalmol 1998; 125: 647-656.
35. Spikes J. Historical review. Photodynamic action: from paramecium to photochemotherapy. Photochem Photobiol 1997; 65S; 142S-147S.
36. Rabb C. Uber die Wirkung Fluroeszierenden Stoffe auf Infusoria. Z Biol 1900; 39:524-526.
37. von Tappeiner H, Jensionek A. Therapeutische Versuche mit fluorescierenden Stoffen. Munch Med Wochenshr 1903; 47:2042-2044.
38. Meyer-Betz F. Untersuchengen uber die biologische (photodynamische) Wirkung des Hamatopophyrins und anderer Derivative des Blut-und Gallenfarbstoffs. Dtsch Arch Klin Med 1913;112: 476-503.
39. Lipson R, Blades E. The photodynamic properties of a particular hematoporphyrin derivative. Arch Dermatol 1960; 82:508-516.
40. Diamond I, McDonagh A, Wilson C, et al. Photodymanic therapy of malignant tumors. Lancet 1972; 2: 1175-1177.
41. Dougherty T, Grindley G, Fiel R, et al. Photradiation therapy II: cure of animal tumors with hematoporphyrin derivative and light. J Natl Cancer Inst 1975; 55: 115-121.
42. Dougherty T, Lawrence G, Kaufman J, et al. Photoradiation in the treatment of recurrent breast carcinoma. J Natl Cancer Inst 1979; 62: 231-237.
43. Dougherty T. Photosensitization of malignant tumors. Semin Surg Oncol 1986; 2: 24-37
44. Weishaupt K, Gomer C, Dougherty T. Identification of singlet oxygen as the cytotoxic agent in photo-inactivation of murine tumor. Cancer Res 1976; 36: 2326-2329.
45. Buettner G, Oberly L. The apparent production of superoxide and hydroxyl radicals by hematoporphyrin and light as seen by spin-trapping. Fed Biol Sci Letts 1980; 121: 161-164.
46. Svaasand L, Ellingson R. Optical properties of human brain. Photochem Photbiol 1983; 38: 283-289.
47. Hasan T, Parish J. Photodynamic therapy of cancer. In: Holland JEA, ed. Cancer Medicine, vol 1, 4th ed. Baltimore: Williams & Wilkins, 1997: 739-751.
48. Figge F, Weiland G, Manganiello L, et al. Cancer detection and therapy. Affinity of neplastic, embryonic and traumatized tissues for porphyrins and metalloporphyrins. J Proc Soc Exp Biol Med 1948; 68: 640-641.
49. Jori G, Tomio L, Reddi E, et al. Rreferential delivery of liposomeincorporated porphyin to neoplastic cells in tumour-bearing rats. Br J Cancer 1983; 48: 307-309.
50. Allison BA, Watefield E, Richter AM, et al. The effects of plasma lipoproteins on in vitro tumor cell killing and in vivo tumo photosensitization with benzoporphtrin derivative. Photochem Ptotobiol 1991; 54: 709-715.
51. Jori G. Low Density Lipoprotein-liposome delivery system for tumor photodynamic therapy: basic principles and clinical applications. New York: Marcel Dekker, 1992 : 173-186.
52. Kessel D. Porphyrin-lipoprotein association as a factor in porphyrin localization. Cancer Letts 1986; 33: 183-188.
53. Jiang F, Allison B, Liu D, Levy J. Enhanced photodynamic killing of target cells by either monoclonal antibody of low density lipoprotein mediated delivery systems. J Contolled Rel 1992; 19: 41-58.
54. Renno RZ. Miller JW. Photosensitizer delivery for photodynamic therapy of choroidal neovascularization. Adv Drug Deliv Rev 2001; 52: 63-78.
55. Kessel D, Luo Y. Mitochondrial photodamage and PDT-induced apoptosis. J Photchem Photobiol B Biol 1998; 42: 89-95.
56. Fingar V. Vascular effect of photodynamic therapy. J Clin Laser Med Surg 1996; 14: 323-328.
57. Miller H, Miller B. Photodynamic therapy of subretinal neovascularization in the monkey eye. Arch Ophthalmol 1993; 111: 855-860.
58. Miller JW, Walsh AW, Kramer M, et. Al. Photodynamic therapy of experimental choroidal neovascularization using lipoprotein-dilivered benzoporphyrin. Arch Ophthalmol 1995; 113: 810-818.
59. Kramer M, Miller J, Michaud N, et al. Liposomal BPD verteporfin photodynamic therapy: selective treatment of choroidal neovascularization in monkeys. Ophthalmology 1996; 103: 427-438.
60. Moulton RS, Walsh AW, Miller JW, et al. Response of retinal and choroidal vessels to photodynamic therapy using benzoporphyrin derivative monacid. Invest Ophthal Vis Sci 1993; 34: 1169.
61. Husain D, Miller J, Michaud N, et al. Intravenous infusion using liposomal benzoporphyrin derivative verteporfin for photodynamic therapy of experimental choroidal neovascularization . Arch Ophthalmol 1996; 114: 978-985.
62. Mori K, Ohta M, Katagiri T. Photodynamic therapy (PDT) with a combination of a new photsensitizer: NPe6 and a diode laser emitting at 664 nm. Invest Ophtahal Vis Sci 1996; 37: S3177.
63. Miller J, Schmidt-Erfurth U, Sickenberg M, et al. Photodynamic therapy with verteporfin for choroidal neovascularization caused by age-related macular degeneration. Results of a single treatment in a Phase 1 and 2 study. Arch Ophthalmol 1999; 117: 1161-1173.
64. Arbour J, Connolly E, Palmer J, et al. Digital angiography of CNV in the monkey using benzoporphyrin. Phthalocyanine, and rose Bengal. Invest Ophthal Vis Sci 1998; 39; S590.
65. Graham K, Arbour J, Connolly E, et al. Digital angiography using lutetium texaphyrin in a monkey model of choroidal neovascularization. Invest Ophthal Vis Sci (ARVO Abstract) 1999; 40: S402.
66. Kramer M, Kenney A, Delori F, et al. Imaging of experimental choroidal neovascularization (CNV) using liposomal benzoporphyrin derivative monoacid (BPD-MA) angiography. Invest Ophthal Vis Sci 1995; 36:S236.
67. Blumenkranz M, Woodburn K, Verdooner S. Lutex texaphyrin angiography: a new method for the evaluation and treatment of retinal and choroidal vascular disorders. Invest Ophthal Vis Sci 1998; 36: S468.
68. Bonnet R, Ridge R, Scourides P, et al. On the nature of hematoporphyrin derivative. J Chem. Soc Perkins Trans 1981; 1: 3135-3140.
69. Davidorf J, Davidorf F. Treatment of iris melanoma with photodynamic therapy. Ophthal Surg 1992; 23: 522-527.
70. Nelson J, Roberts W, Berns MW. In vivo studies on the utilization of mono-l-aspartyl chlorin (NPe6) for photodynamic therapy. Cancer Res 1987; 47: 4681-4685.
71. Schuitmaker J, van Best J, van Delft J, et al. Bacteriochlorin a, a new photosensitizer in photodynamic therapy. Invest Ophthal Vis Sci 1990; 31: 1444-1450.
72. Richter AM, Watefield E, Jain AK, et al. Photosensitising potency of structural analogues of benzoporhyrin derivative (BPD) in a mouse tumour model. Br J Cancer 1991; 63: 87-93.
73. Treatment of Age-related Macular Degeneration with Photodynamic Therapy (TAP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin. Two-year vision results of two randomized clinical trials. Arch Ophthalmol 2001; 119:198-207.
74. Baumal C, Puliafito C, Piieroth L, et al. Photodynamic therapy (PDT) of experimental choroidal neovascularization with tin ethyl etiopurpurin. Invest Optthal Vis Sci 1996; 37:S122.
75. Obana A, Gohto Y, Miki T, et al. Photodynamic therapy of choroidal vessels using a newly developed chlorin derivative (ATX-S10). Invest Ophthal Vis Sci 1996; 37:S549.
76. Kreimer-Birnbaum M. Modified porphyrins, chlorines, phthalocyanines, and purpurins: second-generation photosensitizers for photodynamic therapy. Semin Hematol 1989; 26: 157-173.
77. Morgan A, Skalkos D. Second generation sensitizers: where are we and where are we and where should we be going? Proc SPIE 1990; 6:87-106.
78. Kliman G, Puliafito C, Stern D, et al. Phthalocyanine photodynamic therapy: new strategy for closure of choroidal neovascularization. Lasers Surg Med 1994; 15: 2-10.
79. Miller JW, Stinson WG, Gregory WA, et al. Phthalocyanine photodynamic therapy of experimental iris neovascularization. Ophthalmology 1991; 98: 1711-1719.
80. Panagopoulos JA, Svitra PP, Puliafito CA, et al. Photodynamic therapy for experimental intraocular melanoma using chloraluminum sulfonated phthalocyanine. Arch Ophthalmology 1989; 107: 892-897.
81. Young S, Woodburn K, Wright M, et al. Lutetium texaphyrin (PCI-0123): a near-infrared, water-soluble photosensitizer. Photochem Photobiol 1996; 63: 892-897.
82. Woodburn K, Fan Q, Kessel D, et al. Phototherapy of cancer and atheromatous plaque with texaphyrins. J Clin Laser Med Surg 1996; 14: 343-348.
83. Woodburn K, Fan Q, Miles D, et al. Localization and efficacy analysis of the phototherapeutic lutetium texaphyrin (PCI-0123) in the murine EMT6 sarcoma model. Photochem Photobiol 1997; 65: 410-415.
84. Arbour J, Graham K, Carson D, et al. Photodynamic therapy of experimental choroidal neovascularization in a monkey model using intravenous infusion of lutetium texaphyrin. Invest Ophthalmol Vis Sci (ARVO Abstract)1999; 40: S401.
85. Blumenkranz MS, Woodburn KW, Qing F, et al. Lutetium texaphyrin (Lutex): a potential new agent for ocular fundus angiography and photodynamic therapy. Am J Ophthalmol Mar 2000;129: 353-362.
86. Yoshikawa K, Kurata H, Iwahara S, et al. Photodynamic action of fluorescein dyes in DNA-damage and in vitro inactivation of transforming DNA in bacteria. Mutat Res 1978; 56: 359-362.
87. Gandin E, Lion Y, Van De Vorst A, et al. Quantum yield of singlet oxygen production by xanthene derivatives. Photochem Photobiol 1983; 37: 271-278.
88. Nanda S, Hatchell D, Tiedeman J, et al. A new method of vascular occlusion. Arch Ophthalmol 1987; 105: 1121-1124.
89. Wilson C, Hatchell D. Photodynamic retinal vascular throbosis. Invest Ophthal Vis Sci 1991; 32: 2357-2365.
90. Royster A, Nanda S, Hatchell D, et al. Photochemical initiation of thrombosis. Arch Ophthalmol 1988; 106: 1608-1614.
91. Tse D, Dutton J, Weingeist T, et al. Hematoporphyrin photoradiation therapy for intraocular and orbital malignant melanoma. Arch Ophthalmol 1984; 102: 833-838.
92. Sery T, Shields J, Augsburger J, et al. Photodynamic therapy of human ocular cancer. Ophthal 1987; 18: 413-418.
93. Chambers R, Arnson D, Davidorf F, et al. Treatment of iris melanoma with dehermatoporphyrin ether and an ophthalmic laser delivery system. Contemp Ophthal For 1986; 4: 70-84.
94. Lewis R, Tse D, Phelphs C, et al. Neovascular glaucoma after photoradiation therapy for uveal melanoma. Arch Ophthalmol 1984; 102: 839-842.
95. Gomer CJ, Jester JV, Razum NJ, et al. Photodynamic therapy of intraocular tumors: examination of hematoporphyrin derivative distribution and long-term damage in rabbit ocular tissue. Cancer Res 1985; 45: 3718-3725.
96. Sery T, Dougherty T. Photoradiation of rabbit ocular malignant melamona sensitized with hematopophyrin derivative. Curr Eye Res 1984; 3: 519-528.
97. Franken K, van Delft J, Dubelman T, et al. Hematoporphyrin derivative photoradiation treatment of experimental malignant melanoma in the anterior chamber of the rabbit. Curr Eye Res 1985; 4 : 641-654.
98. Gomer C, Murphree A, Doiron D, et al. Preclinical evaluation of ocular photoradiation therapy. Paper presented at: Proceedings of the international symposium on porphyrins in tumor phototherapy, New York, 1984.
99. Liu H, Chuo N. Hematoporphyrin phototherapy for experimental intraocular malignant melanoma. Arch Ophthalmol 1983; 101 : 901-903.
100. Franken N, Vrensen G, van Delft J, eta al. Early morphological changes induced by photodynamic therapy in amelanotic Greene melanoma implanted in the anterior eye chamber of rabbits. Laser Surg Med 1988; 3: 27-34.
101. Schmidt-Erfurth U, Flotte T, Gragoudas ES, et al. Benzoporphyrin-lipoprotin-mediated photodestruction of intraocular tumors. Exp Eye Res 1996; 62:1-10.
102. Bruce RJ. Evaluation of hematoporphyrin photoradiation therapy to treat choroidal malamoma. Sasers Surg Med 1984; 4: 59-64.
103. Bruce RJ. Photoradiation therapy for choroidal malignant melamoma. In: Mc Caughan JJ, ed. A clinical manual: photodynamic therapy of malignancies. Austin: RG Landes, 1993.
104. Muphree A, Cote M, Gomer C, The evolution of photodynamic therapy techniques in the treatment of intraocular tumors. Photochem Photobiol 1987; 46: 919-923.
105. Favilla I, Barry W, Gosbell A, et al. Phototherapy of posterior uveal melanomas. Br J Ophthalmol 1991; 75: 718-721.
106. Lingua R, Parel J. Photodynamic therapy for ocular tumors. J Phototchem Photobiol B Biol 1991: 119-122.
107. Schmidt-Erfurth U, Bauman W, Gragoudas E, et al. Photodynamic therapy of experimental choroidal melanoma using lipoprotein-delivered benzoporphyrin. Ophthalmology 1994; 101: 89-99.
108. Gomzalez V, Hu L, Theodossiadis P, et al. Photodynamic therapy of pigmented choroidal melanomas. Invest Ophthal Vis Sci 1995; 36: 871-878.
109. Phillips A, Browne B, Allan D. Haematoporphyrin photosensitization treatment of experimental choroidal melanoma. Eye 1987; 1: 680-685.
110. Ozler S, Nelson S, Liggett P, et al. Photodynamic therapy of experimental subchoroidal melanoma using cholraluminum sulfonated phthalocyanine. Arch Ophthalmol 1992; 110: 555-561.
111. Young L, Howard M, Hu L, et al. Photodynamic therapy of pigmented choroidal melanomas using a liposomal preparation of benzoporphyrin derivative. Arch Ophtalmol 1996; 114: 186-192.
112. Hu L, Huh K, Foster S, et al. Photodynamic therapy of pigmented choroidal melanomas in a rabbit model. Retina 1994; 14: 264-269.
113. Kim R, Hu L, Foster S, et al. Photodynamic therapy of pigmented choroidal melanomas of greater than 3 mm thichness. Ophthalmology 1996; 103 : 3029-2036.
114. Ohnishi Y, Yamana Y, Minei M. Photoradiation therapy using argon laser and a hematoporphyrin derivative for retinoblastoma: a preliminary report. Jpn J Ophthalmol 1986; 30: 409-419.
115. Murphree A. Retionblastoma. In: Ryan S, Ogden T, eds. Retina, vol 1. St Louis: CV Mosby, 1989:544.
116. White L, Gomer C, Doiron D, et al. Ineffective photodynamic therapy (PDT) in a poorly vascularized xenograft model. Br J Cancer 1988; 57: 455-458.
117. Winther J, Porphyrin photodynamic therapy in an experimental retinoblastoma model. Ophthal Paedatr Gen 1987; 8: 49-52.
118. Winther J, Ehlers N. Histopathological changes in an intraocular-like tumour following photodynamic therapy. Acta Ophthalmol 1988; 66: 69-78.
119. Winther J, Overgaard J, Photodynamic therapy of experimental intraocular retinoblastoma: dose-response relationships to light energy and photofrin II. Acta Ophthalmol 1989; 67: 44-50.
120. Epstein R, Hendricks R, Harris D. Photodynamic therapy of corneal neovascularization. Cornea 1991; 10: 424-432.
121. Pallikaris I, Miltiades M, Iliaki O, eta al. Effectiveness of corneal neovascularization photothrombosis using phthalocyanine and a diode laser (675 nm). Lasers Surg Med 1993; 13: 197-203.
122. Tsilimbaris M, Pallikaris I, Naoumidi I, et al. Phthalocyanine mediated photodynamic thrombosis of expimental corneal neovascularization: effect of phthalocyanine dose and irradiation onset time on vascular occlusion rate. Lasers Surg Med 1994; 15: 19-31.
123. Gohto Y, Obana A, Kanai M, et al. Photodynamic therapy for corneal Neovascularization using topically administered ATX-S10 (Na). Ophthal Surg Lasers 2000; 31: 55-60.
124. Gohto Y, Obana A, Kanai M, et al. Treatment parameters for selective occlusion of experimental corneal neovascularization by photodynamic therapy using a water soluble photosensitizer, ATX-S10 (Na). Exp Eye Res 2001; 72: 13-22.
125. Schmidt-Errurth U, Hasan T, Schomacker K, et al. In vivo uptake of liposomal benzoporphyrin derivative and photothrombosis in experimental corneal neovascularization. Lasers Surg Med 1995; 17: 178-188.
126. Virdi PS, Hayreh SS. Ocular neovascularization with retinal vascular occlusion. I. Association with experimental retinal vein occlusion. Arch Ophthalmol 1982; 100: 331-341.
127. Miller JW, Adamis AP, Shima D, et al. Vascular endothelial growth factor/vascular permeability factor is temporally and spatially correlated with ocular angiogenesis in a primate model. Am J Pathol 1994; 145: 574-584.
128. Packer AJ, Tse DT, Gu X-Q, et al. Hematoporphyrin photoradiation therapy for iris neovascularization. A preliminary report. Arch Ophthalmol 1984; 102: 1193-1197.
129. Husain D, Miller J, Kenney A, et al. Photodynamic therapy and digital angiography of experimental iris neovascularization using liposomal benzoporphyrin derivative. Ophthalmology 1997; 104: 1242-1250.
130. Muller V, Ruokonen P, Schellenbeck M, et al. Treatment of rubeosis iridis with photodynamic therapy with verteporfin: a new therapeutic and prophylactic option for patients with the risk of neovascular glaucoma? Ophthal Res 2003; 35: 60-64.
131. Thomas EL, Langhofer M. Closure of experimental subretinal neovascular vessels with dihematoporphyrin either augmented argon green laser photocoagulation. Photobiol 1987; 46:881-886.
132. Тахчиди Х.П., Белый Ю.А., Терещенко А.В. и др. Экспериментальные результаты фотодинамической терапии в офтальмологии с использованием отечественных препаратов хлоринового ряда. Офтальмохирургия 2005; № 2: 30 -35.
133. Белый Ю.А., Семенов А.Д., Володин П.Л. и др. Фотодинамическая терапия (ФДТ) экспериментально-индуцированной хориоидальной неоваскуляризации с использованием отечественного препарата «Фотодитазин». VIII Съезд офтальмологов России. Тезисы докладов. Москва; 1 – 4 июля 2005г.: 376.
134. Володин П.Л. Экспериментальное изучение порогов фотодинамического повреждения сетчатки и хориоидеи с использованием отечественного фотосенсибилизатора «Фотодитазин». VIII Съезд офтальмологов России. Тезисы докладов. Москва; 1 – 4 июля 2005г.: 382.
135. Воронцов Г.Н., Кузьмин С.Г., Ермакова Н.А. и др. Использование Фотосенса и лазерно-спектроскопического комплекса для диагностики и фотодинамической терапии субретинальных мембран. VIII Съезд офтальмологов России. Тезисы докладов. Москва; 1 – 4 июля 2005г.: 384.
136. Moulton RS, et al. Response of retinal and choroidal vessels to photodynamic therapy using benzoporphyrin derivative monoacide. Invest Ophthalmol Vis Sci 1993;34:1169A.
137. Husain D, Kramer M, Kenny AG, et al. Effects of photodynamic therapy using verteporfin on experimental choroidal neovascularization and normal retina and choroids up to seven weeks after treatment. Invest Ophthalmol Vis Sci 1999;40:2322-2331.
138. Schmidt-Егfuth U, Miller JW, Sickenberg М, et al. Photodynamic thеrаpy with vеrtерогfin for choroidal neovascularization caused bу age-related macular degeneration: results of retreatments in а phase 1 and 2 studу. Arch Ophthalmol 1999;117: 1177-1187.
139. Treatment of Age-Related Macular Degeneration with Photodynamic Therapy (ТАР) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin. Two-year results of 2 randomized clinical trials – TAP Report No. 2. Arch Ophthalmol. (in press), 2000.
140. Тreatment of Age-related Macular Degeneration with Photodynamic Therapy (ТАР) Study Group. Verteporfin (Visudyne) therapy of subfoveal choroidal neovascularization in patients with age-related macular degeneration: Additional information regarding baseline lesion composition's impact оп vision outcomes-TAP Report No. 3. Аrch Ophthalmol 2002;120:1443-1454.
141. Vеrtерогfin in Рhоtodynamic Therapy Studу Group. Verteporfin therapy of subfoveal choroidal neovascularization in age-related macular degeneration: two year results of а randomized clinical trial including lesions with occult ,with nо classic choroidal nеоvascularization. Аm J OphthalmoI 2001; 131 :541-560.
142. Verteporfin in Photodynamic Therapy (VIP) Study Group. Photodynamic therapy of subfoveal choroidal neovascularization in pathologic myopia with verteporfin: one-year results of а randomized clinical trial. Ophthalmology 2001 ;108:841-852.
Дата добавления: 2019-01-14; просмотров: 737; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
