ТЕХНОЛОГИИ ИСПОЛЬЗОВАНИЯ ШАХТНЫХ ВОД 8 страница
8.2 Использования шахтных вод для охлаждения
Общие требования к охлаждающей воды следующие: Температура воды не должна превышать допустимую температуру, что в оборотных системах составляет 30-40 °С. Вода не должна вызывать отложений шлама в теплообменник аппаратах и трубопроводах, она должна быть термостабильною, т. е. при многократном нагреве и охлаждении не вызывать отложений солей в теплообменных аппаратах и трубопроводах. Выделение карбоната кальция и других солей не должна превышать 0,25 г/м2. Вода не должна способствовать развитию биологических обрастаний аппаратов и охладителей. Допустимое биологическое обрастание не должно превышать 0,07 г/м2 (на сухую массу). Вода не должна вызывать коррозию металла более чем 0,09 г/м2.
Требования к свежей технической воды, предназначенной для восполнения безвозвратных потерь в оборотных системах, характеризуются следующими показателями:
Температура, °С... ........................20-25
Взвешенные частицы крупностью до 50 мкм, мг/л... ..................20-25
Эфирорастворимые вещества
(масло - и смолообразные продукты), мг/л. .....................10-20
Запах, баллы ............................3
Показатель рН ...........................7,2—8,5...
Жесткость, мг-экв/л:
общая ............................к 7
карбонатная ........................2,0-2,5
Щелочность общая .....................1,5-3,0
Общее солесодержание, мг/л... .....................500
Хлориды, мг/л... .....................100
Сульфаты, мг/л... .....................150
Железо, мг/л... .....................1
|
|
|
Окисляемость по КМпО4, мгО2/л... ..................до 10-15
БПКполн, мгО2/л... .....................15-20
Азот, мг/л. . .....................до 1,5
8.3 Использование шахтных вод для котельных
Водный режим котельной должен обеспечивать работу котла и тракта питательной водой без повреждения их конструкций вследствие отложений накипи, шлама или коррозии, без повышения относительной щелочности до опасных пределов при условии обеспечения получения пара соответствующего качества. Для пополнения оборотных систем котлоагрегатов вода должна отвечать следующим требованиям:
Температура, °С 5-25... ...
Взвешенные частицы, мг/л... ...20
Эфирорастворимые вещества, мг/л... ...3-5
Запах, баллы ......3
Растворенный кислород, мг/л... ...0,03—0,1
Показатель, рН ......больше 8,5
Жесткость общая, мг-экв/л... ...0,02—0,5
Железо, мг/л... ....0,2
9 Обзор методов очистки шахтных вод
Как классификационные признаки методов чаще всего используют: физико-химическую основу методов очистки воды; характер сил, воздействующих на примеси; характер примесей, подлежащих удалению; изменение состояния примесей в процессе очистки воды.
Широко известные классификации Кульского Л.А. и Лапшина Н.И. По Кульському классификационным признаком является характер примесей, подлежащих удалению (их фазово-дисперсный состояние: грубодисперсные, коллоидно-дисперсные и истинно растворенные примеси).
|
|
|
Классификация методов очистки воды М.И.Лапшина конкретизирует классификацию Л.А.Кульского и рассматривает метод очистки относительно определенного технологического процесса. Все методы в этой классификации разбиты на три группы: методы, основанные на выделении примесей без изменения их химического состава; на преобразовании примесей с изменением их химического состава; биохимические методы.
Первая группа методов получила наибольшее распространение в практике очистки шахтных вод. Она делится на две подгруппы:
1) непосредственное выделение примесей из воды;
2) разделение примесей и жидкости после изменения фазового состояния воды или примеси.
Непосредственное выделение примесей из воды включает методы механической очистки (с применением процеживание, отстаивание и фильтрование) и физико-химической очистки (флотация, электрофорез и мембранные методы).
Методы разделения примесей и жидкости после изменения фазового состояния классифицируют, исходя из характера поверхностей раздела фаз (все они являются физико-химическими), коагуляция, сорбция, кристаллизация (примесь - твердая фаза; вода - жидкая фаза); испарение (примесь - жидкая или твердая фаза); коалесценция, экстракция (примесь и вода - две жидкие фазы, не смешиваются); вымораживание (примесь - жидкая фаза; вода - твердая фаза); дегазация, отвод, эвапорация (примесь - газовая фаза; вода - жидкая фаза).
|
|
|
Вторая группа методов, а именно методы превращения примесей с изменением их химического состава подразделяются на следующие подгруппы: образование труднорастворимых электролитов, образование малодиссоциированных соединений, образования комплексных соединений, процессы синтеза и разложения, окислительно-восстановительные процессы, в частности электрохимические, термолиз.
Таким образом, следует различать методы механической, химической, физико-химической и биологической очистки производственных сточных вод.
Процессы очистки воды можно интенсифицировать применением электростатических и магнитных полей.
Во всех случаях очистки сточных вод первой стадией является механическая очистка, предназначенная для удаления грубодисперсных и коллоидно-дисперсных частиц. Дальнейшая очистка от истинно-растворенных химических веществ осуществляется различными методами: химическими (реагентное осаждение), ф (флотация, абсорбция, ионный обмен, дистилляция, обратный осмос, ультрафильтрация и др.), электрохимическими и биологическими. В отдельных случаях для уничтожения вредных веществ применяют термические методы. Во многих случаях, приходится применять комбинацию указанных методов.
|
|
|
Таким образом, в зависимости от характера примесей, содержащихся в сточных водах, применяют те или иные методы их очистки. Наиболее употребительными из них являются следующие:
1) для извлечения взвешенных примесей - отстаивание, флотация, фильтрование, центрифугирования (для грубодисперсных частиц); коагуляция, флокуляция, электрические методы осаждения (для мелкодисперсных и коллоидных частиц);
2) для очистки от минеральных (неорганических) истинно-растворенных - дистилляция, ионный обмен, обратный осмос, ультрафильтрация, реагентное осаждение, методы охлаждения, электрические методы;
3) для очистки от органических соединений - экстракция, абсорбция, флотация, ионный обмен, реагентные методы (регенерационные методы); биологическое окисление, жидкофазное окисление, парофазне окисление, озонирование, хлорирование, электрохимическое окисление (деструктивные методы);
4) для очистки от газов и паров - отдувка, нагрев, реагентные методы;
5) для уничтожения вредных веществ - термическое разложение.
В перспективе основной удельный вес очистки стоков будет приходиться на механический и физико-химический методы очистки (70% всех стоков, которые очищаются), а по капиталовложениям основное внимание будет уделяться физико-химическом (54%) и химическом (20%) методам.
ЛЕКЦИЯ 14
ОБРАБОТКА ШАХТНЫХ ВОД РЕАГЕНТАМИ
Современные методы освещения воды, учитывая наличие в их составе значительных концентраций тонкодисперсных взвешенных веществ, предусматривают агрегацию таких примесей с помощью коагулянтов и флокулянтов.
1 Коагуляция примесей воды
1.1 Цели и методы коагуляции шахтных вод
В процессе механической очистки шахтных вод достаточно эффективно удаляются частицы размером более 10 мкм; тонкодисперсные и коллоидные частицы практически не удаляются. Это объясняется их седиментационною устойчивостью. Имея незначительные размеры и вес, они участвуют в броуновском движении, а следовательно, способны диффундировать (не опускаться, например, а вверх). Способность к седиментации в таких частиц возникает лишь при их агрегации (укрупнении). В природных условиях этому препятствует агрегативная устойчивость коллоидно - и тонкодисперсных частиц, то есть способность сохранять свою дисперсность. Как известно агрегативная устойчивость обусловлена расклинивающим давлением между частицами вследствие наличия оболочек (вокруг гидрофильных частиц, обычно органического происхождения) гидратов или двойного электрического слоя (вокруг гидрофобных частиц, обычно минерального происхождения). Для шахтных вод характерна подавляющее присутствие минеральных примесей, которые в диапазоне рН 6,5...7,5 имеют на грануле отрицательный заряд.
Ликвидация или уменьшение электрического заряда частиц, разрушение их диффузной и гидратной оболочек к нарушению агрегативной устойчивости и коагуляции примесей. Это достигается введением в воду электролитов (электролитная коагуляция) или золей (коллоидов) с
противоположным зарядом частиц (нейтрализационная коагуляция).
При обработке шахтных вод применяют, как правило, электролитную коагуляцию. В результате добавления в воду коагулянтов происходит постепенное снижение электрокинетического потенциала, вплоть до нуля, но дальнейшее увеличение концентрации электролита в воде может перезарядку коллоидов с изменением заряда на противоположный. В этих условиях электрокинетический потенциал начинает расти и агрегативная устойчивость частиц увеличивается.
Коагуляция природных гидрофобных коллоидов, имеющих обычно -потенциал в пределах 0,05...0,1 В, становится возможной при его снижении до 0,03 В и меньше.
Как коагулянты применяются широко сульфат и хлорид алюминия вместе с известью, а также соли железа. Коагуляция различными реагентами применяется почти во всех производственных сточных вод, включая шахтные.
1.2 Химизм процесса коагуляции
При введении коагулянта (соли многовалентных металлов) в воду он диссоцинирует на ионы металла и анионы сильных кислот. Катионы металла с гидрокарбонат - и карбонат-ионами образуют малорастворимые гидроксиды:
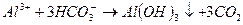
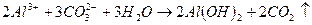
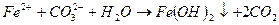

во-вторых, гидролиз избытка коагулянта, что заканчивается образованием коллоида металла (железа, алюминия и др.) 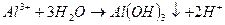
Ионы водорода, которые накапливаются, задерживают дальнейший ход реакции. Одновременно их концентрация снижает рН обрабатываемой среды, а, следовательно, увеличивает различие этого показателя с рН изоэлектрического состояния вещества примеси (рНіз), то есть агрегативную устойчивость примесей. Необходимо связывать в зоне реакции ионы водорода, образующиеся при гидролизе. Последнее достигается, во-первых, естественным образом при взаимодействии ионов водорода с анионами щелочности воды:
 ,
,
 ,
,
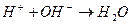 ;
;
во-вторых (при дефиците щелочного резерва в обрабатываемой воде), путем добавление к воде извести или соды (подщелачивания, лучше известью), в-третьих, удалением путем барботирования из зоны коагуляции (продувка воздухом) углекислого газа.
Интенсивность процессов осветления сточной воды может быть достигнута применением новых коагулянтов типа оксихлорида алюминия [Al2(OH)5]Cl6H2O и алюмината натрия NaAlO2, при коагуляции которых рН воды практически не изменяется, что имеет важное технологическое значение.
Различают два механизма коагуляции: объемная, такая, что происходит в камерах образование хлопьев, и контактная коагуляция, которая может протекать в толще зернистой загрузки фильтра или в массе взвешенного осадка.
1.3 Коагуляция примесей воды в свободном объеме
Применяется в основном при отстаивании шахтных вод.
Действие коагулянта сводится к следующих основных процессов: собственно коагуляции, флокуляции, сорбции и соосаждения.
Коагуляция протекает в две стадии. Первая перикинетическая протекает под влиянием броуновского движения, вследствие чего частицы сталкиваются и укрупняются. В результате введения коагулянта формируются хлопья (в виде цепочек) из одного реагента (гидроксиды металлов). На поверхности хлопьев коагулянта, сформировались, адсорбируются примеси воды, которые соосождаются с хлопьями оседают. В свою очередь цепочки коагулянта могут прилипать к поверхности грубодисперсных примесей и образовывать еще более крупные хлопья (флоккулы), которые тонкодисперсные примеси, благодаря чему достигается осветление и обесцвечивание воды. Кроме того, на поверхности хлопьев, могут адсорбироваться растворенные органические вещества, привкусы и запахи воды. Структура хлопьев представлена на рис. 5.1.

Рис. 5.1. Структура хлопьев, образующихся при коагуляции воды
Завершается перикинетическая стадия, которая длится меньше минуты, образованием микрохлопьев, на которые уже не действуют силы теплового движения. Для дальнейшего сталкивания частиц и образование крупных агрегатов требуется внешнее перемешивание воды – ортокинетическая стадия коагуляции. Она длится от 5 до 30 минут, в результате образуются макрохлопья величиной от 1 мм.
Первая стадия коагуляции протекает в смесителях, вторая – в камерах образования хлопьев, осаждения хлопьев в отстойниках.
1.4 Контактная коагуляция
Это технологический процесс осветления и обесцвечивания воды, который протекает в зернистой загрузке скорых фильтров. В основе этого процесса лежит адсорбция примесей на поверхности зерен загрузки под действием Ван-дер-ваальсовых сил межмолекулярного притяжения. Контактная коагуляция тонкодисперсных примесей в зернистом слое загрузки протекает при фильтровании воды всегда (при этом вокруг каждого зерна скапливается гель с характерной сетчатой структурой). Однако при обычном фильтровании контактная коагуляция протекает крайне. Она значительно ускоряется при добавлении электролита-коагулянта. При этом особенно успешно контактная коагуляция протекает при смешении реагента с обрабатываемой водой непосредственно перед ее поступлением в зернистое загрузки.
Действие коагулянтов при этом объясняется тем, что образующиеся в результате диссоциации соликоагулянта ионы двух-, трехвалентных металлов обмениваются с одновалентными катионами диффузного слоя, адсорбированными на поверхности гидрофобных примесей воды, и сжимают двойной электрический слой, уменьшая тем самым - потенциал последнего, а, следовательно, агрегативную устойчивость частиц.
Контактная коагуляция имеет ряд характерных особенностей, отличающих ее от коагуляции в свободном объеме воды. Так, при добавлении коагулянта контактная коагуляция протекает полно и быстро при таких дозах, которые оказываются недостаточными для коагуляции в свободном объеме воды (в камерах образования хлопьев). Снижении дозы коагулянта достигает 15-20%. Температура воды не оказывает заметного влияния на контактную коагуляцию. Контактная коагуляция хорошо протекает (в отличие от обычной коагуляции) и при малых концентрациях реагента. При ее использовании нет необходимости в підлуговуванні воды. На интенсивность контактной коагуляции влияет изменение рН воды.
Метод очистки воды, основанный на использовании явления контактной коагуляции, называют методом контактного осветления.
1.5 Основные типы коагулянтов
Самым распространенным является сернокислый алюминий Al2(SO4)3.
Получают путем обработки адюминиевых глин (боксита, каолина) серной кислотой, выпускается двух сортов: очищенный и неочищенный.
Очищенный сернокислый глинозем Al2(SO4)3 18Н2О содержит 90% активного продукта, почти белый с желтоватым оттенком, выпускается в виде комков, достаточно мягких, впитывающих влагу. Поэтому этот реагент нельзя хранить большими слоями, чтобы избежать слеживания.
Неочищенный сернокислый глинозем Al2(SO4)3 пН2О mSiO2 - комья светло-зеленого цвета с содержанием активного продукта 33-40 % (остальное - вода и примеси).
FeSO4 - железный купорос. Получают при обработке отходов черных металлов серной кислотой. Имеет вид кристаллов зеленоватого цвета, что буреют на воздухе. Для образования коллоидного гидроксида железа Fe(OH)3, требуется окисление закисного железа в окислительное под воздействием кислорода, растворенного в воде
Fe2+ + Н2О + O2 = Fe(OH)3
Эта реакция быстро идет только при pH > 8, поэтому нужно добавлять щелочи. Можно также окислять двухвалентное железо хлором.
Из-за осложнения реагентного хозяйства и увеличение расходов реагентов FeSO4 на городских водопроводах применяют редко, но находит широкое применение на станциях реагентного умягчения воды, где все равно вводят известковое молоко.
FeCl3 - темные кристаллы с металлическим блеском. Получают обработкой стальных стружек соляной кислотой. Этот коагулянт гигроскопичен (поэтому требует герметичной тары), очень коррозийный, поэтому неудобен в эксплуатации. Его преимуществом является то, что он хорошо коагулирует при низких температурах воды.
Смешанный коагулянт: смешивают железный коагулянт FeCl3 с Al2(SO4)3 в соотношении 1:3 для совмещения достоинств обоих реагентов.
В последнее время применяют новый коагулянт полихлорид алюминия (Al2(OH)nCl6-n)m. Он мало снижает рН воды, хорошо действует при низких температурах. Современные коагулянты выпускаются в удобной гранулированной форме, затариваются в мешки.
1.6 Определение дозы коагулянта
Доза коагулянта для вод различного состава неодинакова и должна устанавливаться методом пробной коагуляции исходной воды в производственной лаборатории.
Методика лабораторных исследований состоит в следующем. В 5-6 стеклянных цилиндров емкостью 1 л каждый наливают исследуемую воду. В каждый цилиндр вводят определенную дозу коагулянта. Доза реагента зависит от концентрации взвешенных веществ, химического состава воды и других факторов. Принимают дозу коагулянтов в пределах 20...200 мг/л.
После введения реагента содержимое цилиндров перемешивают десятикратным опрокидыванием закрытых пробками цилиндров. После 60-минутного отстаивания воды из каждого цилиндра сифоном с глубины, превышающей на 5 см верхнюю границу осадка, отбирают пробу воды, в которой определяют концентрацию взвешенных веществ. По результатам исследований строят кривую, по которой определяют оптимальную дозу реагента.
При контактной коагуляции содержимое цилиндров после перемешивания с коагулянтом фильтруют через бумажные фильтры, и определяется мутность каждой пробы, после чего строится коагуляционная кривая и по точке ее перелома определяется оптимальная доза коагулянта. Подробнее методика описана в лабораторном практикуме по курсу.
Если проба воды отсутствует, дозу коагулянта определяют по значению мутности по табл. 16 СНИП 2.04.02 – 84.
1.7 Электрокоагуляция
Прогрессивным направлением в технологии очистки природных и сточных вод от взвешенных веществ, а также ионов тяжелых металлов, нефтепродуктов и органических веществ, устойчивых к биологическому разложению (типа СПАЛ), является применение метода очистки воды в электролизерах с растворимыми электродами (анодами), известного под названием “электрокоагуляция”. С помощью этого метода в воду вводят вместо коагулянтов ионы металлов (как правило, алюминия или железа), полученные электрохимическим путем. Процесс протекает обычно под действием постоянного тока (применение переменного тока также имеет место).
Дата добавления: 2018-11-24; просмотров: 296; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
