ТЕХНОЛОГИИ ИСПОЛЬЗОВАНИЯ ШАХТНЫХ ВОД 4 страница

Рис. 3.5. Двойной электрический слой
Структурный комплекс, включающий в себя нерастворимую коллоидную частицу и ПЕШ, называется мицеллою.
Внутреннюю часть мицеллы составляет агрегат основного вещества, что состоит из m молекул, например {[SiO2]m}. На его поверхности расположено n потенциальноопределяющих ионов, например, гидроксид-ионов {nOH- }. Агрегат с потенциальноопределяющими ионами образует ядро мицеллы {[SiO2]m (OH-)n•}. Ядро с противоионами плотной части ПЕШ составляет гранулу {[SiO2]m* nOH-•(n-x) H+}-, где х - число противоионов, образующих внешний, т. е. диффузный слой ионов; (n-x) - число "связанных" противоионов, входящих в неподвижный адсорбционный слой ПЕШ. Наконец, заряженная гранула, окруженная "свободными" противоионами диффузного слоя, составляет мицеллу. {[ЅіО2]m •nOH- (•n-x) H+}- •x •H+.
В состоянии покоя мицелла всегда электронейтральная. При относительном перемещении фаз в процессе броуновского движения противоионы диффузной части мицеллы отстают, отрываются от гранулы, чего частица приобретает электрического заряда. Отрыв происходит по плоскости скольжения слоев жидкости, расположенной на некотором расстоянии от межфазной поверхности, то есть внутри диффузного слоя. Разность потенциалов, образующаяся, по этой плоскости называется электрокинетическим потенциалом, или дзета-потенциалом . Природные гидрофобные коллоиды имеют обычно отрицательный -потенциал в пределах 0,05...0,1 В.
|
|
|
Таким образом, движущиеся частицы не являются электронейтральними: они обладают одноименными зарядами и при взаимодействии отталкиваются друг от друга.
Наиболее типичная появление электрических свойств гидрофобных частиц в коллоидно-дисперсных системах. В гидрофильных системах значение ПЕШ сказывается в меньшей степени. Для таких систем характерна адсорбция молекул растворителя (жидкой фазы), которые образуют вокруг частицы сольватные оболочки.
Следствием электрических свойств коллоидно-дисперсных систем, а также наличии сольватных оболочек является агрегативная устойчивость коллоидных частиц, то есть их неучастие в процессе агрегации.
Обеспечение возможности агрегации коллоидно-дисперсных примесей является актуальным практическим вопросом, который возникает при очистке шахтных вод от тонкодисперсных примесей.
3.2 Молекулярные примеси
Молекулярные примеси (раздроблены до размеров отдельных молекул размерами 10-8...10-9м) находятся в истинных растворах (растворы неэлектролита в воде), которые являются однофазными гомогенными системами.
Основными источниками молекулярных примесей в шахтных водах являются продукты жизнедеятельности человека, поэтому они представлены белками, углеводами и т.п. Кроме того, в шахтных водах Донбасса встречаются такие специфические молекулярные примеси, как толуол, мета-и параксилол, бутилацетат, хлорбензол, ацетон, бензол, этилацетат, фенол, а также нефтепродукты. Наличие таких загрязнений в подземных водах объясняется частичными локальными утечками горюче-смазочных материалов от предприятий, расположенных в пределах горного отвода шахт, и их инфильтрация вместе с водой в подземных горизонтов.
|
|
|
Источниками нефтепродуктов в горных водах есть также гидравлические системы механизированных комплексов, системы машин и механизмов. При эксплуатации последних происходит попадание массы и эмульсий на почву горных выработок, а дальше - в шахтную воду. Содержание нефтепродуктов в шахтных водах изменяется от 0 до 50 мг/л. Однако среднее содержание последних составляет обычно 0,5-2,0 мг/л.
И источником загрязнения шахтных вод нефтепродуктами является миграция их из нефтесодержащих пород в горные выработки. Такие явления наблюдаются на нескольких шахтах Донбасса.
3.3 Показатели коллоидно-дисперсных и молекулярных примесей
Представителями коллоидно-дисперсных примесей в шахтных водах являются продукты жизнедеятельности живых организмов, разложения древесины и др. Их наличие в воде свидетельствуют такие показатели, как цветность, запахи и привкусы, окисляемость.
|
|
|
Цветность воды, ее окраска объясняется наличием гуминовых соединений, танина, окрашенных отходов производства. Цветность устанавливают визуально. Мера цветности выражается в условных градусах, определяемых путем сравнения со стандартными растворами платиново-кобальтовой шкалы, и характеризуется как бурая, серая, коричневая и др.
В большинстве шахтных вод величина цветности находится в пределах 20 - 60 град.
Запах и вкус обусловливается присутствием примесей минерального и биологического происхождения. Запах и вкус воды биологического происхождения (травяной, болотный, земляной, рыбный и др.) является следствием жизнедеятельности и отмирания лучистых грибков, плесени, некоторых форм бактерий. Из минеральных примесей, воде запах и вкус, следует выделить сероводород, соединения железа и марганца, сульфаты, хлориды.
Из промышленных загрязнений, которые могут попасть в горных вод, запах и привкус, ароматические и алифатические углеводороды, спирты, фенолы, кантоны, альдегиды и др. Наименьшими пороговыми концентрациями (по запаху) обладают фенолы, некоторые хлорированные углеводороды, пестициды.
|
|
|
Окисляемость, мгО2/л. Данный показатель косвенно характеризует содержание в воде органических веществ, а также (в незначительной степени) невысоких концентраций неорганических (типа железа, сероводорода, нитритов).
Его величина является расходом кислорода (или другого сильного окислителя условном пересчете на кислород) на окисление органических и некоторых неорганических веществ в определенных условиях.
В качестве окислителей используются чаще всего перманганат калия KMnO4 (перманганатная окисляемость) или бихромат калия (бихроматная окисляемость).
Показателями окисляемости также являются:
БПК - биохимическая потребность в кислороде, мгО2/л;
ХПК - химическая потребность в кислороде, мгО2/л.
Они на загрязненность сточных вод органическими веществами и характеризующих их способность к биохимического или химического окисления.
Под БПК понимается количество растворенного кислорода, необходимое для биохимического окисления органических веществ в аэробных условиях. Она определяется лабораторным путем в пробах специально обработанной воды (которые выдерживают в термостате при температуре 20оС в течение 1,2,5,8,10 и 20 суток и более) по разнице содержания кислорода в начале и конце выдержки каждой пробы. По количеству времени выдержки проб БПК индексируют БПК5, БПК20.
ХПК выражает количество кислорода, необходимое для полного химического окисления всех органических веществ в воде. Значение ХПК обычно всегда больше БПК, потому что химическое окисление ведет до полного распада органических веществ в сравнении с биологическим.
4 Ионные примеси шахтных вод
4.1 Виды ионных примесей
Ионные примеси относятся к истинно-растворенных и имеют наименьшие размеры. Фактически это растворенные в воде соли, кислоты и щелочи. Ионные частицы имеют заряд, положительно заряженные частицы называются катионами, отрицательно заряженные – анионами. Физико-химические системы с ионными примесями гомофазные (примеси – гомогенные) и являются электролитами.
В природных водах (к которым можно отнести шахтные воды, попутно извлекаемые) наиболее распространены три группы ионных примесей, которые представлены в табл.3.1.
Особенно распространены ионы 1-ой группы. Они образуют различные соединения, часть из которых растворима, а другая нерастворимая. Например, катионы Na+ и K+ относятся к устойчивых примесей, поскольку они не образуют с анионами труднорастворимых солей и практически не подвергаются гидролизу. Их концентрации часто можно изменить только испарением или разбавлением воды. При химических анализах концентрацию Na+ и K+ часто выражают суммарно.
Таблица 3.1 - Ионные примеси воды
| Группа | Катион | Анион | Концентрация, миллиграм/л |
| І | Na+, K+, Ca+2, Mg+2 | HCO3-, Cl-, SO42- | От нескольких единиц до десятков тысяч |
| II | NH4+, Fe+2, Mn+2 | HSiO3-, F-, NO3-, CO3- | От десятых долей до единиц |
| III | Cu+2, Zn+2, Ni+2,, Al+3 | Менее десятых долей |
Катионы Ca2+ и Mg2+ являются важнейшими, поскольку они во многом определяют значение жесткости воды. Они относятся к неустойчивых примесей, поскольку образуют с некоторыми анионами (типа CO32-, SO42 - и др..) труднорастворимые соединения. Такие образования возникают при упаривании (присутствие CO32-) или снижении растворимости с ростом температуры (присутствие SO42-). Они выделяются в виде твердой фазы на теплообменных поверхностях. Следует учитывать, что соединения кальция и магния, как правило, имеют отрицательные коэффициенты растворимости: CaSO4,CaSO3, MgCO3, CaSiO3, MgSO4. Хотя при нормальной температуре некоторые из них растворимые: CaSO4, MgSO4.
Катионы железа, относящиеся к II группе, поливалентные (Fe2+ и Fe3+). В подземных водах железо обычно находится в виде Fe2+, образуя гидрокарбонат Fe(HCO3)2. При удалении из воды CO2 железо легкое гидролизуются образуя Fe(OH)2, а при наличии в воде кислорода гидроксид Fe(OH)2 окисляется с образованием красно-коричневой твердой фазы гидроксида железа Fe(OH)3 (III). Из-за наличия железа на стенках трубопроводов образуются бугристые колонии железобактерий. Содержание железа в воде достигает 3-5мг/л.
Марганец содержится в воде в виде гидратированных ионов или комплексов с органическими соединениями в истинно растворенном и коллоидном состояниях.
Ионы тяжелых металлов (Cu2+, Ni2+ и др.) мало распространены в горных водах. Однако в связи с возможностью попадания под землю промышленных сточных вод их содержание в шахтной воде может увеличиться. Опасными загрязнителями являются ртуть, свинец, медь, кадмий и др.
В шахтных водах широко распространены анионы Сl- (хлорид-ион) и SO42- (сульфат-ион). Они устойчивы, то есть труднорастворимых солей, как правило, не образуют (за исключением соли CaSO4, которая образуется при температуре более чем 850оС). В природных условиях температура воды обычно невысокая, а потому твердая фаза CaSO4 не выделяется.
распространены в подземных водах также соли кремниевых кислот (силикатов). Ангидрид кремниевой кислоты SiO2 образует с водой различные кислоты (мета -, орто -, поликремниевые), которые при обычных значениях pH малорастворимые, способные образовывать коллоидные растворы. Многообразие форм кремниевых кислот и их малая растворимость в воде сильно затрудняют их дифференциацию при химическом анализе воды. Поэтому определяют суммарную концентрацию кремниевых, условно выраженную в виде SiO2.
За содержанием ионных примесей воды классифицируют по двум признакам: а) солесодержания; б) преобладающему в воде аниона.
По солесодержанию воды делят на:
а) пресные (до 1 г/л)
б) солоноватые (1-10 г/л)
в) соленые (более 10 г/л).
Степень минерализации изменяется значительно даже в пределах одной шахты. В Донбассе встречаются шахтные воды от солоноватых (минерализация 1-3 г/л), соленых (10-25 г/л) и даже сильносоленых (25-50 г/л). Основная масса шахтных вод Центрального Донбасса относится к солоноватым, особенно сильно минерализованные шахтные воды в Западном Донбассе. Их минерализация составляет более 30 г/л, а по прогнозам геологов на шахтах Новомосковского района может превысить 100 г/л. С глубиной шахт степень минерализации вод, при этом содержание хлоридов и натрия увеличивается, а гидрокарбонатов, сульфатов, кальция и магния падает.
По преобладающему в воде аниона классификация предложенная А.А.Алекиным. Она получила большое распространение. В соответствие с этой классификацией различают классы, группы, типы вод.
Выделяют следующие три класса вод: гидрокарбонатный класс с преобладающим анионом HCO3- (или суммой анионов HCO3 - и CO32-); сульфатные воды (SO42-); хлоридные воды (Cl-). По преобладающему катиона каждый из перечисленных классов вод делят на группы. Всего выделяют три группы: кальциевая вода (Ca); магниевая вода (Mg); натриевая вода (Na). Каждая группа в свою очередь делится на типы, учитывающие соотношение между главными ионами (всего четыре типа):
I. 
П. 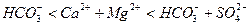
Ш. 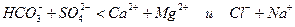
IV. 
Всего по классификации А.А.Алекина различают 27 видов вод.
4.2.Химические показатели качества воды
Ионный состав примесей воды характеризуют показатели рН, общая минерализация, сухой остаток, щелочность, жесткость и др.
Водородный показатель (рН). Для упрощения обозначения реакции среды вместо истинной концентрации ионов водорода логарифм ее величины, взятый с обратным знаком. Эту величину называют водородным показателем (pH)
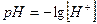 (3.6)
(3.6)
Таким образом, водородный показатель pH характеризует реакцию воды (кислая, щелочная, нейтральная) и учитывается при всех видах обработки воды.
В зависимости от величины показателя pH реакцию среды классифицируют следующим образом: pH=1-3 (кислая); pH=4-6 (слабокислая); рн=7 (нейтральная); pH=8-10 (слабощелочная); pH=11-14 (щелочная). В природных и шахтных водах обычно pH=6-8. Основной объем шахтных вод Донбасса относится к классу нейтральных. Д кислых вод составляет 7-9% общего объема шахтных вод, а щелочных - 10%.
От значения pH зависит интенсивность диссоциации слабых кислот, содержащихся в водных растворах. С понижением pH, то есть с повышением активности (или концентрации) ионов Н+, содержание недиссоциованных молекул кислот повышается, а содержание их анионов снижается, для катионов оснований наблюдается обратное соотношение.
Измерение рн основано на определении разности электрических потенциалов (метод потенциометра) двух помещенных в анализируемый раствор электродов - индикаторного и электрода сравнения.
Общая минерализация (мг/л) характеризует общее солесодержание в воде. Подсчитывается путем суммирования концентраций катионов и анионов, определенных при проведении полного химического анализа воды. Показатель трудоемкий и используется редко.
Средний уровень минерализации шахтных вод составляет 2700 мг/л.
Сухой остаток (мг/л) путем испарения определенного объема (1 л) предварительно профильтрованной пробы и последующего просушивания остатка при температуре 105-120оС и взвешивания. Сухой остаток примерно равен общей минерализации и определяется значительно проще нее.
Общей щелочностью воды (), мг-экв/л, называется сумма концентраций всех анионов кислот с (Сасл.к) и гидроксид-ионов (ОН -) за вычетом концентрации ионов водорода (Н+).
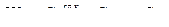 (3.7)
(3.7)
Различают щелочность гидрокарбонатная - Для (НСОз -), карбонатную Щк (СОз2-), силикатную, - Щс (НЅіОз. -, ЅіОз2-), фосфатную, - Щф (H2PO42-, PO43-) и гидратную - Щг (ОН-).
 (3.8)
(3.8)
В большинстве природных и горных вод концентрация гидрокарбонат-иона (НСОз -) преобладает над концентрациями других анионов кислот, поэтому общая щелочность обычно численно совпадает с концентрацией гидрокарбонатов, то есть=Для. Учет гидратной щелочности следует проводить только при рН>9.
Экспериментально щелочность определяют титрованием пробы воды кислотой в присутствии щелочно-кислотных индикаторов, свою окраску при различных значениях рН. Зная расхода кислоты, по справочных таблицах идентифицируют бикарбонатную, карбонатную, гидратную и другие виды щелочности.
Жесткость воды - один из важнейших показателей ее качества. Общей жесткостью (Жо) называют суммарную концентрацию ионов кальция и магния (мг-экв/л). 1 мг-экв/л жесткости соответствует 20,04 мг/л Са+2 или 12,16 мг/л Mg+2.
Согласно общей жесткости природные воды классифицируют на пять типов:
малая жесткость (Жо<1,5 мг-экв/л);
средняя (Жо=1,5-3,0 мг-экв/л);
повышенная (Жо=3,0-6,0 мг-экв/л);
высокая (Жо=6,0-12,0 мг-экв/л);
очень высокая (Жо>12,0 мг-экв/л)
Общую жесткость подразделяют на кальциевую и магниевую, а также карбонатную и некарбонатную.
Часть общей жесткости (Жо), эквивалентная содержания бикарбонатов (НСОз -) и карбонатов (СО32-), называется карбонатной жесткостью (Жк), разница между общей и карбонатной жесткостью называется некарбонатною жесткостью (Жн. к), то есть
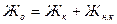 (3.9)
(3.9)
Негативными последствиями жесткости является ухудшение питьевых и моющих качеств воды, а также образования накипи (особенно при высоких температурах).
Общая жесткость шахтных вод определяется природой подземных вод водоносных горизонтов. Высокой жесткостью (более 7 мг-экв/л) характеризуются, как правило, солоноватые воды, а также часть пресных шахтных вод. Для шахт Донбасса характерные значения общей жесткости от 5 до 27 мг-экв/л.
4.3 График ионного состава воды
Определение ионного состава минерализованной воды производится химическими методами, изложенными в “Руководстве по анализу шахтных вод”. Концентрацию ионов-примесей выражают в единицах мг/л или мг-экв/л.
После окончания химического анализа проводят проверку правильности определения концентраций анионов и катионов. В общем случае для этого используют закон электронейтральности раствора. Его существование обусловлено тем, что вода всегда электрически нейтральна. Если концентрация ионов выражена в мг-экв/л, то уравнение закона имеет вид:
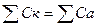 (3.10)
(3.10)
где Ск и Са - концентрация соответственно катионов и анионов.
Если правая и левая части приведенной равенства различаются менее чем на 1%, анализ можно считать выполненным правильно.
Ионный состав воды полезно представлять в виде графика (диаграммы) Роджерса, который получается из вышеприведенного уравнения и имеет следующий вид:
2,5 1,0 3,0
| Са2+ | Mg2+ | Na++K+ | ||
| CO2 | HCO3- | SO42- | Cl- | |
0,75 0,5 2,0 4,0
Таким образом, диаграмма состоит из двух полосок, длина отдельных участков которых в определенном масштабе соответствует значению концентраций ионов в эквивалентных единицах (сами значения приводятся над и под полосками). Верхняя полоска содержит катионы, нижняя – анионы. Последовательность ионов соответствует растворимости их солей, которая увеличивается в направлении слева направо.
Дата добавления: 2018-11-24; просмотров: 381; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
