ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Цель работы: экспериментально подтвердить влияние концентрации реагирующих веществ и температуры на скорость реакции; зависимости скорости гетерогенной реакции от величины поверхности раздела фаз; смещение химического равновесия при изменении концентрации реагирующих веществ, влияние температуры на состояние химического равновесия.
Реактивы и материалы: мрамор, хлорид калия, 1 н. и 1:200 раствор тиосульфата натрия, 2 н. и 1:200 раствор серной кислоты, 0,1 н. раствор соляной кислоты, 0,001 н. и насыщенный раствор хлорида железа(III), 0,001 н. и насыщенный раствор роданида калия, дистиллированная вода.
Оборудование: весы с разновесом, секундомер, газовая горелка, термометр на 100 оС, водяная баня, два сообщающихся сосуда, заполненные оксидом азота(IV), набор пробирок, пробирки на 50 мл с номерами, химические стаканы, мерные цилиндры, ступка с пестиком, шпатели.
Техника безопасности: соблюдать основные правила работы в химической лаборатории и технику безопасности при работе с открытым пламенем.
Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
Влияние концентрации реагирующих веществ на скорость химической реакции можно исследовать на примере реакции разложения тиосерной кислоты, которая образуется при сливании растворов тиосульфата натрия и серной кислоты:
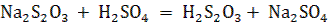
Скорость этой реакции, происходящей между ионами,
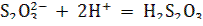
очень велика, и временем этой реакции можно пренебречь. Полученная кислота распадается:
|
|
|
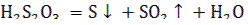
Этот процесс происходит во времени, скорость его зависит от концентрации реагирующих веществ.
К концентрированному раствору тиосульфата натрия прилейте равный объём концентрированного раствора серной кислоты. Появление коллоидных частиц серы можно заметить по голубоватой опалесценции раствора. Время, которое проходит с момента сливания растворов до заметного помутнения, характеризует скорость химической реакции.
В три большие пронумерованные пробирки налейте разбавленный (1:200) раствор тиосульфата натрия: в первую – 5 мл, во вторую – 10 мл, в третью 15 мл. В первую пробирку добавьте 10 мл воды, во вторую – 5 мл воды. В три другие большие пробирки налейте по 5 мл разбавленного раствора (1:200) серной кислоты. В каждую пробирку с тиосульфатом натрия прилейте при перемешивании по 5 мл серной кислоты. Момент сливания растворов отметьте по секундомеру и замерьте время до момента помутнения раствора.
Результаты запишите в табл. 1.
Таблица 1
| № пробирки | Объем раствора тиосульфата натрия, мл | Объем воды, мл | Объем раствора серной кислоты, мл | Общий объем раствора, мл | Условная концентрация тиосульфата натрия, С | Время протекания реакции до помутнения, τ | Скорость реакции в условных единицах, ν = 1/τ |
|
|
|
Контрольные вопросы и задания:
1. Рассчитайте скорость реакции в трех опытах ν = 1/τ в условных единицах.
2.Постройте график зависимости скорости реакции от концентрации тиосульфата натрия, отложив на оси абсцисс условные концентрации тиосульфата натрия, а на оси ординат – скорость реакции.
3. Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ.
4. Согласуются ли ваши наблюдения с законом действия масс?
Опыт 2. Зависимость скорости реакции от температуры
В три большие пронумерованные пробирки налейте по 10 мл разбавленного (1: 200) раствора тиосульфата натрия, в три другие пробирки – по 10 мл разбавленного раствора (1:200) серной кислоты. Разделите пробирки с растворами на три пары: по пробирке с раствором тиосульфата натрия и раствором серной кислоты в каждой паре.
Проведите опыт по взаимодействию серной кислоты с тиосульфатом натрия при температуре в лаборатории (определить ее по термометру). Определить время протекания реакции.
|
|
|
Четыре остальные пробирки поместите вместе с термометром в стеклянный стакан с водой и медленно нагревайте на газовой горелке до температуры на 10˚С выше, чем температура в лаборатории. Слейте содержимое двух пробирок и определите время протекания реакции.
Повторите опыт, нагрев содержимое стакана до температуры на 20˚С выше температуры в лаборатории, слейте растворы и определите время протекания реакции.
Результаты опытов запишите в табл. 2.
Таблица 2
| № пробирки | Объем раствора тиосульфата натрия, мл | Объем раствора серной кислоты, мл | Температура, оС | Время до появления мути, с | Скорость реакции в условных единицах,
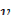 =1/ =1/ 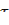
|
Контрольные вопросы и задания:
1. Постройте график зависимости скорости химической реакции от температуры и рассчитайте температурный коэффициент скорости реакции γ.
2. Сделайте вывод о зависимости скорости химической реакции от температуры.
1. Какие значения принимает температурный коэффициент для большинства химических реакций?
Опыт 3. Зависимость скорости гетерогенной реакции от величины поверхности раздела фаз
|
|
|
Одинаковые навески (приблизительно по 0,5 г) куска мрамора и измельченного мрамора поместите в 2 пробирки (№ 1 и № 2). Налейте в эти пробирки по 5 мл 10 %-ного раствора соляной кислоты.
Момент начала реакции отметьте по секундомеру. Отметите различие скорости газовыделения в обеих пробирках. Определите время протекания реакции в пробирках 1 ( 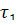 ) и 2 (
) и 2 ( 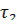 ). Определите скорость реакций
). Определите скорость реакций 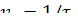 , v 2 = 1/ τ 2 и отношение v2/v1.
, v 2 = 1/ τ 2 и отношение v2/v1.
Контрольные вопросы и задания:
1.Объясните различия скоростей реакции v 1 и v 2 .
2. Как влияет на скорость химической реакции, протекающей в гетерогенной среде, величина поверхности реагирующих веществ?
3. Заполните табл. 3.
Таблица 3
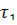
| 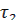
| 
| 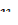
| 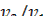
|
Опыт 4. Смещение химического равновесия при изменении концентрации реагирующих веществ
Смешайте в стакане по 10 мл 0,001 н. растворов хлорида железа(III) и роданида калия.
Напишите уравнение этой обратимой реакции и выражение константы равновесия для нее.
Полученный раствор разлейте поровну в четыре пробирки. В первую пробирку добавьте 1-2 мл концентрированного раствора хлорида железа(III), во вторую - концентрированного раствора роданида калия, в третью - несколько кристаллов хлорида калия, в четвертую пробирку оставьте для сравнения. Сравните цвет жидкостей в пробирках. По изменению интенсивности окраски сделайте вывод об изменение концентрации роданида железа(III), т.е. о смещении равновесия.
Контрольные вопросы и задания:
1. Объясните изменение цвета на основании закона действия масс.
2. Составьте выражение для константы равновесия процесса и сделайте вывод о сдвиге равновесия при увеличении концентрации исходных веществ и продуктов реакции.
3. Сместиться ли равновесие при разбавлении полученных растворов?
Опыт 5. Влияние температуры на состояние химического равновесия
 Прибор (рис. 1), заполняется оксидом азота(IV). Измерения молярной массы показали, что при нагревании выше 140 оС этот газ состоит исключительно из мономеров, а при понижении температуры происходит постепенная димеризация:
Прибор (рис. 1), заполняется оксидом азота(IV). Измерения молярной массы показали, что при нагревании выше 140 оС этот газ состоит исключительно из мономеров, а при понижении температуры происходит постепенная димеризация:
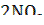
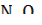 + 54,39 кДж
+ 54,39 кДж
Рис. 1. Прибор для изучения смещения химического равновесия при изменении температуры
Газ NO2 - бурого цвета, N2O4 – бесцветный. Поэтому по изменению цвета смеси можно судить о направлении сдвига равновесия системы.
Одну из колб прибора поместите в стакан с теплой водой, другую – в сосуд со смесью льда и соли. Наблюдайте изменение цвета газовой смеси в колбах. В какую сторону сместилось равновесие в каждой из колб? Выньте сосуды из стаканов. Как изменяется окраска газа в этом случае? Дайте объяснение наблюдаемым явлениям, исходя из принципа Ле Шателье.
Контрольные вопросы:
1. Зачем нужны знания о скорости химических реакций? Какими примерами можно подтвердить то, что химические реакции протекают с различными скоростями?
2. Ч то понимают под скоростью гомогенной реакции? Запишите математическое выражение для скорости такой реакции.
3. О т каких факторов зависит скорость химической реакции? Приведите формулировки законов действия масс и Вант-Гоффа.
4. Ч ему равна константа скорости химической реакции? Каков физический смысл этой величины?
5. К ак изменяется скорость реакции: 2 NO + O 2 = 2 NO 2 , при увеличении концентрации NO в два раза; при одновременном увеличении концентрации NO и О2 каждой в три раза?
6. Две реакции протекали с такой скоростью, что за единицу времени в первой образовался сероводород массой 3 г, во второй — иодоводород массой 10 г. Какая из реакций протекала с большей средней скоростью?
7. Реакция при температуре 50 °С протекает за 2 мин 15 с. За сколько времени закончится эта реакция при температуре 70 °С, если в данном температурном интервале температурный коэффициент скорости реакции равен 3?
8. При температуре 30 °С реакция протекает за 25 мин, при 50 °С — за 4 мин. Рассчитайте температурный коэффициент скорости реакции.
9. Химическая реакция протекает в растворе, согласно уравнению: А + В = С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите среднюю скорость реакции за этот промежуток времени и концентрацию вещества В через 20 мин.
10. Равновесие реакции 2SO2 + O2=2SO3 установилось при концентрации [SO3] = 0,01 моль/л. Исходные концентрации веществ равны: [SO2]=0,03 моль/л и [O2]=0,025 моль/л. Вычислите равновесные концентрации остальных веществ.
Лабораторная работа № 11
Дата добавления: 2018-11-24; просмотров: 461; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
