ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ
Цель работы: экспериментально применить знания теоретического материала по теме «Растворы неэлектролитов»; отработать умение приготовления растворов с заданной массовой долей вещества.
Реактивы и материалы: хлорид натрия твердый, дистиллированная вода.
Оборудование: технохимические весы с набором разновесов, набор ареометров, цилиндр высокий узкий, мерная колба на 100 мл, химические стаканы, колбы, воронки стеклянные, шпатели.
Техника безопасности: соблюдать основные правила работы в химической лаборатории.
Примеры расчетов и методики приготовления растворов
Задание 1: Приготовить 100 мл 6,5 %-го раствора хлорида бария.
По табл. 1 рассчитать плотность 6,5 %-ного раствора хлорида бария. Плотности 6,5 %-ного раствора хлорида бария можно рассчитать методом интерполяции, предполагая, что зависимость плотности от концентрации в узком интервале линейная. Массовая доля 6,5 % находится между 6,0 % и 8,0% следовательно плотность 6,5 %-ного раствора находится между значениями 1,053 и 1,072 г/мл. Концентрация 6,5% больше, чем 6,0% на 0,5 %. При увеличений концентрации на2 % от 6,0 % до 8,0 % плотность увеличивается от 1,053 до 1,072.
Пропорцией можно определить, на сколько плотность (г/мл) 6,5 %-ного раствора больше, чем плотность 6 % - ного раствора (х).
при изменении концентрации раствора на 2 % плотность изменяется на 0,019 г/мл (1,072-1,053)
при изменении концентрации раствора на 0,5 % плотность изменяется на х г/мл
|
|
|
х = 0,005 г/мл.
Плотность 6,5 %-ного раствора равна сумме 6,0 %-ного раствора и х.
ρ6,5% = ρ6% + ρ0,5% = 1,053 + 0,005 = 1,058 г/мл.
Таблица 1
Зависимость плотности раствора от массовой доли растворенного вещества
| ω,%
| ρ, г/мл | ω, %
| ρ, г/мл | ||
| ВаСl2 | NaCl | ВаСl2 | NaCl | ||
| 2,0 | 1,016 | 1,013 | 12,0 | 1,113 | 1,086 |
| 4,0 | 1,034 | 1,027 | 14,0 | 1,134 | 1,101 |
| 6,0 | 1,053 | 1,041 | 16,0 | 1,156 | 1,116 |
| 8,0 | 1,072 | 1,056 | 18,0 | 1,179 | 1,132 |
| 10,0 | 1,092 | 1,071 | 20,0 | 1,203 | 1,148 |
2. Рассчитать массу заданного раствора:
mp-pa= V ∙ p = 100 ∙ 1,058 = 105,80 г.
3. Рассчитать массу растворенного вещества:
m(ВаС12) = mр-ра ∙ ω = 105,80 ∙ 0,065 = 6,88 г.
4. На технохимических весах взвесить 6,88 г ВаС12.
 5. С помощью стеклянной воронки перенести соль в мерную колбу на 100 мл, смыть дистиллированной водой остатки соли с воронки и довести объем до метки. Закрыть колбу пробкой и перемешать раствор, переворачивая колбу до исчезновения кристаллов соли.
5. С помощью стеклянной воронки перенести соль в мерную колбу на 100 мл, смыть дистиллированной водой остатки соли с воронки и довести объем до метки. Закрыть колбу пробкой и перемешать раствор, переворачивая колбу до исчезновения кристаллов соли.
6. С помощью ареометра измерить плотность полученного раствора (рис. 1). Для этого перелить раствор в цилиндр, подобрать ареометр по плотности раствора. Измерение плотности проводить под руководством преподавателя. Предположим, что плотность полученного раствора ρэксп = 1,059 г/мл.
|
|
|
7. Определить концентрацию полученного раствора ωэксп, используя метод интерполяции (см. п. 1).
2 % -------------------- 0,019 г/мл.
х --------------- 0,006 г/мл (ρэксп - р6,0 %),
где: х – разность между ωэксп и ω6,0 % раствора
х = 0,6 %.
ωэксп = 6,0 % + 0,6 % = 6,6 %.
8. Рассчитать ошибку эксперимента:
абсолютная ошибка (∆): ∆ = |6,5 - 6,6| % = 0,1 %.
относительная ошибка (δ): 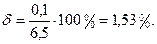
Вывод: определили концентрацию полученного раствора. Она равна 6,6 %. Относительная ошибка эксперимента равна 1,5 %.
Контрольные вопросы и задания: п олучите у преподавателя индивидуальное задание и приготовьте раствор хлорида натрия заданной концентрации по навеске. Рассчитайте абсолютную (∆) и относительную (δ) погрешности эксперимента.
Задание 2: Приготовить 100 мл 6,5 %-го раствора хлорида бария из 4,5 %-го и 7,5 %-го растворов.
1. Определить плотности исходных и заданных растворов по табл. 2.
Таблица 2
Зависимость плотности раствора от массовой доли растворенного вещества
| ω, % | р, г/мл | ω, % | р, г/мл | ||
| ВаС12 | NaCl | ВаС12 | NaCl | ||
| 2,0 | 1,016 | 1,013 | 12,0 | 1,113 | 1,086 |
| 4,0 | 1,034 | 1,027 | 14,0 | 1,134 | 1,101 |
| 6,0 | 1,053 | 1,041 | 16,0 | 1,156 | 1,116 |
| 8,0 | 1,072 | 1,056 | 18,0 | 1,179 | 1,132 |
| 10,0 | 1,092 | 1,071 | 20,0 | 1,203 | 1,148 |
Плотность 6,5 %-го раствора хлорида бария можно рассчитать методом интерполяции, предполагая, что зависимость плотности от концентрации в узком интервале линейная. Массовая доля 6,5 % находится между 6,0 % и 8,0 %, следовательно, плотность 6,5 %-го раствора находится между значениями 1,053 и 1,072 г/мл. 6,5 % больше, чем 6,0 %, на 0,5 %. При увеличении концентрации на 2 % от 6,0 % до 8,0 % плотность увеличивается от 1,053 до 1,072. Можно определить пропорцией, на сколько г/мл плотность 6,5 %-го раствора больше, чем плотность 6 %-го раствора (х):
|
|
|
при изменении концентрации раствора на 2 % плотность изменяется на 0,019 г/мл (1,072-1,053)
при изменении концентрации раствора на 0,5 % плотность изменяется на х г/мл
х = 0,005 г/мл.
Плотность 6,5 %-го раствора равна:
ρ6,5% = ρ6% + ρ0,5% = 1,053 + 0,005 = 1,058 г/мл.
Аналогично,плотность 4,5 %-го раствора:
при изменении концентрации раствора на 2 % плотность изменяется на 0,019 г/мл (1,072-1,053)
при изменении концентрации раствора на 0,5 % плотность изменяется на х г/мл
х = 0,005 г/мл.
Плотность 4,5 %-го раствора равна:
ρ4,5%= ρ4,0%+ ρ0,5% = 1,034 + 0,005 = 1,039 г/мл.
Плотность 5,5 %-го раствора:
при изменении концентрации раствора на 2 % плотность изменяется на 0,019 г/мл (1,072-1,053)
|
|
|
при изменении концентрации раствора на 1,5 % плотность изменяется на х г/мл
х = 0,014 г/мл.
ρ 5,5%= ρ 4,0%+ ρ1,5% = 1,034 + 0,014 = 1,048 г/мл.
Плотность 7,5 %-го раствора:
при изменении концентрации раствора на 2 % плотность изменяется на 0,019 г/мл (1,072-1,053)
при изменении концентрации раствора на 1,5 % плотность изменяется на х г/мл
х = 0,014 г/мл.
ρ 7,5%= ρ 6,0%+ ρ1,5% = 1,053 + 0,014 = 1,067 г/мл.
2. Определить массу заданного (6,5 %-го) раствора:
mр-ра = V ∙ р = 1,058 ∙ 100 = 105,80 г.
3. Определить массу растворенного вещества в 6,5 %-м растворе:
m(BaCl2) = 105,8 ∙ 0,065 = 6,877 г.
4. Определить массы 4,5 %-го и 7,5 %-го растворов:
а) обозначим массу 4,5 %-го раствора за х:
m4,5% = х г.
Масса 7,5 %-го раствора в растворе после смешения исходных растворов:
m 7,5% = m 4,5% - х = (105,8 - х) г.
Масса растворенного вещества в 4,5 % -ом растворе:
m(BaCl2)4,5%= (0,045 ∙ х) г.
Масса растворенного вещества в 7,5 %-м растворе:
m(BaCl2) =(105,8 - х) ∙ 0,075 г.
Масса растворенного вещества в 6,5 %-м растворе равна сумме масс растворенного вещества в 4,5 %-м и 7,5 %-м растворах:
m(BaCl2)6,5% = m(BaCl2)4,5% + m(BaCl2)7,5% = 0,045∙х + (105,8 - х) ∙0,075 = 6,877 г,
Тогда, х = 35,27.
m4,5% р-ра = 35,27 г; m7,5%= 105,8 – 35,27 = 70,53 г.
б) для расчета масс исходных растворов можно воспользоваться правилом креста:


 4,5% 1 м.ч.
4,5% 1 м.ч.
 6,5 %
6,5 %

 7,5 % 2 м.ч.
7,5 % 2 м.ч.
Масса 4,5 %-го раствора относится к массе 7,5 %-го раствора как 1 : 2. На массу 6,5 %-го раствора приходятся 3 массовые части.
m4,5% - 1 м.ч.
m6,5% - 3 м.ч.
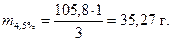

m7,5%= 105,80 – 35,27 = 70,53 г.
5. Определить объемы исходных растворов:
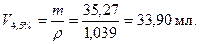
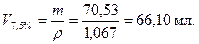
6. Приготовить 6,5 %-й раствор в колбе сливанием рассчитанных объемов исходных растворов. Объемы растворов измерить с помощью цилиндра с точностью до 0,5 мл. Раствор перемещать стеклянной палочкой.
7. Подобрать соответствующий ареометр и измерить плотность полученного раствора.
Предположим, что рэксп = 1,058 г/мл.
8. По измеренной плотности определить концентрацию полученного раствора ωэксп, используя метод интерполяции:
2,0 % ------------------ 0,019 г/мл
х % ------------------- 0,005 г/мл (ρэксп - р6,0 %),
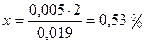
ωэксп = 6,0 + 0,53 = 6,53 %.
9. Рассчитать абсолютную (∆) и относительную (δ) погрешности измерения:
∆ = |6,53 - 6,5| = 0,03 %.
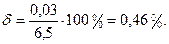
Вывод: определили концентрацию полученного раствора. Она равна 6,53 %. Относительная ошибка эксперимента равна 0,46 %.
Контрольные вопросы и задания: п олучите у преподавателя индивидуальное задание и приготовьте раствор хлорида натрия заданной концентрации смешением двух растворов с различной массовой долей растворенного вещества в них. Рассчитайте абсолютную (∆) и относительную (δ) погрешности эксперимента.
Контрольные вопросы:
1. Что показывает массовая доля растворенного вещества? В каких единицах она выражается?
2. Как выразить состав раствора через плотность?
3. Каково устройство и принцип действия ареометра? Для чего он применяется ?
4. Перечислите способы, с помощью которых ненасыщенный раствор можно сделать насыщенным.
5. Какая масса 20 %-ного раствора соляной кислоты потребуется для нейтрализации 45 г 15 %-ного раствора гидроксида натрия?
6. В каком соотношении по объему смешали 4,2 % раствор гидроксида натрия (плотность 1,045 г/мл) и раствор того же вещества с концентрацией 6,12 моль/л (плотность 1,22), если при этом получился 10,1% раствор.
7. Масса соли, которая вводится в организм при вливании 353 г физиологического раствора, содержащего 0,85% по массе поваренной соли, равна?
8. При поглощении оксида серы(VI) 55,6 мл раствора серной кислоты (массовая доля кислоты 91%, плотность раствора 1,8 г/мл) массовая доля кислоты в образовавшемся растворе составила 96,3%. Определите массу поглощенного оксида серы(VI).
9. Из 300 г насыщенного при 40 оС раствора хлорида цинка (растворимость 452,5 г в 100 г воды) при охлаждении до 0 оС выпало 254 г кристаллогидрата, а массовая доля соли в растворе снизилась до 73,1%. Установите формулу кристаллогидрата?
10. Определите молярную, моляльную, нормальную концентрацию и титр 20%-ного раствора серной кислоты (плотность 1,14 г/мл).
Лабораторная работа № 7
Дата добавления: 2018-11-24; просмотров: 493; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
