ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Цель работы: закрепить знания по теме «Электролитическая диссоциация»; изучить процесс электролитической диссоциации и смещение равновесия в растворах электролитов; исследовать влияние ионов на окраску индикатора;
приобрести практический навык в проведении реакций ионного обмена.
Реактивы и материалы: цинк гранулированный, хлорид меди(II) твердый, хлорид аммония твердый, ацетон, 0,1 н. раствор соляной кислоты, 0,1 н. раствор уксусной кислоты, раствор хлорида кальция, 2 н. раствор гидроксида натрия, 2 н. раствор аммиака, раствор хлорида алюминия, раствор хлорида натрия, лакмус, метиловый оранжевый, фенолфталеин, дистиллированная вода.
Оборудование: набор пробирок, химические стаканы, колбы, воронки стеклянные, шпатели.
Техника безопасности: соблюдать основные правила работы в химической лаборатории.
Опыт 1. Диссоциация солей
Возьмите немного хлорида меди(II). Одну часть соли растворите в ацетоне, в другую – в воде.
Каков цвет твердой соли хлорида меди( II )?Наблюдайте окраску раствора в первом и во втором случае. Дайте объяснение.
Кристаллик хлорида меди(II) растворите в 2-3 каплях воды. Добавьте несколько миллилитров воды. Наблюдайте изменение окраски раствора.
Каков цвет водного раствора хлорида меди( II )? Дайте объяснение изменению окраски раствора соли после добавления к нему воды.
Напишите уравнение диссоциации хлорида меди( II ).
Опыт 2. Сравнение химической активности сильных и слабых электролитов
|
|
|
В одну пробирку налейте 5 мл 0,1 н. раствора соляной кислоты, в другую – столько же 0,1 н. раствора уксусной кислоты. Опустите в каждую пробирку по одинаковому кусочку цинка.
Какой газ выделяется в пробирках? Напишите уравнения протекающих реакций. В какой кислоте процесс идет более энергично? Объяснить это явление, пользуясь данными о степени диссоциации соляной и уксусной кислот в их 0,1 н растворах.
Налейте в две пробирки раствор хлорида кальция. В одну пробирку добавьте 2 н. раствор гидроксида натрия, а в другую – такой же объем 2 н. раствора аммиака.
Опишите Ваши наблюдения? Объясните причину различного действия на хлорид кальция взятых оснований.
Опыт 3. Окраска индикаторов
Налейте в три пробирки по 3 мл дистиллированной воды и прибавьте по 2 капли раствора одного из индикаторов: лакмуса, метилового оранжевого и фенолфталеина. Отметьте в табл. 1 их цвет в нейтральной среде. В каждую пробирку прибавьте по 2 мл раствора любой кислоты. Наблюдайте изменения окраски и запишите их в соответствующие графы табл. 1.
Проделать то же самое, взяв вместо кислоты раствор какой-либо щелочи.
Таблица 1
| Среда | Цвет индикатора
| ||||
| Лакмуса | Метилового оранжевого | Фенолфталеина | |||
| Нейтральная | |||||
| Кислая | |||||
| Щелочная | |||||
Опыт 4. Химическое равновесие в растворах электролитов
Налейте в пробирку 5 мл воды и две капли фенолфталеина. Внесите в пробирку одну каплю концентрированного раствора аммиака.
Как изменилась окраска фенолфталеина? Какова реакция среды раствора аммиака?
Напишите уравнения реакций обратимых процессов, происходящих при растворении аммиака в воде.
Разлейте содержимое пробирки пополам и к одной части добавьте щепотку хлорида аммония. Перемешайте раствор стеклянной палочкой и сравните окраску растворов в двух пробирках.
Объясните смешение равновесия процесса диссоциации гидроксида аммония при добавлении хлорида аммония.
Напишите выражение константы его диссоциации.
Опыт 5. Ионные реакции в растворах электролитов
Проделайте качественную реакцию на хлорид-ионы, взяв для исследований разбавленный раствор соляной кислоты и растворы хлоридов различных металлов.
Качественной реакцией на хлорид-ионы является образование белого творожистого осадка хлорида серебра.
Каким сокращенным ионным уравнением можно выразить все проведенные реакции?
|
|
|
Контрольные вопросы:
1. Что такое электролитическая диссоциация? Каков механизм этого процесса? Какие вещества называются электролитами?
2. Дайте определение понятию степень диссоциации. В чем разница между истинной и кажущейся степенью диссоциации?
3. Напишите уравнения электролитической диссоциации следующих веществ и покажите в каких случаях диссоциация идет ступенчато: AlCl 3 , Cu ( NO 3 )2, Ca ( OH )2, H 3 PO 4 , H 2 SO 3 , NaOH .
4. Укажите, имеют ли окраску (и какую) следующие гидратированные ионы: H + , OH - , Co 2+ , Ca 2+ , Ag + , Cu 2+ , MnO 4 - , Cl - .
5. Напишите уравнения последовательных стадий электролитической диссоциации угольной кислоты и выразите в общем виде их константы диссоциации.
6. Какое вещество из предложенных (H2SiO3; Na2SiO3; SiO2; CaSiO3) при диссоциации образует ион SiO 3 2- ?
7. Какому молекулярному уравнению соответствует сокращенное ионное:
Al + + 3 OH – = Al ( OH )3  ?
?
Al 2 O 3 + НС l 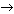 ... ; Al2O3 + Н2O
... ; Al2O3 + Н2O 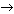 ... ; АlPO4 + КОН
... ; АlPO4 + КОН 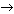 ... ; АlCl3 + КОН
... ; АlCl3 + КОН  ... .
... .
8. C какими из предложенных веществ (KNO3; НNО3; СuCl2; СaO) будет взаимодействовать гидроксид натрия?
9. Установлено, что в 0,01 M растворе уксусной кислоты степень протолиза a составляет 4,2%. Рассчитайте рН этого раствора.
10. Определите степень диссоциации гидрата аммиака NH3 . H2O в 0,002М растворе, если его рН равен 10,3 при 25 oС.
|
|
|
Лабораторная работа № 8
Дата добавления: 2018-11-24; просмотров: 895; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
