ПОЛУЧЕНИЕ И СВОЙСТВА ОСНОВНЫХ КЛАССОВ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Цель работы: изучение некоторых способов получения и свойства веществ различных классов неорганических соединений.
Реактивы и материалы: оксид фосфора(V), ацетат натрия, оксид кальция, оксид цинка, оксид свинца(IV), разбавленный раствор серной кислоты, фенолфталеин (спиртовой), раствор сульфата цинка, раствор хлорида алюминия, раствор сульфата меди(II), раствор хлорида железа(III), 2 н. раствор гидроксида натрия, раствор хлорида кальция, раствор ацетат свинца(IV), нейтральный раствор лакмуса.
Оборудование: штативы с пробирками, фарфоровая чашка, железная ложечка для сжигания, химические стаканы и колбы, предметное стекло, стеклянные палочки.
Техника безопасности: соблюдать основные правила работы в химической лаборатории, а также технику безопасности при работе с концентрированными растворами кислот, красным фосфором.
Опыт 1. Получение оксидов
Положите немного красного фосфора в металлическую ложку для сжигания твердых веществ, зажгите его и быстро внесите в сухую коническую колбу, сразу же прикройте колбу стеклянной пластинкой. После того, как горение фосфора закончится, выньте ложку из колбы и тщательно прокалите ее в пламени горелки. Оксид фосфора оставьте в колбе для следующего опыта.
Напишите уравнения реакций горения фосфора в избытке и недостатке кислорода.
Опыт 2. Получение кислоты
а) Взаимодействие кислотного оксида с водой. В колбу с оксидом фосфора(V) прилейте 5 мл дистиллированной воды, закройте колбу пробкой и тщательно взболтайте содержимое. Полученный раствор перелейте в чистую пробирку и докажите наличие кислоты в нем.
|
|
|
Напишите уравнение реакции соединения кислотного оксида с водой.
Испытайте полученный раствор лакмусом. Что наблюдается?
б) Взаимодействие соли с кислотой. Положите в пробирку немного твердого ацетата натрия и смочите его раствором серной кислоты. Определите по запаху какое вещество образовалось.
Напишите уравнение реакции взаимодействия ацетата натрия с разбавленной серной кислотой.
Опыт 3. Получение нерастворимых оснований
Подберите из имеющихся в лаборатории реактивов растворы двух солей, которые при взаимодействии со щелочами образуют нерастворимые в воде основания. Одно из оснований должно обладать амфотерными свойствами. Получите эти основания, уточнив у преподавателя, какой объем раствора соли нужно взять.
Перенесите полученные осадки на гладкий фильтр, промойте дистиллированной водой и высушите между листами фильтровальной бумаги.
Разделите полученные осадки на две части. Одну часть осадков поместите в фарфоровую чашку и нагреете. Вторую часть осадков используйте для изучения амфотерных свойств оснований.
|
|
|
Напишите уравнения реакций образования нерастворимых оснований в молекулярной и ионной форме. Отметьте изменение цвета, там, где оно будет наблюдаться, при прокаливании осадков. Напишите уравнения реакций, доказывающие амфотерные свойства одного из полученных Вами оснований.
Опыт 4. Получение солей
а) Получение средней соли. Из имеющихся реактивов двумя способами получите сульфат цинка. Реактивы подберите такие, чтобы реакция протекала необратимо и в растворе образовалась бы только одна соль - сульфат цинка. Одну каплю полученного раствора перенесите стеклянной палочкой на предметное стекло. Осторожно выпарите раствор до начала кристаллизации (стекло не должно касаться пламени горелки). Кристаллы появляются преимущественно по краям капли.
Напишите уравнения реакций получения сульфата цинка в молекулярной и ионной форме. Отметьте, какие внешние признаки протекания химических реакций наблюдаются.
Рассмотрите полученные кристаллы. Сравните их с образцом. Зарисуйте в тетради.
б) Получение основной соли. В пробирку с раствором ацетата свинца(II) прибавьте немного оксида свинца и нагрейте. Запишите результаты наблюдений и уравнение химической реакции.
|
|
|
Контрольные вопросы:
1. Дайте определение кислот, оснований и солей с точки зрения теории электролитической диссоциации.
2. Опишите способы получения кислот. Напишите уравнения реакций.
3. Напишите графические формулы кислот: серной, сернистой, ортофосфорной, угольной, дихромовой H 2 Cr 2 O 7 .
4. Опишите способы получения оснований. Приведите примеры. Напишите уравнений реакций.
5. Перечислите известные Вам растворимые в воде основания.
6. Опишите способы получения средних солей. Приведите примеры. Напишите уравнений реакций в молекулярной и ионной форме.
7. Опишите способы получения кислых и основных солей. Приведите примеры. Напишите уравнений реакций в молекулярной и ионной форме.
8. Составьте уравнения реакций получения всеми возможными способами солей хлорида магния и сульфата кальция.
9. Напишите уравнения реакций превращения указанных солей в средние соли: Na 2 HPO 4 , Al ( OH )2, Al ( OH )2 Cl , Bi ( OH )( NO 3 )2.
10. Составьте уравнения реакций в молекулярной и ионной форме, с помощью которых можно осуществить следующие превращения:
P → P 2 O 5 → H 3 PO 4 → Ca 3 ( PO 4 )2 → Ca ( H 2 PO 4 )2
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ ОТНОСИТЕЛЬНОЙ МОЛЕКУЛЯРНОЙ МАССЫ ОКСИДА УГЛЕРОДА(IV)
|
|
|
Цель работы: научиться экспериментально, на основе закона Авогадро и следствий из него, определять относительную молекулярную массу газообразных веществ.
Реактивы и материалы: мрамор, раствор соляной кислоты, раствор концентрированной серной кислоты, дистиллированная вода.
Оборудование: установка для получения и очистки оксида углерода(IV), технохимические весы с набором разновесов, термометр, барометр, колба с пробкой, цилиндр, часы с секундомером.
Техника безопасности: соблюдать основные правила работы в химической лаборатории и при работе с аппаратом Киппа.
Установка (рис. 1) состоит из аппарата Киппа 1, заряженного кусками мрамора и соляной кислотой, двух последовательно соединенных склянок Тищенко 2 и 3 (склянка 2 заполнена водой для очистки проходящего оксида углерода(IV) от хлороводорода и от механических примесей, склянка 3 — серной кислотой для осушки газа) и колбы 4 емкостью 250 мл для собирания оксида углерода(IV).
Вымыть и высушить колбу. Подобрать к ней пробку и отметить уровень, до которого входит пробка в горло колбы (надеть на горло колбы резиновое кольцо или сделать метку карандашом по стеклу). Взвесить колбу с пробкой с точностью до 0,01 г. Данные записать.

Наполнить колбу оксидом углерода(IV), опустив газоотводную трубку до дна колбы. Закрыть колбу пробкой (пробка должна входить на ту же глубину, что и при взвешивании колбы) и вновь взвесить. Чтобы быть уверенным в том, что воздух из колбы полностью вытеснен и она целиком наполнена оксидом углерода(IV), надо, взвесив колбу, еще раз на несколько минут опустить в нее газоотводную трубку, пропустить газ и вновь взвесить колбу, повторяя эту операцию до получения постоянной массы колбы с газом. Значение массы колбы с оксидом углерода (IV) записать.
Определить объем колбы, наполнив ее водой до пробки, измерить затем объем воды мерным цилиндром и записать результаты. Отметить и записать показания термометра и барометра во время опыта.
Форма записи наблюдений
1. Масса колбы (с пробкой) с воздухом — m1 (г).
2. Масса колбы (с пробкой) с оксидом углерода(IV) — m2 (г).
3. Объем колбы— V (мл).
4. Температура — t (°С).
5. Давление — р (кПа).
Обработка результатов
1. Объем воздуха в колбе V привести к нормальным условиям (T0 = 273К, р0 = 101,3 кПа) по формуле 1:
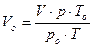 (1)
(1)
где: V — объем колбы, л; р — атмосферное давление, кПа; Т — температура комнаты, К (ро - 101,3 кПа, Т0 - 273 К).
2. Вычислить массу воздуха m3, который находился в колбе, зная, что масса 1 л воздуха при нормальных условиях равна 1,29 г.
3. Вычислить массу оксида углерода(IV) m(СO2) в колбе:
m(CO2) = m2 - (m1 - m3)
4. Вычислить плотность оксида углерода(IV) по воздуху по формуле 2:
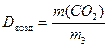 (2)
(2)
5. Вычислить относительную молекулярную массу оксида углерода(IV):
Mr = 29 ∙ Dвозд
6. Вычислить абсолютную (∆) и относительную (δ) ошибку опыта (в %) по формулам 3 и 4:
∆абс = хi - хист, (3)
где: хi - полученное значение определяемой величины; хист - истинное (действительное) значение параметра.
∆ = Mr(теор) – Mr
Относительная ошибка:
δ = ∆абс/ хист (4)
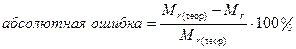
7. Сделать вывод, указав полученное значение определяемой величины, значение абсолютной и относительной ошибки эксперимента.
Контрольные вопросы:
1. Что называется плотностью газа по воздуху?
2. Как можно вычислить относительную молекулярную массу вещества, зная плотность его паров по воздуху?
3. Какова плотность по воздуху оксида углерода( IV )?
4. Как изменится плотность газа при изменении давления?
5. Как зная массу определенного объема газа, найти его молярную массу?
6. Показать, пользуясь определениями, что молярная масса численно равна относительной молекулярной. Какие размерности имеют эти величины?
7. Масса смеси оксидов углерода равна 44 г, объем смеси 28 л (н.у.). Сколько молекул СО2 приходится на 1 молекулу СО?
8. Какой объем оксида углерода( IV ) (н.у.) выделится при обработке 15 г карбоната натрия, содержащего 15 % примесей, избытком соляной кислоты?
9. Определите относительную атомную массу пятивалентного элемента, если он образует оксид, содержащий 56,3% кислорода.
10. Какой объем займет при 18 оС и 98 кПа оксид углерода( IV ), выделившийся при разложении 250 г карбоната кальция?
Лабораторная работа № 6
Дата добавления: 2018-11-24; просмотров: 942; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
