Требования к реакциям в методах осаждения
1. в результате реакции должно образоваться малорастворимое соединение
2. должны быть быстрыми
3. должны быть необратимыми ( осадок не долен растворяться)
4. не должно быть побочных реакций
5. четкое изменение окраски в точке эквивалентности
К методам осаждения относятся методы
- аргентометрия по Мору
- аргентометрия по Фаянсу ( с ПДИ= поверхностно-действующий индикатор)
-аргентометрия по Фольгарду = роданометрия (устар.)= тиоцианометрия.
Из названия методов видно, что рабочим раствором является раствор нитрата серебра, который готовят по приблизительной навеске( с титром установленным ). Это объясняется тем, что нитрат серебра на свету разлагается
2AgNO3 = 2Ag +2NO2 + O2
Исходным веществом метода является хлорид натрия, растворы которого готовят по точной навеске ( с титром приготовленным).
Точную концентрацию нитрата серебра по раствору хлорида натрия определяют по индикатору хромат калия.
МЕТОД МОРА.
Индикатором метода является хромат калия.
Этим методом можно определить соли хлороводородной или бромоводородной кислоты.
(! йодиды этим методом определить нельзя, т.к. из-за высоких адсорбционных свойств осадка йодида серебра результаты титрования могут быть переменными)
NaCl + AgNO3 = AgCl↓ + NaNO3
белый
в точке эквивалентности:
K2CrO4 + 2AgNO3 = Ag2CrO4↓ + 2KNO3
желто-розов.
|
|
|
В этом методе титрование проводят в нейтральной среде (рН 6-8):
В кислой среде титровать нельзя,т.к. хромат серебра будет растворяться и невозможно зафиксировать точку эквивалентности
Ag2CrO4 ↓+ 2HNO3 = 2AgNO3 + H2CrO4
В присутствии аммиака осадки будут растворяться ( не выполняется условие метода осаждения)
AgCl ↓+ 2NH4OH = [Ag(NH3)2]Cl + 2H2O
Ag2CrO4↓ + 4NH4OH = [Ag(NH3)2]2CrO4 + 4H2O
В щелочной среде результаты будут завышены, т.к. нитрат серебра будет дополнительно расходоваться на реакцию со щелочью
2AgNO3 + 2NaOH = Ag2O↓ + H2O + 2NaNO3
Прибавляют индикатор в минимальном количестве: 1-2 капли
В избытке индикатора осадок хромата и хлорида серебра могут выпадать одновременно, а не последовательно, титрование будет неверным.
Метод Фаянса.
Титрование в этом методе ведут в присутствии уксусной кислоты.
При определении йодида калия или йодида натрия берут индикатор эозинат натрия,
При титровании органических галогенидов – бром-феноловый синий.
В точске эквивалентности наблюдают двойной эффект:
- коагуляция осадка
- появление характерной окраски осадка (розовая – с эозинатом натрия, сиреневая – с бром-феноловым синим).
KIl + AgNO3 = AgI↓ + KNO3
Желтый
|
|
|
эозанат натрия – NaInd = Na+ + Ind-
розовый
Ind- розовый
I- I- I- I- I- I- I- I- I- в точке эквивал. Ag+ Ind- розовый
AgI желтый AgI
Метод Фольгарда
В этом методе в качестве рабочих растворов используют раствор нитрата серебра и раствор тиоцианата аммония ( роданида аммония).
Индикатор метода Железоаммонийные квасцы NH4Fe(SO4)2×12H2O.( раствор индикатора готовят с добавление кислоты для подавления гидролиза соли, но для предотвращения побочных реакций используют только азотную кислоту, которая с нитратом серебра не взаимодействует, не осаждает его
Титрование можно вести в нейтральной или кислой среде, поэтому этим методом можно определять галогеноводородные кислоты и их соли ( метод обратного титрования):
HCl + AgNO3 = AgCl↓ + HNO3
|
|
|
0,1м/л белый
AgNO3 + NH4CNS = AgCNS↓ + NH4NO3
0,1м/л 0,1м/л белый
в точке эквивалентности NH4Fe(SO4)2 + 3NH4CNS = Fe(CNS)3 + 2(NH4)2SO4
кр-крас. р-р
Растворимые соли серебра определяют методом тиоцианометрии ( прямое титрование)
AgNO3 + NH4CNS = AgCNS↓ + NH4NO3
0,1моль/л белый
в точке эквивалентности NH4Fe(SO4)2 + 3NH4CNS = Fe(CNS)3 + 2(NH4)2SO4
кр-крас. р-р
Метод нитритометрии
Этим методом определяют органические ароматические соединения, имеющие в своем составе ароматическую амино-группу, или нитро-группу ( после её восстановления).
Рабочим раствором является нитрит натрия, из которого готовят растворы с титром установленным ( по приблизительной навеске)
Исходным веществом является сульфаниловая кислота или её амид ( стрептоцид)
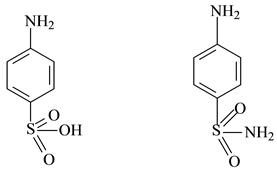 стрептоцид= амид сульфаниловой кислоты
стрептоцид= амид сульфаниловой кислоты
Сульфаниловая кислота
-Титрование ведут в кислой среде ( среде соляной кислоты). Кислота нужна для растворения анализируемых веществ, для образования продуктов реакции и для высвобождения из нитрита натрия азотистой кислоты, которая и реагирует с аминогруппой.
-Титрование ведут в присутствии катализатора – кристаллического бромида калия.
|
|
|
- Титрование проводят медленно: со скоростью 20 капель ( 1мл) в минуту в начале титрования и 4-5 капель в минуту в конце титрования. Это необходимо соблюдать из-за низкой скорости реакции.( при добавлении большого количества нитрита натрия он в кислой среде будет разлагаться до оксидов азота, а не реагировать с определяемым веществом)
- Титрование ведут при температуре 8-100С для предотврщения разложения нитрита натрия.
-Титрование ведут в присутствии индикатора
тропеолинОО ( переход окраски из красной в жёлтую)
тропеолинОО + метиленовый синий в соотношении 1:4 ( переход окраски в точке эквивалентности из фиолетовой в голубую)
нейтральный красный ( переход окраски из красной в синюю)
В результате титрования получают соль – хлористый диазоний
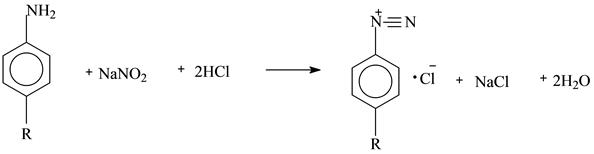
Можно фиксировать точку эквивалентности с помощью внешнего индикатора – йодид-крахмальной бумаги: титруют до тех пор, пока капля раствора, вынесенная на индикаторную бумагу, не вызовет её посинения:
2NaNO2+2KI +4HCl =I2 + 2NO +2NaCl +2 KCl +2H2O
( выделяющийся йод взаимодействует с йодом на бумаге и появляется синее окрашивание )
Методом нитритометрии в фармацевтическом анализе определяют сульфаниламидные препараты и местные анестетики, производные ПАБК.
Метод броматометрии
В качестве рабочего раствора используют раствор бромата калия KBrO3 . В зависимости от степени очистки его могут готовить по точной навеска ( с титром приготовленным), или, если содержит примеси, - по приблизительной ( с титром установленным) и тогда точную концентрацию бромата калия определяют по тиосульфату натрия.
Титрование в методе броматометрии всегда проводят в кислой среде ( 50% серная кислота), точку эквивалентности фиксируют по-разному в зависимости от техники титрования:.
При определении неорганических восстановителей: фосфористой кислолты, аммиака, оксида мышьяка (III) проводят прямое титрование и титруют до обесцвечивания розовой окраски раствора ( индикатор – метиловый оранжевый):
2KBrO3 + 3 As2O3= 2KBr + 3AS2O5
5KBr +KBrO3+ 3H2SO4 =3Br2+ 3K2SO4 +3H2O – выделяющийся бром разрушает молекулу индикатора и раствор обесцвечивается.
При определении ароматических спиртов- фенолов или ароматических аминов проводят обратное титрование в сочетании с косвенным титрованием:
К анализируемому раствору прибавляют раствор бромида калия, серную кислоту и избыток титрованного раствора бромата калия
5KBr +KBrO3+ 3H2SO4 =3Br2+ 3K2SO4 +3H2O
Раствор оставляют в темном месте на 5 минут( чтобы прошла реакция бромирования),
А затем прибавляют раствор йодида калия ( избыток)
2 KI + Br2 = 2KBr + I2
А затем выделившийся йод титруют тиосульфатом натрия по индикатору крахмал
( когда добавляют индикатор? как изменяется окраска в толчке эквивалентности?)
I2 +2 Na2S2O3 = 2NaI + Na2S4O6
( всю операцию титроваия прводят в банке с притертой пробкой из-за летучести продуктов реакции)
Дата добавления: 2018-11-24; просмотров: 1668; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
