Условия йодометрического титрования
1.Титруют в нейтральной или кислой среде. В щелочной среде результаты будут неточными из-за дополнительного расхода йода на реакцию со щелочью:
2NaOH + I2 = NaI + NaIO + H2O
гипойодит натрия
2.Титруют при комнатной температуре или при пониженной (100-120С), т.к. при нагревании йод возгоняется и уменьшается чувствительность индикатора (исчезает синяя окраска)
3. Если реакция идет с выделением свободного йода, то добавляют избыток раствора йодида калия ( часть расходуется на реакцию выделения йода, часть – на растворение выделившегося йода)
Рабочие растворы – раствор йода и раствор тиосульфата натрия
Исходные вещества – дихромат калия и йод очищенный возгонкой
Индикатор – крахмал
Метод трилонометрии ( комплексонометрия=комплексометрия)
В этом методе в качестве рабочих растворов используются растворы поликарбоновых аминокислот, чаще всего – трилонБ( комплексон Б) – динатриевая соль этилен –диамино-тетрауксусной кислоты (ЭДТА)
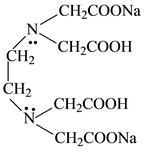
Трилон Б реагирует с солями двух-или трёхзарядных катионов металлов всегда в соотношении 1:1


В результате реакции образуется комплексное соединение прочное, благодаря образованию двух типов связи:
1. между катионом металл и карбоксильной группой ( сплошная черта) – ионная связь
2 между катионом металла и неподелённой парой электронов атома азота (пунктирная линия) – донорно-акцепторная=внутрикомплексная=координационная связь ( очень прочная)
|
|
|
Трилон Б не отвечает требованиям для исходных веществ, поэтому из трилона Б готовят растворы по приблизительной навеске ( с титром установленным).
Исходными веществами метода являются MgSO4 или ZnSO4. Из них готовят растволры с титром приготовленным ( по точной навеске).
В качестве индикаторов используют металлоиндикаторы.
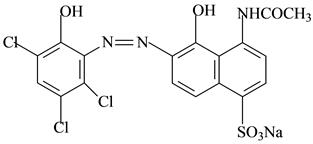 кислотный хром тёмно-синий
кислотный хром тёмно-синий
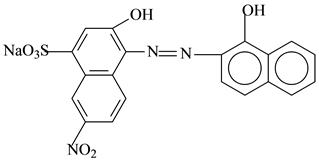 кислотный хром черный специальный или эреохром чёрный.
кислотный хром черный специальный или эреохром чёрный.
Эти индикаторы имеют разную окраску в зависимости от того, находятся ли они в свободном виде или образуют комплекс с катионом металла.
Требования к индикаторам:
1. должны устойчивое окрашивание в точке эквивалентности
2. комплекс катиона металла с индикатором должен быть менее прочнымя, чем комплекс катиона металла с трилоном Б( это условие для перечисленных выше индикаторв выполняется только в щелочной среде, поэтому титрование ведут в присутствии аммиачного буфера).
Эти индикаторы в растворе неустойчивы, поэтому их добавляют по массе. Для того, чтобы добавить минимальное количество индикатора готовят «сухие» растворы, растирая индикатор с хлоридом натрия.
|
|
|
Механизм титрования
Индикатор - Ind
Катион металла – Меn+
Трилон Б - Tr
В начале титрования добавляют индикатор и образуется комплекс катиона металла с индикатором. Раствор окрашивается в красный цвет.
Men + + Ind → Men + × Ind
синий красный
Анализируемый раствор титруют раствором трилона Б:
Men + + Tr → Men + × Tr
В точке эквивалентности лишняя капля трилона Б разрушает комплекс катиона металла индикатора и происходит изменение окраски раствора.
Men+×Ind + Tr→ Men+×Tr + Ind
красный синий
Методом трилонометрии можно определить соли двух- и трёхзарядных катионов металлов и органических и неорганических кислот.
( хлорид и глюконат кальция, сульфат или хлорид магния, хлорид цинка и т.п.)
МЕТОДЫ ОСАЖДЕНИЯ
Дата добавления: 2018-11-24; просмотров: 329; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
