Материал используется для выполнения контрольной работы №2
Метод нейтрализации =
Кислотно-основное титрование в водных средах
Основное уравнение метода H+ + OH- = H2O
Т. е. методом нейтрализации можно определить вещества кислотного или основного характера.
По тому, какой раствор используют для титрования, метод делится на подметоды:
· ацидиметрия (титрование кислотой)
· алкалиметрия (титрование щелочью)
В методе ацидиметрии в качестве рабочих растворов используют растворы хлористоводородной или серной кислоты (уксусная кислота не используется, т.к. при титровании слабых оснований реакция будет обратимой, а такие реакции в титриметрическом анализе не используют.
CH3COOH + NH4OH ↔ CH3COONH4 + H2O
Азотная кислота не используется, т.к. кроме кислотных свойств, обладает свойствами окислителя, реакция может идти в нескольких направлениях, а такие реакции в титрeметрическом анализе не используют
Na2S + 2HNO3 = 2NaNO3 + H2S
3Na2S + 8HNO3 = 6NaNO3 + 2NO + 3S + 4H2O
По какой из этих реакций вести расчёт?).
Серная и хлористоводородная кислота не отвечает требованиям для исходных ( не имеют постоянного состава, т.к. отпускаются в виде растворов %% концентрации), поэтому растворы кислот готовят с титром установленным (приблизительной концентрации).
Исходными (стандартными ) веществами являются
· карбонат натрия Na2CO3
· оксалат натрия Na2C2O4
· тетраборат натрия (бура) Na2B4O7×10H2O
Из них готовят растворы с титром приготовленным ( точной концентрации)
|
|
|
По результатам титрования рассчитывают точную концентрацию раствора кислоты::
2HCl + Na2B4O7 + 5H2O = 4H3BO3 +2 NaCl
C(fHCl)×VHCl = C(fNa….)×VNa…..
В этой формуле известны величины: объёмы известны – раствор тетрабората натрия берут пипеткой, а объём раствора кислоты измеряют бюреткой. Концентрация раствора тетрабората натрия известнап при приготовлении. Осталось рассчитать (установить) концентрацию кислоты.
В методе алкалиметрии в качестве рабочих растворов используют растворы гидроксида натрия или калия. Гидроксид натрия используют чаще, т.к. натрий более распространен в природе и его соединения более дешевы. Щёлочи очень гигроскопичны, могут поглощать угольный ангидрид из воздуха ( углекислый газ), поэтому не отвечают требованиям для исходных веществ (требование чистоты), из них готовят растворы с титром установленным (приблизительной концентрации).
Исходными веществами метода алкалиметрии являются:
· кислота щавелевая H2C2O4
· кислота янтарная H2C4H4O4
Из них готовят растворы с титром приготовленным ( точной концентрации).
По результатам титрования рассчитывают точную концентрацию раствора щелочи:
2NaOH + H2C2O4 = Na2C2O4 + 2H2O
C(fH...)×VH... = C(fNaOH)×VNaOH
|
|
|
Ионное произведение воды. Понятие о рН.
Вода относится к слабым электролитам и диссоциирует с образованием:
H 2 O ↔ H + + OH -
Этот процесс описывается выражением константы, которая называется ионное произведение воды Кw
Kw = [H+]×[OH-] = 10-14
[OH-] = 10-2 [H+] = 10-12 cреда щелочная рН = 12
[OH-] = 10-4 [H+] = 10-10 среда щелочная рН =10
[OH-] = 10-7 [H+] = 10-7 среда нейтральная рН = 7
[OH-] = 10-9 [H+] = 10-5 среда кислая рН = 5
[OH-] = 10-13 [H+] = 10-1 среда кислая рН = 1
[OH-] = 10-14 [H+] = 100 среда кислая рН = 0
Пользоваться отрицательными степенями неудобно, поэтому ввели понятие рН (водородного показателя) рН = -lg[H+]
0 - 6 среда кислая 7 - среда нейтральная 8 - 14 среда щелочная. Чем меньше зачение, тем кислее раствор, чем больше значение рН, тем раствор более щелочной
Индикаторы метода нейтрализации
В методе нейтрализации используют одноцветные (фенофталеин) или двухцветные ( метиловый оранжевый) индикаторы. Эти индикаторы относятся к ароматическим соединениям класса фенолов или аминов, но в зависимости от реакции среды имеющие разную окраску.
Например, фенолфталеин
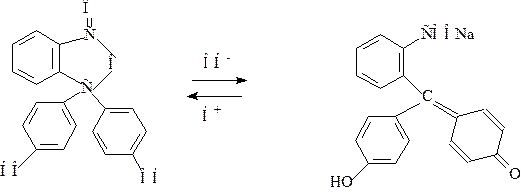
бесцветный малиновый
Для индикаторов метода нейтрализации используют две характеристики:
|
|
|
· интервал перехода окраски - это интервал значений рН, при которых индикатор имет сиешанную краску
· показатель титрования рТ - это конкретное значение рН, при котором индикатор наиболее четко изменяет окраску.
·
| индикатор | интервал перехода окраски | показатель титрования |
| ф/ф | 8- 10 | 9 |
| м/ор | 3,2 - 4,4 | 3,4 |
Дата добавления: 2018-11-24; просмотров: 220; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
