Определение концентрации дихромата калия
Определение основано на поглощении света окрашенным раствором калия дихромата.
1. Приготовление стандартного раствора исследуемого вещества, содержащего 0,1 мг калия дихромата в 1 см3
Точную навеску 0,1000 г калия дихромата помещают в мерную колбу вместимостью 100,00 см3, растворяют в 20 см3 1М раствора серной кислоты и доводят объем тем же раствором до метки. В мерную колбу вместимостью 100,00 см3 пипеткой помещают 10,00 см3 приготовленного раствора и доводят объем до метки 1М раствором серной кислоты.
Приготовление серии эталонных растворов
Серию эталонных растворов готовят из стандартного раствора в мерных колбах в соответствии с табл.
| № эталонного раствора | V стандартного раствора, см3 | V 1М раствора H2SO4, см3 | Содержание K2Cr2O7, мкг/см3 | Оптическая плотность |
| 1 | ||||
| 2 | ||||
| 3 | ||||
| 4 | ||||
| 5 | ||||
| Х |
В качестве раствора сравнения используют 1М раствор серной кислоты
Измерение оптической плотности эталонных растворов
Обработка данных фотометрирования эталонных растворов
Полученные значения оптической плотности эталонных растворов используют для построения градуировочного графика в координатах D – C.
ХРОМАТОГРАФИЯ
Разделение и обнаружение ионов Hg22+, Bi3+, Ni2+ методом осадочной хроматографии на бумаге
|
|
|
На приготовленную бумагу наносят капиллярами в различные точки по 1 капле 0,1М растворов нитратов Ві3+, Hg22+, Ni2+.
Растворы наносят постепенно: касаются капилляром бумаги и после впитывания небольшого количества раствора капилляр отстраняют от бумаги, а затем эту операцию повторяют несколько раз до полного впитывания исследуемого раствора.
Полученные после этого хроматограммы промывают с помощью капилляра 2-3 каплями дистиллированной воды. Каждую следующую каплю вносят после впитывания предыдущей. Промывание повторяют до тех пор, пока размер зоны не увеличится в 2-3 раза.
Хроматограммы подсушивают и проявляют парами концентрированного раствора аммиака. В центре хроматограммы с раствором Hg2(NO3)2 наблюдают образование черного пятна. Хроматограмма с раствором Bi(NO3)3 имеет вид желтого кольца. Хроматограмму с раствором Ni(NO3)2 обрабатывают с помощью кисточки, смоченной раствором реактива Чугаева: проводят по хроматограмме от ее центра к периферии. Наблюдают образование зоны красного цвета. Затем получают по аналогичной методике хроматограмму смеси 0,1М растворов нитратов Bi3+, Hg22+ и Ni2+.
Полученную хроматограмму проявляют, как описано выше. Сравнивают хроматограммы 0,1М растворов нитратов катионов и исследуемой смеси. Делают вывод о составе исследуемого раствора.
|
|
|
КЛАССИФИКАЦИЯ КАТИОНОВ ПО КИСЛОТНО-ОСНОВНОМУ МЕТОДУ АНАЛИЗА
| Группа | Катионы | Групповой реагент | Растворимость соединений |
| I | Na+, K+, NH4+ | Отсутствует | Хлориды, сульфаты и гидроксиды, растворяются в воде |
| II | Ag+, Pb+, Hg22+ | 2М р-р HCl | Хлориды, не растворяются в воде |
| III | Ba2+, Sr2+, Ca2+ | 1М р-р H2SO4 + C2H5OH | Сульфаты, не растворяются в воде |
| IV | Al3+, Zn2+, Cr3+, Sn (II), Sn (IV), As (III), As (V) | Избыток 6М р-ра NaOH + 3% H2O2 | Гидроксиды не растворяются в воде, но растворяются в избытке щелочи |
| V | Fe2+, Fe3+, Mg2+, Mn2+, Bi3+, Sb (III), Sb (V) | Избыток конц. NH3∙Н2O | Гидроксиды, не растворяются в воде, избытке щелочи и аммиаке |
| VI | Co2+, Ni2+, Cd2+, Cu2+, Hg2+ | Избыток конц. NH3∙Н2O | Гидроксиды, не растворяются в воде, избытке щелочи, но растворяются в избытке аммиака |
Ионная сила раствора равна полусумме произведений концентраций ионов на квадрат их зарядов:
 , где , где
|  – концентрация i-того иона в растворе, – концентрация i-того иона в растворе,
 - заряд указанного иона. - заряд указанного иона.
|
С увеличением ионной силы раствора коэффициент активности данного иона уменьшается. Зависимость коэффициента активности очень разбавленного раствора от ионной силы раствора выражается формулой:
|
|
|
 .
.
В нейтральном водном растворе

Так как концентрации [Н+] и [ОН-] в водных растворах выражаются малыми величинами, которыми неудобно пользоваться, то введена логарифмическая форма их выражения:
-lg[H+] = pH,
-lg[OH-] = pOH
Закон разбавления Оствальда:  .
.
Из выражения для констант равновесия слабой кислоты или слабого основания могут быть получены формулы для расчета равновесных концентраций [H+] и [OН–]  :
: 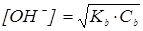
При известных начальных концентрациях кислоты (Ca) или основания (Cb) и их степени ионизации (α) значения [Н+] или [ОН–] в их растворах могут быть вычислены по формуле: 

В водных растворах, насыщенных относительно малорастворимого электролита АaBb, устанавливается равновесие между твердой фазой и раствором ее ионизированной части: ↓ A a Bb  aAb + + bBa –
aAb + + bBa –
Это равновесие описывается константой равновесия, называемой произведением растворимости:
ПР = [Ab+] a ∙[B a– ]b Уравнение для расчета растворимости электролита (S, моль∙л-1) по величине ПР:
 ,
,
рН буферных растворов, состоящих из слабой кислоты и ее соли рассчитывают по уравнению: 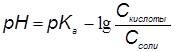
pH буферных растворов, состоящих из слабого основания и его соли рассчитывают по уравнению: 
|
|
|
Буферную емкость рассчитывают по формулам:  , или
, или  ,
,
где СНА и СА- - концентрации компонентов сопряженной кислотно-основной пары;
Таблица для расчета параметров гидролиза
| Соль | Константа гидролиза Кг | Степень гидролиза h | [H+] | [OН–] |
| Образованная сильной кислотой и слабым основанием | 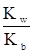
| 
| 
| 
|
| Образованная слабой кислотой и сильным основанием | 
| 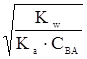
| 
| 
|
| Образованная слабой кислотой и слабым основанием | 
| 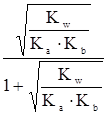
| 
| 
|
Примечание: 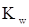 - ионное произведение воды, СBA – концентрация соли, моль∙л-1.
- ионное произведение воды, СBA – концентрация соли, моль∙л-1.
Дата добавления: 2018-10-27; просмотров: 759; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
