Осадительное и комплексиметрическое титрование.
Определение общей жесткости воды
Общая жесткость воды обусловленная присутствием катионов кальция и магния, суммарная концентрация которых определяется комплексонометрически:
В колбу для титрования отмеряют 50,00 см3 (точный объем) исследуемой водопроводной воды, прибавляют 10 см3 аммиачного буферного раствора, 0,1 г индикаторной смеси эриохрома черного Т и титруют стандартным раствором трилона Б до появления синей окраски. Общую жесткость воды (Х) рассчитывают по формуле:
 , ,
| где X – общая жесткость воды, мг-экв/дм3; M – молярность раствора трилона Б, моль/дм3; V1 – объем титранта, см3; V2 – объем воды, взятый для анализа, см3. |
Окислительно-восстановительное титрование.
ПЕРМАНГАНАТОМЕТРИЯ
Определение содержания перекиси водорода в объеме мерной колбы
В основе определения лежит следующая реакция, представленная уравнением:
 MnO4- + 8H+ + 5e
MnO4- + 8H+ + 5e 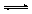 Mn2+ + 4H2O 2 E0 = + 1,51 B
Mn2+ + 4H2O 2 E0 = + 1,51 B
 Н2O2 - 2e
Н2O2 - 2e 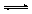 O2 + 2Н+ 5 E0 = + 0,682 B
O2 + 2Н+ 5 E0 = + 0,682 B
2MnO4- + 5Н2O2 + 6H+ ® 2Mn2+ + 5О2 +8H2O
ЕМ Н2О2 =
В мерную колбу вместимостью 100 см3 помещают аликвотный (10,00 см3) объем исследуемого раствора перекиси водорода, доводят объем раствора водой до метки и перемешивают. В колбу для титрования пипеткой отбирают аликвотную часть полученного раствора (10,00 см3), прибавляют 10-15 см3 1М раствора серной кислоты и титруют 0,1М раствором калия перманганата до получения слабо-розовой окраски, устойчивой не менее 15 сек. Титрование повторяют до получения воспроизводимых результатов. Рассчитывают содержание перекиси водорода (г) в объеме мерной колбы.
|
|
|
Определение массовой доли железа (II) в соли Мора
В основе определения лежит следующая реакция, представленная уравнением:
 MnO4- + 8H+ + 5e
MnO4- + 8H+ + 5e 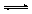 Mn2+ + 4H2O 1 E0 = 1,51 B
Mn2+ + 4H2O 1 E0 = 1,51 B
 Fe2+ - e
Fe2+ - e 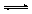 Fe3+ 5 E0 = 0,77 B
Fe3+ 5 E0 = 0,77 B
MnO4- + 5Fe2+ + 8H+ ® Mn2+ + 5Fe3+ + 4H2O
ЕМ Fe2+ =
ЕМ (NH4)2Fe(SO4)2∙6H2O =
Рассчитанную точную навеску (NH4)2Fe(SO4)2×6H2O помещают в колбу для титрования, растворяют в 15-25 см3 1М раствора серной кислоты и титруют стандартным 0,1М раствором калия перманганата до появления слабо-розовой окраски, устойчивой не менее 15 сек. Титрование повторяют до получения воспроизводимых результатов. Рассчитывают массовую долю ионов железа (II) в соли Мора.
ЙОДОМЕТРИЯ
Определение массовой доли аскорбиновой кислоты
В основе определения лежит реакция окисления аскорбиновой кислоты:
ЕМ C6H8O6 =
Рассчитанную точную навеску аскорбиновой кислоты переносят в коническую колбу, растворяют в объеме воды, удобном для титрования, прибавляют 2 см3 крахмала и титруют стандартным раствором йода до появления синей окраски раствора. Титрование повторяют до получения воспроизводимых результатов. Рассчитывают массовую долю аскорбиновой кислоты.
|
|
|
Определение массовой доли сульфата меди (II)
В основе определения лежат следующие реакции, представленные уравнениями:
 Cu2+ + I- + 1e Cu2+ + I- + 1e 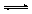 CuI↓ 2 E0 = 0,167 B CuI↓ 2 E0 = 0,167 B
|  I2 + 2e I2 + 2e 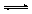 2I- 1 E0 = 0,545 B 2I- 1 E0 = 0,545 B
|
 2I- - 2e 2I- - 2e 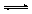 I2 1 E0 = 0,545 B I2 1 E0 = 0,545 B
|  2S2O32- - 2e 2S2O32- - 2e 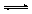 S4O62- 1 E0 = 0,09 B S4O62- 1 E0 = 0,09 B
|
| 2Cu2+ + 4I- ® 2CuI↓ + I2 | I2 + 2S2O32- ® 2I- + S4O62- |
ЕМ CuSO4∙5H2O =
Рассчитанную точную навеску меди сульфата переносят в мерную колбу, растворяют в дистиллированной воде, доводят объем раствора водой до метки и тщательно перемешивают. Отбирают пипеткой аликвотный объем приготовленного раствора, переносят в колбу для титрования, прибавляют 4-5 см3 раствора серной кислоты, 1г калия йодида. Выделившийся йод оттитровывают стандартным раствором натрия тиосульфата (в присутствии осадка меди йодида) до светло-желтой окраски раствора, затем прибавляют 2 см3 раствора крахмала и титруют до обесцвечивания синей окраски. Титрование повторяют до получения воспроизводимых результатов. Рассчитывают массовую долю меди сульфата.
|
|
|
РЕФРАКТОМЕТРИЯ
Определение концентрации глюкозы в водных растворах
Точные навески глюкозы (около 2,50; 5,00; 7,50; 10,00; 12,50 г) переносят в мерные колбы вместимостью 100 см3, растворяют в дистиллированной воде, доводят водой объем раствора до метки и тщательно перемешивают. Измеряют показатель преломления воды – n0, затем показатели преломления приготовленных растворов – n. По полученным данным строят график в координатах n – C. Измеряют показатели преломления исследуемых растворов – nx и определяют их концентрацию по графику.
| № | C % | n |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | ||
| Х1 | ||
| Х2 | ||
| Х3 |
ВАРИАНТ 2
Измеряют показатель преломления воды n0, затем показатель преломления исследуемого раствора глюкозы – n и рассчитывают его концентрацию по формуле:

ФОТОЭЛЕКТРОКОЛОРИМЕТРИЯ
Дата добавления: 2018-10-27; просмотров: 270; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
