Организация дыхательной цепи. Переносчики в дыхательной цепи (ЦПЭ).
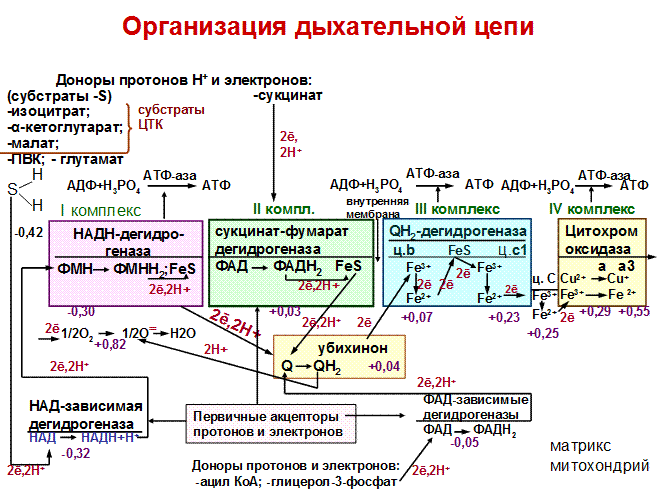
Организация дыхательной цепи
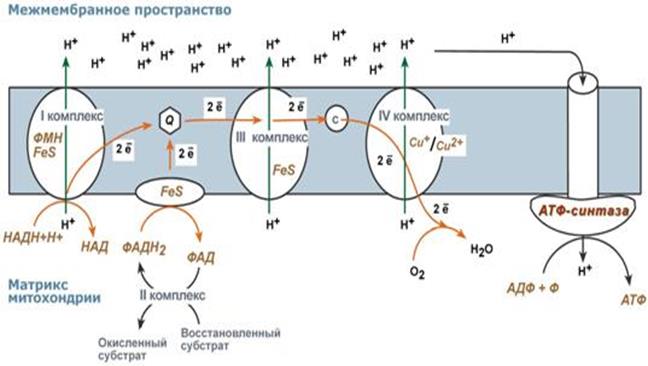
По современным представлениям внутренняя мембрана митохондрий содержит 5 мультиферментных комплексов, включающих множество дыхательных ферментов. Последовательность их расположения – дыхательная цепь.
Компоненты комплексов расположены в порядке возрастания их окислительно-восстановительных потенциалов (редокс-потенциалов). Его величина связана с изменением свободной энергии. Её выражают в вольтах.
Принцип работы дыхательной цепи
1.Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают протоны водорода Н+ и электроны (ē) на ферменты дыхательной цепи.
2. ē движутся по ферментам дыхательной цепи и теряют энергию.
3. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
4. В конце дыхательной цепи ē попадают на О2 и восстанавливают его до Н2О.
5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу (V комплекс).
6. При этом Н+ теряют энергию, которая используется для синтеза АТФ.
Переносчики в дыхательной цепи
I комплекс – НАДН-дегидрогеназа
В комплекс входят две группы: ФМН и FeS (железо-серные белки).
На ФМН комплекса протоны Н+ и 2ē от субстратов передают НАД-зависимые дегидрогеназы, находящиеся в матриксе, с образованием ФМНН2. ФМНН2 ē и протоны транспортируют на FeS, затем на кофермент Q (убихинон). Одновременно с комплекса протоны Н+ переносятся в межмембранное пространство (ММП).
|
|
|
II комплекс - ФАД- зависимые дегидрогеназы.
Состоит из ФАД и FeS. На ФАД ē и протоны отщепляются от субстратов окисления ФАД. ФАД восстанавливается в ФАДН2. С ФАДН2 они передаются на FeS, с FeS – на убихинон.
Убихинон – или кофермент Q. Это небелковый переносчик. Структура КоQ сходна с витаминами К, Е.
Молекулы Q в организме человека содержат 10 изопреноидных звеньев и обозначаются - Q10.
Убихинон является коллектором всех ē, поступающих в митохондрии от разных субстратов и передает их на III комплекс.
Цитохромы
Обнаружены в 1886г. Мак-Мунном, исследованы в 1925г. Девидом Кейлином.
Цитохромы (Ц)- это сложные белки-гемопротеины, которые в качестве простетической группы содержат гем
Известно около 30 различных Ц.
Цитохромы имеют особенности:
Железо в Ц способно изменять свою степень окисления, поэтому Ц в ЦПЭ транспортируют только ē.
Fe 3+ +ē Fe 2+

 -ē
-ē
В транспорте двух ē принимают участие две молекулы каждого вида цитохромов, так как одна молекула может переносить только один ē.
III комплекс Q Н2-дегидрогеназа
|
|
|
III комплекс включает 2 типа Ц: в, с1 и FeS.
ē передаются от Ц в на FeS-центры, затем на Ц с1 и на Ц с. Одновременно с комплекса протоны Н+ переносятся в ММП.
Цитохром С - периферический водорастворимый мембранный белок, имеющий одну полипептидную цепь из 100 аминокислотных остатков и молекулу гема, ковалентно связанную с полипептидом. От Ц с ē переносятся на IV комплекс.
IV комплекс- цитохромоксидаза
В IV комплекс входят два цитохрома а и а3, каждый из которых имеет центр связывания с кислородом.
В комплексе содержатся 2 иона меди.
С комплекса протоны Н+ переносятся в ММП.
IV комплекс транспортирует ē непосредственно на молекулярный кислород, активируя его:

 аа3 ½ О2 О
аа3 ½ О2 О
У активированного О2 появляются две свободные валентности, к которым присоединяются 2 протона Н+, поступающие из матрикса. Это приводит к образованию Н2О.
V комплекс – АТФ-синтаза
АТФ-синтаза состоит из двух белковых субъединиц.
Гидрофобная - F0 погружена в мембрану.
Функция – каналообразующая, по ней протоны переносятся в матрикс.
Субъединица F1 выступает в матрикс.
Функция – каталитическая, используя энергию протонов, синтезирует АТФ.
|
|
|
|
Дата добавления: 2018-10-26; просмотров: 726; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
