Свойства жирнокислотных собирателей.
Для карбоксильной группы характерно существование нескольких резонансных структур. Анион также можно рассматривать как гибрид двух резонансных структур, при этом делокализация отрицательного заряда между двумя атомами кислорода делает ион стабильным.
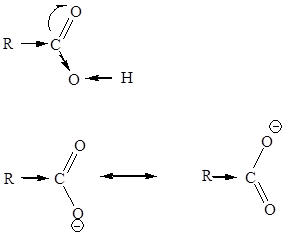
Трудно изучать высшие жирные кислоты ввиду трудности синтеза или выделения индивидуальных соединений. Кроме того, они образуют коллоидные растворы. Подвижность большого аниона очень мала, поэтому равновесие в водных растворах наступает крайне медленно. О некоторых свойствах высших жирных кислот судят по свойствах их низших гомологов.
Так, установлено, что в твердом и жидком состоянии жирные кислоты существуют в виде димеров циклической структуры.
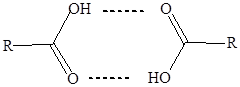
Наличием димеров, образованных за счет водородных связей, объясняются высокие температуры кипения и плавления кислот, по сравнению с углеводородами той же молекулярной массы и строения. В водных растворах молекулы жирных кислот сольватированы молекулами воды, при этом образуются ассоциаты посредством водородных связей. Однако, чем выше углеводородный радикал и выше степень разветвления, тем меньше растворимость.
Физико-химические и флотационные свойства карбоновых кислот зависят от числа карбоксильных групп, их положения в молекуле, величины и строения углеводородного радикала. Свойства кислот различных гомологических рядов отличаются. Кислоты взаимодействуют с щелочью или содой (медленнее) и образуют мыла.
|
|
|

По своим свойствам мыла отличаются от кислот. Все мыла твердые вещества (даже если исходная кислотва была жидкой). Соли обладают ионным характером, растворимы в воде (всегда). Растворимость в воде солей также уменьшается с увеличением углеводородного радикала. Для кислот это уменьшение более резко. Растворение кислот идет следующим образом:
- гидратация димеров по месту водородной связи с последующим отрывом димера от общего объема кислот, что характерно для первых членов гомологического ряда;
- разрыв водородной связи в димере вследствие гидратации карбоксильной группы;
- разрыв связи О-Н в карбоксиле кислоты с образованием протона Н+ и аниона RCOO-;
- перевод в объем раствора образовавшихся анионов.
Энергетический вклад первых двух этапов для всех членов гомологического ряда прмерно одинаков. Энергия третьего этапа – разрыв связи О-Н и удаление протона в объем раствора будет, по-видимому, возрастать с увеличением молекулярной массы кислот. Энергия четвертого этапа, необходимая для преодаления сил В-д-В, поэтому возрастает с увеличением углеводородного радикала.
Огромное влияние водородной связи на растворение только карбоновых кислот. При переводе кислоты в мыло разрывается водородная связь и увеличивается растворимость соединения. Так, растворимость мыл с С11-С18 выше растворимости соответсвующих кислот в 100-40 раз. При растворении мыл энергия затрачивается в основном на преодоление сил В-д-В межмолекулярного взаимодействия углеводородных радикалов.
|
|
|
Диссоциация в водных растворах. Константы диссоциации карбоновых кислот показывают (порядка 10-5), что эти кислоты очень слабые, слабодиссоциированые. Однако,данные о значении констант диссоциации у разных авторов сильно отличаются. По другим данным рКа=10.9 для олеиновой, 1,9 для пальмитиновой 11,0 для линолевой, 11,5 для линоленовой.
Знание констант диссоциации позволяет рассчитать содержание той или иной ионной или молекулярной формы соединения при различных значениях рН. Так, например. Для олеиновой кислоты (если Ка=1,25*10-6) при рН=5,5 50% олеата присутствует в ионной форме. Однако надо помнить, что подобные рассчеты являются приблизительными, т.к. константы диссоциации жирных кислот определить трудно, а также, в расчете не учитывается присутствие других ионов (т.е. иона сила).
Увеличение длины углеводородного радикала несколько снижает ее кислотность, т.к. углеводородный радикал обладает положительным индуктивным эффектом, чем длиннее, тем больше значение. Строение радикала сильно влияет на физико-химические свойства жирных кислот. При увеличении R увеличивается температура кипения, плавления. Наличие двойной связи или гидроксильной групп снижает температуру плавления. Смеси кислот различного строения имеют более низкие температуры плавления, чем индивидуальные кислоты (в этом предпочтительность применения смесей кислот). Температура замерзания – важная техническая характеристика флотационных реагентов.
|
|
|
Кислотные свойства карбоновых кислот усиливаются при введении в углеводородный радикал в α,β-положения к карбоксильной группе электроотрицательных заместителей (с отрицательным индуктивным эффектом).
Устойчивость продуктов диссоциации зависит от рН среды и природы катиона.
Растворы щелочных мыл карбоновых кислот всегда гидролизованы и имеют щелочную реакцию.
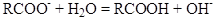
Аналогично для мыл щелочноземельных металлов. (Когда константа диссоциации кислоты много меньше константы диссоциации основания).
Тогда константа гидролиза: 
Если рассматривать гидролиз солей карбоновых кислот и железа или алюминия (когда константа диссоциации основания значительно меньше константы дисоциации кислоты):
|
|
|

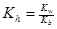
Если константы диссоциации кислоты и основания сравнимы (случай аммониевой соли карбоновых кислот):
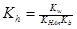
Из реакции гидролиза видно, что регулируя рН среды можно влиять на гидролиз, а следовательно, и на устойчивость мыл, закрепленных на минерале.
Форма реагента в жидкой фазе пульпы зависит от рН среды и оказывает большое влияние на флотационную активность собирателя.
Для одновалентного собирателя:
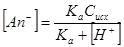 .
.
При известной исходной концентрации собирателя в жидкой фазе пульпы (моль/л) и известном значении рН легко рассчитать концентрацию ионной формы собирателя.
Обычно флотация оксигидрильными собирателями осуществляется при рН>7. При этих условиях оксигидрильные собиратели, в том числе и карбоновые кислоты, находятся в ионной форме.
Свойство коллоидных водных растворов мыл жирных кислот образовывать мицеллы также оказывает влияние на флотационный процесс. Строение мицеллы таково, что углеводородные радикалы обращены внутрь ее, а полярные группы наружу. Тем самым, поверхность мицеллы получает отрицательный заряд и гидрофильность. Такая мицелла, закрепляясь на поверхности минерала, препятствует закреплению пузырьков воздуха и способствует гидратации поверхности. Связь ККМ со строением молекулы уже упоминалась. Однако, достигается ли значение ККМ во флотационном процессе? Если используемые концентрации реагента таковы, что ККМ в процессе не достигается, то говорить об отрицательном влиянии не стоит. Наоборот, опыт показывает, если меньше значение ККМ, значит, более поверхностноактивно соединение, тем лучшие гидрофобизующие свойства оно проявляет. ККМ олеата натрия при 250С 1-1,2*10-4 моль/л, олеата калия – 9,5 *10-4 моль/л.
Определяющее значение для ККМ играет величина углеводородного радикала, но влияют и наличие ненасыщенных связей, разветвление, наличие заместителей в радикале. Увеличение длины углеводородной цепи пи переходе к следующему члену гомологического ряда снижает значение ККМ на треть.
При числе атомов в радикале более 12 межмолекулярное взаимодействие приводит к снмижению флотационной активности кислот нормального строения. Поэтому парафиновые кислоты с С>12 находят малое применение при флотации. Повышение флотационной активности парафиновых кислот с С>12 возможно при условии снижения межмолекулярного взаимодействия.
У первых членов гомологическоно ряда энергия межмолекулярного взаимодействия не велика, намного меньше энергии гидратации карбоксильной группы. Поэтому высока рстворимость этих кислот в воде. Увеличение межмолекулярного взаимодейсвтия приводит к уменьшению растворимости. Растворы ПАВ при низких концентрациях являются истинными. Выше ККМ в объеме раствора образуются агрегаты – мицеллы. Концентрация в растворе молекулярной или ионой формы при ККМ остается постоянной. Поэтому ККМ можно рассматривать как предельную истинную растворимость молекул, превышение которой приводит к образованию новой фазы.
Агрегирование ПАВ в мицеллах идет по углеводородному радикалу. Гидрофобные цепи вытесняются из воды в ядро мицеллы, аналогично тому, как они вытесняются из воды в воздушную фазу при образовании адсорбционного слоя на границе раздела фаз. Наименьшее расстояние между осями углеводородных цепей в мицелле равно приблизительно 5*10-10 м и соответсвует расстоянию наибольшего сближения между двумя молекулами при плотной упаковке молекул.
Растворы ПАВ выше ККМ обладают повышенной вязкостью, что приводит к гелеобразованию.
В настоящее время установлено, что форма и размер мицелл зависят от концентрации и темпратуры растовора, молекулярной структуры ПАВ и т.д.
Считается, что повышение температуры вызывает дезагрегирование мицелл в растворах ПАВ. При этом ККМ должна резко повышаться. В действиятельсти картина сложнее. В ряде случаев ККМ в широком интервале температур оказывается практически постоянной, что соотиветствует малым теплотам мицеллообразования. Такая картина наблюдается для натриевых мыл предельных кислот, начиная с лауриновой.
Уменьшение свободной энергии, обусловленное агрегацией углеводородных цепей, и электростатическое отталкивание диссоциированных полярных групп при мицеллообразовании являются главными факторами.
Одновалентные длинноцепочесные мыла щелочных металлов дисоциируют в воде полностью. Небольшие отличия в гидратации и во влиянии неэлектрической составляющей неионогенных групп и их ионных радиусов отражаются на ККМ в малой степени. Поэтому электирическая работа при мицеллообразовании мыл щелочных металлов одинакова.
Для рядов органических элктролитов с неразветвленной цепью (жирные кислоты, алкилсульфаты и алкилсульфонаты и т.п.) зависимость ККМ от числа атомов углерода в радикале описвывается уравнением прямой. Для ионогеных веществ с одной полярной группой и при одинаковой длине углеводородного радикала ККМ близки. Таким образом, склонность иоогенных ПАВ к мицеллообразованию зависит от ряда причин: природы ионогеной группы и их числа, концентрации противоионов, рН, от котоой зависит степень диссоциации, величины и структуры углеводородного радикала.
Флотационные свойства
Соли щелочных металлов жирных кислот растворимые в воде соединения. Однако, как соли слабой кислоты и сильных оснований – подвергаются гидролизу. В щелочной среде гидролиз мыл жирных кислот подавляется. Соли щелочноземельных металлов – труднорастворимые соединения. С одной стороны соли жесткости отрицательно влияют на флотацию. С другой стороны, считается, что образование труднорастворимых соединений на поверхности минерала способствует эффективному флотационному процессу. И минералы, содержащие ионы кальция, магния, бария хорошо флотируются жирнокислотным собирателем. Возможно, вблизи поверхности минерала концентрация собирателя такова, что начинает идти процесс мицеллообразования, что мешает гидрофобизации минерала. Поэтому в практике флотации применяют смеси жирных кислот, которые более растворимы и менее склонны к мицеллообразованию. Часто жирные кислоты дозируются в процесс в растворе керосина, что также препятствует мицеллообразованию. Молекулы углеводорода при этом, сорбиуясь совместно с карбоксильным собирателем на гидрофобных радикалах, усиливают эффективность действия и снижают пенообразование.
Существует и другая точка зрения. Склонность к мицеллообразованию говорит о хорошей способности соединений к структурированию, а, следовательно, к большей гидрофобизации поверхности минерала.
Карбоксильные собиратели могут быть и пенообразователями. Эта особенность не всегда является преимуществом, так как оптимальные концентрации для собирательного и пенообразующего действия могут быть различными и это внесет затруднения в регулирование процесса флотации. При значительных расходах карбоксильных собирателей в оборотных флотационных продуктах технологической схемы флотации, в желобах, насосных зумпфах и сгустителях накапливаются большие объемы пены, затрудняющие транспортирование и обезвоживание флотационных продуктов.
Действие карбоксильных собирателей зависит от щелочности пульпы. В достаточно щелочных пульпах органические кислоты омыляются и действуют как мыла. Действие же последних ввиду их более высокой растворимости и повышенной ионизации может оказаться более эффективным. При применении олеиновой кислоты и олеата натрия в пульпе всегда присутствуют как недиссоциированные молекулы этих соединений, так и свободные ионы олеата. В. Г. Даниловым установлено, что при обычных расходах карбоксильных собирателей и при рН<11 концентрация олеат-ионов в пульпе практически не зависит от расхода собирателя и определяется в основном рН среды. Можно считать, что органическая кислота (например, олеиновая) в щелочной среде взаимодействует с минералами в основном в ионной форме, а в кислой среде—в молекулярной форме.
Активное взаимодействие ионов карбоксильных собирателей с присутствующими в воде кальциевыми и магниевыми солями жесткости, переводит анионы собирателей в нерастворимый осадок и таким образом выводит из строя часть собирателя. Это приводит иногда к резкому повышению расхода собирателей и вызывает значительные осложнения в технологии. В отдельных случаях необходимо умягчить воду перед флотацией. Ионы тяжелых металлов также связывают собиратель.
Современное состояние теории адсорбционных процессов позволяет считать, что как молекулы, так и ионы карбоксильных собирателей могут закрепляться на минералах путем физической и химической адсорбции. Физическая адсорбция ионов может происходить под действием сил кулоновского притяжения, а молекул - под влиянием сил дипольного взаимодействия и водородной связи. Химическое закрепление ионов осуществляется обычным порядком — в результате электронных переходов от анионов собирателя к катионам кристаллической решетки минерала. Представляется возможным физическую адсорбцию рассматриватькак подготовительный этап к хемосорбционному закреплению.
С. И. Полькиным установлена возможность образования полислойных адсорбционных покрытий олеат-ионами до 20 и более условных монослоев.
Вероятно, образуется целый ряд химических соединений аниона карбоксильного собирателя с катионом минерала. Установлено, что адсорбционный слой на поверхности минералов в общем случае представлен хемосорбционным покрытием, образованным химически закрепленными на минерале анионами собирателя (например, олеата), над которым располагаются нормальные или замещенные олеаты металла, физически адсорбированные молекулы олеиновой кислоты и олеата натрия. Ионный характер кристаллической решетки большинства несульфидных минералов, при флотации, которых в качестве собирателей применяют карбоксильные реагенты, предопределяет возможность адсорбции на их поверхности гидроксильных или водородных ионов, которые могут конкурировать в борьбе за поверхность минерала. Это принципиально важное. В зависимости от соотношения концентраций ионов собирателя и гидроксила или молекул собирателя и водородных ионов результаты адсорбции собирателя и гидрофобизации могут быть различными. Таким образом, увеличение адсорбции минералом водородных ионов можно связать с соответствующим уменьшением адсорбции им олеиновой кислоты в этих условиях.
Влияние структуры радикала на активность собирателя.
Увеличение расстояния между молекулами собирателя может происходить вследствие разветвления или ненасыщенности углеводородного радикала в цис-форме (тем самым уменьшается межмолекулярное взаимодействие), и при замещении водорода в радикале на бензольное кольцо. ККМ и растворимость возрастают, если в радикале имеется разветвление, циклические или ароматические кольца, ненасыщенность или другие полярные группы. Чем ближе полярная группа сдвинута к центру цепи, тем выше ККМ содинения (на примере алкилсульфанатов).
Олеиновая кислота – цис-изомер.

Она короче по длине, чем транс-изомер – эландиновая.

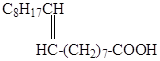
Эландинова кислота имеет примерно такую же длину (24*10-10м), как и насыщенная стеариновая. Олеиновая имеет длину 21,6*10-10м.
Наличие двойных связей имеет большое значение. Увеличивается сила кислот (если двойная связь рядом с карбоксилом), увеличивается растворимость. Увеличение числа двойных связей в молекуле приводит к снижению температур плавления: стеариновая – 69.6 0С, олеиновая – 1,4-16,8 0С, линолевая – 6 0С, линоленовая -10-110С.
Изучено влияние пространственной изомерии на примере флотации кварца, активированного кальцием и гематита. Установлено, что флотационная активность натриевого мыла олеиновой кислоты и эландиновой бизка в широком интервале температур от 25 до 700С. С увеличением ненасыщенности флотационная активность кислот по отношению вк кварцу и гематиту растет: стеариновая< эландиновая< олеинова< линолевая< линоленовая. Одновременно падает селективность собирателей.
При наличии разветвления в радикале площадь сечения молекулы также увеличивается. Т.е. молекулы удалены друг от друга более чем на 0,5 *10-10 м. В результате энергия межмолекулярного взаимодействия уменьшается в 10-33 раза, что отражается и на температуре плавления. У изокислот изменяются не только физические, но и химические свойства – сила кислот, растворимость и т.д. Изучение собирательных свойств индивидуальных изокислот состава С15-С18 показало, что при флотации апатита кислоты изостроения действительно обладают более высокой флотационной активностью, но характеризуются при этом меньшей избирательностью действия по сравнению с нормальными кислотами того же состава.
Выявленная более высокая флотоактивность разветвленных карбоновых кислот по сравнению с кислотами нормального строения объяснялась авторами значительными стерическими эффектами, препятствующими межмолекулярному взаимодействию углеводородных радикалов в растворе и большей предельной площадью, занимаемой молекулой на границе раздела фаз.
Было установлено, что по отношению к фосфатным рудам собирательная способность ненасыщенных карбоновых кислот с 18 атомами углерода в цепочке понижается в порядке: линолевая, олеиновая, линоленовая, стеариновая.
Изучение собирательной и адсорбционной способности того же набора непредельных кислот проводилось с помощью меченых собирателей на примере флотации чистых минералов - гематита и активированного кварца. По мнению авторов, несмотря на большую растворимость и меньшую гидролизуемость жирных кислот с большим числом двойных связей, окончательный эффект гидрофобизации поверхности минерала складывается из множества факторов. Так, следует учитывать, что рост числа ненасыщенных связей в углеводородной цепочке собирателя увеличивает взаимодействие неполярной части молекулы с водой, т.е. она становится более гидрофильной. Так же увеличивается площадь поверхности минерала, занимаемая молекулой собирателя. Эксперименты, проведенные авторами, показали, что для активированного кальцием кварца рост числа двойных связей приводит к увеличению флотационного действия собирателя.
Другим способом увеличения флотационной активности карбоновых кислот может быть введение в углеводородный радикал электроноакцепторного заместителя. Наличие в молекуле электроотрицательной группировки или атома приведет к усилению кислотных свойств карбоксильной группы, улучшению растворимости рассматриваемых соединений, а также повышению значений критической концентрации мицеллообразования.
Так, вследствие отрицательного индуктивного эффекта, возникающего при введении одного или двух атомов хлора в a-положение к карбоксильной группе, увеличивается константа диссоциации по сравнению с аналогичными незамещенными кислотами. Это приводит к более прочному взаимодействию с поверхностью минералов, а, следовательно, к снижению расхода собирателя. Предложенные в качестве коллекторов для несульфидных руд a-хлор-a-алкил-, a,a-дихлоркарбоновые кислоты с величиной углеводородного радикала от С3 до С21 обладают более высокими собирательными свойствами по сравнению со своими незамещенными аналогами.
Известно использование в качестве собирателей для флотации нитро- и алкилнитрокарбоновых кислот, в которых выступающая в качестве заместителя нитрогруппа обладает сильным отрицательным индуктивным эффектом.
Влияние широкого ряда электроотрицательных заместителей на флотационные свойства синтетических жирных кислот было рассмотрено в работах Рябого В.И., Янис Н.А. и др. Для исследования авторами были выбраны производные пальмитиновой кислоты, входящей в состав промышленно доступных фракций синтетических жирных кислот (СЖК). Флотационными опытами на вольфрамите, касситерите, кальците и гематите была дана сравнительная оценка собирательной способности пальмитиновой, меркапто-, бром-, сульфо-, окси-, амино- пальмитиновых кислот, хлорированных кислот фракций С10-С16 и олеиновой кислоты. На основании полученных результатов авторами был сделан вывод, что для большинства минералов бром-, хлор- и меркапто- пальмитиновые кислоты являются более сильными собирателями, чем незамещенная пальмитиновая кислота, а в ряде случаев превосходят по собирательному действию олеиновую кислоту. В то же время сульфо-, окси- и амино- пальмитиновые кислоты проявляют более слабые собирательные свойства, чем пальмитиновая кислота.
Обобщая полученные результаты, исследователи заключают, что изменение собирательных свойств и селективности действия замещенных карбоновых кислот можно связать с характером заместителя и с различием в их кислотных свойствах. В тех случаях, когда заместитель увеличивает кислотные свойства соединения, а сам с водой не взаимодействует (хлор, бром) или взаимодействует слабо (меркаптогруппа), соединение является сильным собирателем. Если же заместитель усиливает гидрофильность соединения и закрепление реагента способствует гидрофилизации поверхности минерала (амино-, сульфо- и оксигруппы), соединение является слабым собирателем. Исключение составляют случаи, когда заместитель принимает участие в образовании дополнительной связи с поверхностью минерала, например, флотация барита сульфопальмитиновой кислотой.
Результаты, полученные приизучении N-ацилированых аминокислот, показали, что собирательная способность рассматриваемых кислот зависит не только от величины и структуры алкильного радикала, но и от расстояния между карбоксильной и амидной группировками. Наибольшей флотоактивностью из перечисленных кислот характеризуются кислоты с углеводородным радикалом С17, содержащим непредельную связь, и расстоянием между функциональными группами 1-2 атома углерода (N-олеилглицин, N-олеилаланин). Значительное увеличение этого расстояния в ряду N-олеиламинокислот приводит к снижению флотационной активности.
Рассмотренный класс N-ацилированных аминокислот, обладающих высокой селективностью действия при недостаточной флотационной активности, представляет интерес при обогащении фосфорсодержащих руд сложного минералогического состава. Однако, высокая стоимость аминокислот, а также использование в качестве сырья жирнокислотной фракции таллового масла сдерживает производство реагентов такого типа.
Применение в качестве собирателей сульфатированных жирнокислотных реагентов позволяет получать высокие технологические показатели флотации фосфатов при более низких, чем у традиционных реагентов, удельных расходах.
При изучении механизма действия сульфированной олеиновой кислоты было установлено, что факторами для улучшения собирательных свойств подобного собирателя по отношению к апатиту являются эффективная ориентация гидрофобных радикалов, преобладающая адсорбция сульфатированного реагента на апатите по сравнению с карбонатными минералами и упрочение связи реагент-минерал.
В качестве собирателя для флотации апатито-нефелиновой руды испытывался так же продукт окисления твердых и мягких парафинов Шебекинского химкомбината, представляющий собой смесь полифункциональных кислот. Полученные результаты показали, что полифункциональные кислоты - селективный и эффективный собиратель при флотации апатита.
Моноамидные производные дикарбоновых кислот также нашли применение в процессах обогащения. В виде добавок к жирнокислотным собирателям предложено использовать моноамиды ортофталевой кислоты. Алкилмоноамиды алкил-(алкенил)янтарных кислот, оба радикала в которых содержат от 8 до 12 атомов углерода были рассмотрены как собиратели для флотации фосфатных руд .Эфиры дикарбоновых кислот и моноалканоламидов, полученные на основе малоновой, янтарной, глутаровой, адипиновой и итаконовой кислот использовались как самостоятельные собиратели, так и в смеси с жирными кислотами.
Сульфоксильные собиратели.
Реагенты с кислотным остатком серной кислоты (сульфоксильные собиратели). Эти реагенты являются органическими производными серной кислоты.
В случае замещения одной из групп ОН в молекуле серной кислоты получаются соединения с общей формулой называемые сульфокислотами. Соли сульфокислот (чаще всего натриевые) называют сульфонатами и в зависимости от принадлежности углеводородного радикала к алифатическому или ароматическому ряду их называют алкил-, арил- или алкиларилсульфонатами. Сульфонаты обладают слабым собирательным, но более сильным пенообразующим действием. Если же один из водородных атомов серной кислоты заменить органическим радикалом R, а другой водород заменить металлом (чаще всего натрием), то получим другие производные серной кислоты, называемые алкилсульфатами (если радикал принадлежит к алифатическому ряду углеводородов
Таким образом, в сульфонатах органический радикал соединен непосредственно с серой, а в алкилсульфатах - через атом кислорода. Алкилсульфаты обладают высокой поверхностной активностью и относятся к категории моющих средств. Так, в известном синтетическом моющем средстве «Новость» содержится около 40 % алкилсульфатов (остальные 40—50 % приходятся на сульфат натрия и другие инградиенты). Другое моющее средство «Прогресс» также может применяться в качестве собирателя. Его выпускают в виде концентрированного водного раствора, содержащего не менее 20 % алкилсульфатов. Алкилсульфаты получают в результате сульфирования некоторых животных жиров, углеводородов нефти (например, олефинов Се—Cie), хорошо растворимых в воде. Их часто применяют в сочетании с омыленной олеиновой кислотой и талловым маслом. Cледует иметь в виду, что как алкилсульфонаты, так и, алкилсульфаты склонны к мицеллообразованию. Одним из достоинств алкилсульфатов является их нечувствительность к жесткой воде. Алкилсульфаты получают все более широкое применение. Их используют, например, при селективной флотации окисленных минералов со щелочноземельными катионами, Известно применение этих реагентов для флотации барита из шеелитовых концентратов; при обогащении вольфрамовых руд для извлечения вольфрамсодержащих минералов, из шламовых фракций гравитационного обогащения. В слабокислой среде (рН=6,8) применение алкилсульфата позволяет выделить в пенный продукт флюорите концентрацией в камерном продукте касситерита. С применением алкилсульфата успешно разделяют флюорит (с переводом его в пенный продукт) от вольфрамовых минералов.
Сульфгидрильные собиратели.
К основным сульфгидрильным собирателям относятся:
Органические производные тиоугольной кислоты (ксантогенаты):

Органические производные дитиофосфорной кислоты (дитиофосфаты) - аэрофлоты:

Органические производные дитиокарбаминовой кислоты (дитиокарбамата):

Органические производные сероводорода (меркаптаны и тиофены): RSH.
Ксантогенаты.
Ксантогенаты щелочных металлов имеют наибольше для практики значение. Это учтойчивые, хорошо растворимые в воде соединения, обладают собирательной спосбностью по отношению к самородным металлам и сульфидам тяжелых металлов, на поверхности которых образуются труднорастворимые ксантогенатные соединения.
Растворимость ксантогенатов убывает в следующем порядке: ZnKx2>PbKx2>CuKx>AgKx.
Уменьшение раствормлсти ксантогенатов улучшает флотируемость минерала, поэтому ряд флотируемости минералов обратный: ZnS<PbS<Cu2S<Ag2S.
Количество атомов серы в полярной группе ксантогената влияет на его связь с катионом минерала. Увеличение углеводородной цепи уменьшает растворимость и увеличивает флотационную активность. Свертывание углеводородной цепи в кольцо – снижает гидрофобизующе действие. Разветвление цепи при большом числе атомов углерода усиливает гидрофобизацию. Селективность уменьшается при увеличении длины цепи.
Ксантогенаты – соли ксантогеновой кислоты:
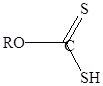
Ксантогеновые кислоты неустойчивы, даже при относительно низкой температуре (250С) разлагаются:

Константа диссоциации ксантогеновых кислот около 3*10-2.
Ксантогенаты металлов – устойчивые соединения. Это твердые вещества, с небольшим запахом. Используемые в практике флотации ксантогенаты – это в основном калийные, реже натриевые соли.
Методом молекулярных орбиталей рассчитано распределение электронной плотности в ксантогенате:
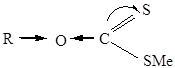
Стабильность ксантогенатов зависит от рН, длины и строения радикала, исходной концентрации, ионного состава раствора. Свежие растворы ксантогенатов – нейтральны и довольно устойчивы (ксантогеновые кислоты – достаточно сильные). Ксантогенаты в нейтральной и щелочной средах полностью диссоциируютна ионы
и со временем гидролизуются. Более концентрированные растворы – более устойчивы во времени. С увеличением углеводродного радикала устойчивость ксантогенатов также увеличивается.

В слабокислой среде ксантогенаты также гидролизуются (рН=4-7).
В более кислой среде, при рН<4, ксантогенаты начинают разлагаться под действием воды с образованием исходных веществ – спирта, сероуглерода и щелочи.
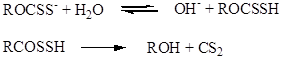 .
.
При рН =4,3 в течение 1 часа разлагается 50% ксантогената (рассчитано по значениям скоростей реакций).
Поэтому при флотации в слабокислой среде подавать ксантогенаты лучше порциями, а в сильнокислой среде ксантогенаты не эффективны.
Ксантогенаты могут окисляться до диксантенида:

Первая стадия – получение самой ксантогеновой кислоты. Скоростьлимитирующей является вторая стадия.
Скорость процесса окисления кислородом воздуха в объеме раствора невысока. Увеличивается в присутствии растворенной углекислоты воздуха, в растворах соды и извести и резко возрастает в присутствии металлической, сульфидной поверхности, ионов некоторых металлов.
Предполагается, что окисление ксантогената до диксантогенида на поверхности сульфидных минералов осуществляется хемосорбированным кислородом без участия катионов минерала. Роль минерала сводится к тому, чтобы сделать более вероятным электоронный обмен между ксантогенатом и кислородом. Реакция окисления-восстановления ксантогената на минеральной поерхности играет большую роль в процессе гидрофобизаци и флотации минеральных частиц. Учитывая обратимость реакции ксантогенат - диксантогенид не имеет принципиального значения в каком виде загружается собиратель. Интенсивность процесса окисления растворов ксантогенатов щелочных металлов уменьшается при введении Na2S.
Окислению подвергаются и ксантогенаты тяжелых металлов – Fe (III), Pb и т.д.
Ионы ксантогената в водных растворах активно взаимодействуют с катионами тяжелых металлов с образованием труднорастворимых соединений (Cu, Ni). Наиболее труднорастворимые ксантогенаты – флотируются при рН 4-7.
Более растворимые – экстрагируются при рН 4-9, что используется в аналитической химии. Самые растворимые – разлагаются с образованием ОН- при рН≥7.
Растворимые комплексы Pb (Kx)2, Ni(Kx)3-, Co(Kx)3-
При изучении труднорастворимых ксантогенатов был сделан вывод, что произведение растворимости является линейной функцией от числа m –СН2- групп для данного гомологичекого ряда: 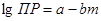 .
.
При взаимодействии ксантогенатов с фосгеном в водной среде образуются тиоангидриды ксантогентовых кислот с общей формулой:
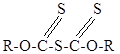
Маслянистые жидкости. Тиоангидриды оказались весьма эффективыми реагентами для цементной меди, молибденита, самородной меди и благородных металлов, сульфидов меди.
При взаимодействии ксантогенатов с галогеналканами образуются эфиры ксантогеновых кислот:
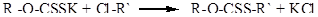
Это маслянистые жидкости, почти не растворимые в воде. Более слабый собиратель сульфидов цинка, меди и свинца. Однако эти эфиры более эффективные собиратели молебденита.
При взаимодействии ксантогенатов и алифатических аимнов получаются диалкилтионокарбаматы, с общей структурной формулой:
R-O-CS-NH-R`.
Обладают сильным собирательным свойством на медные минералы и активированный сфалерит.
Диалкилдитиофосфаты – аэрофлоты.
Имеют наряду с ксантогенатами максимальное промышленное значение среди сульфгидрильных собирателей. Наиболее используемые – крезиловый, ксиленоловый и бутиловый.
Аэрофлоты представляют собой тиопроизводные эфиров диалкилфосфоновых кислот, в которых атомы кислорода заменены на атомы серы:

В дитиофосфатах цетральный атом фосфора сильнее смещает электронное облако серы по направлению к центру, чем углерод в молекуле ксантогената. Поэтому связь серы с металлом слабее, что является причиной увеличения растворимости дитиофосфоновых солей.

Это легколетучие жидкости, пахнущие сероводородом. Титруются как одноосновные кислоты. При попадании в них воды выделяются вредные газы:
(RO)2PSSH + H2O = (RO)2PSOH + H2S,
поэтому их применяют в виде солей.
Дитиофосфаты более устойчивы в кислых средах и окисляются труднее, чем ксантогенаты. В кислой среде окисляются до дисульфидов.
Дитиофосфаты обладают более слабыми собирательными свойствами, чем ксантогенаты, но они более селективны при флотации сульфидов меди в присутствии цинковых и железных сульфидов.
Жидкие дитиофосфаты содержат некоторое количество крезола, поэтому обладаютеще и пенообразующими свойстваи. В водных растворах аналогично ксантогенатам образуют труднорастворимые соединения с ионами тяжелых металлов. Однако ПР для этих соединений на 3-4 порядка выше, чем ПР ксантогенатов.
Гидролизованные аэрофлоты – сочетания моно- и дитиофосфатов. Оказывают сильное собирательное действие на медные минералы, сфалерит. Более селективные собиратели. Получаются в результате гидролиза аэрофлотов:
(RO)2PSSH + H2O = (RO)2PSOH + H2S.
Дитиокарбаматы
Органические производные дитиокарбаминовой кислоты – дитиокарбаматы – болдее сильные собиратели для сульфидов, чем ксантогенаты, но дороги не нашли широкого применения. Получаются при взаимодействии сероуглерода с аминами.
Если в реакцию вступает первичный амин, то образуются моноалкилдитиокарбаматы – неустойчивые соединения:
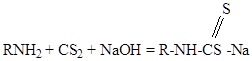
Если в реакцию вступают вторичные амины, образуются диалкилдитиокарбаматы, являющиеся более устойчивыми соединениями:
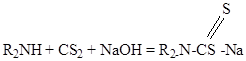
Соли щелочных металлов дитиокарбаматов более устойчивые соединения, чем ксантогенаты.
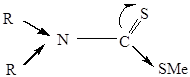
Химические свойства дитиокарбаматованалогичны свойствам ксантогенатов. Как и ксантогенаты легко гидролизуются и окисляются до дитиокарбамидов:

. Также образуют труднорастворимые соединения с ионами тяжелых металлов. ПР труднорастворимых соединений дитиокарбаматов много меньше соотвествующих значений ПР ксантогенатов.
Механизм собирательного действия аналогичен механизму действия ксантогенатов.
Органические производные сероводорода – меркаптаны и тиофенолы обладают сильными собирательными свойствами по отношению к сульфидам, обладают неприятным запахом. Образуют с оксидами тяжелых металлов меркаптиды – малорастворимые соли.
Окисляются с образовием дисульфидов:
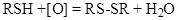 .
.
Меркаптаны обладают килотными свойствами, что позволяет им присоединяться к решетке минерала.
Основными собирателями для флотации цветных металлов используют ксантогенаты и дитиофосфаты. Остальные используют в качестве добавок к основным собирателям.
Механизм действия сульфгидрильных собирателей.
Результаты исследований показали, что при адсорбции из растворов сорбционный слой ксантогената на поверхности различных сульфидов представлен 2 а то и 3 формами закрепления. Первый монослой ксантогената, закрепившегося на поверхности сульфида является хемосорбционым. Дальше слой нормального или полного ксантогената, третий – продукт окисления молекулы - диксантогенид.
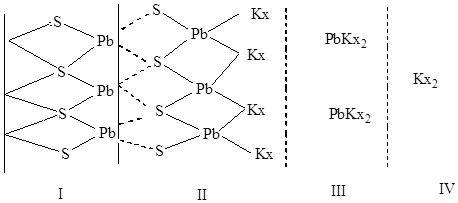
I – неизмененный сульфид
II – сульфидоксантогенат
III – ксантогенат свинца
IV- диксантогенид
Различные модели действия ксантогенатов, предложенные разнвми исследователями, отражали, как правило, одну из форм адсорбции. Так, теория Хаггарта – флотация обусловлена протеканием гетерогенной химической реакции обменного типа с образованием труднорастворимых ксантогенатов соответствующих металлов. Однако, с этой точки зрения нельзя объяснить случаи адсорбции и флотации минералов, когда соответствующее произведение растворимости не достигнуто, плохую флотируемость окисленных медных и свинцовых минералов даже при значительном превышении произведения растворимости. Теория не учитывает образование диксатогенидов. Другая гипотеза (Голиков) – основное действие ксантогенатов – очистка поверхности минерала от окисленных пленок, а гидрофобизация поверхности и флотация сульфидов – результат действия смвачивающего дейсвия диксантогенидов, образующихся на поврхности. В этой гипотезе не рассматривается влияние химически закрепившегося собирателя. Теория Шведова – гидрофобизация проходит Зв счет образования сульфидокснтогенатов. Если образуются полные ксантогенаты, то они теряютсвязь с поверхностьюи отслаиваются при механическом воздействии и не оказывают собирательного действия. Предложены также гипотезы ионообменного механизма, гидролитического механизма и др.
Однако, исследования показали, что для успешной флотации необходимо присутствие и химически и физически закрепленного собирателя. Доля каждого из них должна быть не меньше 10-30% общей плотности адсорбции собирателя.
При любой степени окисления поверхности минерала флотационная активность сорбционного слоя, представленного обеими формами закрепления выше флотоактивности одного химически закрепившегося ксантогената.
Закрепление собирателя обусловленоне только способностью полярной группы ксантогената образовывать прочную химическую связь с ионами тяжелых металлов и катионами кристаллической решетки сульфидов, но и способностью аполярной части собирателя к дисперсионному взаимодействию с молекулами диксантогенида.
Роль форм адсорбции собирателей при флотации.
Каждая из форм закрепления собирателя играет свою роль, обусловленную механизмом и кинетикой закрепления минеральной частицы на пузырьке воздуха.
Самопроизвольный разрыв гидратной прослойки при закреплении частицы на пузырьке должен присходить в том случае, когда толщина прослойки достигнет критического значения. Чем больше гидрофобность поверхности частицы, тем при большей толщине гидратной оболочки может призойти самопроизвольный ее разрыв, сопровождающийся прикреплением частицы к пузырьку.
Основной потенциальный барьер при закреплении частицы на пузырьке обусловлен необходимостью уменьшить толщину гидратной прослойки между ними в каком-либо месте до критического значения.
В настоящее время установлено, что физически сорбированный собирателель не растекается по природногидофобной или гидрофобизированной собирателем поверхности минеральных частиц, а образует капельки. При образовании смешанного сорбционого слоя точки химически закрепления служат центрами конденсации физически сорбировнных молекул. Образующиеся на поверхности микрокапельки органических реагетов должны способствовть локальному уменьшению прослойки жидкости между частицей и пузырьком. При достижении критической толщины гидратной оболочки происходит ее разрыв. Локальный разрыв прослойки может сопровождаться переходом части поверхностно-активного вещества из жидкой капли во вновь образующуюся поверхность раздела фаз и быстрым распространением периметра контакта пузырька по гидрофобной поверхнсти твердого. Таким образом, основная роль физичеки сорбированного собирателя заключается в том, чтобы обеспечить эффективный разрыв гидратной прослойки. Гидрофобизация самой поверхности, и создание тем самым условий для распространения по ней трехфазного периметра контакта пузырька является основным назначением химически закрепленного собирателя.. Использование в качестве собирателей полярных реагентов, функциональная группа которых способна к химической фиксации на поверхности минерала, преследует одну цель: нейтрализовать на минеральной поверхности всее те некомпенсированные связи, которые отвественны за взаимодействие ее с диполями воды и приводят к образованию гидратной оболочки. Аполярная часть реагента должна быть такова, чтобы энергия взаимодействия молекул воды с поверхностью минерала, покрытого углеводородными радикалами собирателя, была бы гораздо меньше взаимодействия молекул воды друг с другом, т.е. гидрофобизовать поверхность минерала.
Дата добавления: 2018-10-26; просмотров: 658; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
