ЗАКРЕПЛЕНИЕ РЕАГЕНТОВ В ДВОЙНОМ ЭЛЕКТРИЧЕСКОМ СЛОЕ
На прилипание минеральных частиц к пузырьку газа, связанное с устойчивостью гидратных слоев у поверхности этих частиц, сильное влияние оказывает заряд поверхности. Концентрируясь в двойном электрическом слое, отдельные реагенты могут изменять заряд частицы и тем самым изменять в ту или иную сторону условия прилипания частицы к пузырьку газа.
Общее количество ионов, адсорбирующихся во внешней обкладке двойного слоя, будет зависеть от заряда поверхности минерала, поскольку электрические заряды обеих обкладок должны быть равны, а вся система суммарно электронейтральна. Как указывалось выше, во внешней обкладке могут адсорбироваться любые ионы, независимо от их природы, размера и величины их заряда, определяемого валентностью. Важно только, чтобы они все по своему знаку соответствовали знаку заряда внешней обкладки.
Следовательно, адсорбция ионов во внешней обкладке не может являться избирательной по отношению к минералу. Это обстоятельство важно для правильного понимания действия отдельных реагентов при флотации.
Если в растворе присутствуют ионы различных реагентов и все они по знаку своего заряда могут адсорбироваться во внешней обкладке, то доля ионов каждого типа в их общей адсорбции будет тем больше, чем выше их концентрация в растворе и чем больше энергии будет выделяться в результате их закрепления во внешней обкладке. Таким образом, состав ионов, адсорбированных внешней обкладкой двойного слоя, находится в зависимости от соотношения концентраций ионов, присутствующих в растворе.
|
|
|
По своему характеру закрепление реагентов во внешней обкладке двойного электрического слоя может быть отнесено к группе явлений физической адсорбции, отличающейся неустойчивостью и обратимостью процесса. Ввиду неустойчивого и, обратимого закрепления во внешней обкладке ионов флотационного реагента последние при разбавлении раствора и соответствующего понижения концентрации начнут переходить из внешней обкладки в результате, например, отмывки водой минеральных частиц, предварительно отделенных фильтрацией от жидкой фазы.
Однако в отличие от физической адсорбции недиссоциированных поверхностно-активных органических соединений, где действуют в основном сравнительно слабые силы Ван-дер-Ваальса, в закреплении ионов реагентов во внешней обкладке двойного слоя участвуют электрические силы притяжения и отталкивания между ионами, проявляющиеся на сравнительно больших расстояниях.
Закрепление реагентаво внутренней обкладке двойного слоя (в противоположность внешней обкладке) носит явно выраженный избирательный характер и может быть отнесено к случаям химической адсорбции. Оно происходит и в соответствии с известным правилом Панета — Фаянса. Закрепляясь во внутренней обкладке двойного слоя, ион реагента входит в кристаллическую решетку минерала.
|
|
|
Таким образом, адсорбция ионов во внутренней обкладке двойного слоя зависит от размеров адсорбирующихся ионов и их близости к размеру ионов кристаллической решетки, от структуры и состава поверхностного слоя минерала, растворимости образующихся соединений, что в совокупности приводит к высокой избирательности этой формы закрепления реагентов и имеет большое значение для действия флотационных реагентов. Нельзя, однако, искусственно изолировать процессы адсорбции ионов во внутреннюю и внешнюю обкладки двойного слоя, так как, несмотря на наличие ряда принципиальных различий между ними, они могут быть органически связаны между собой.
ЗАКРЕПЛЕНИЕ РЕАГЕНТОВ НА МИНЕРАЛАХ В ФОРМЕ ПОВЕРХНОСТНЫХ СОЕДИНЕНИЙ
Закрепление реагентов на минералах в форме поверхностных соединений широко распространено и наблюдается при флотации разнообразных полезных ископаемых в самых различных условиях. Было установлено, что поверхностные соединения значительно отличаются от других соединений своими свойствами. Так, в отличие от соединений обычного типа, образовавшихся в объеме раствора, поверхностные соединения не составляют отдельной самостоятельной существующей фазы, поскольку атомы или ионы кристаллической решетки минерала, участвующие в образовании поверхностного соединения, затрачивают на это только часть своей энергии связи и по-прежнему остаются связанными с другими атомами или ионами решетки. Если кристаллическая решетка ионная, то поверхностное соединение образуется в результате присоединения к катиону решетки аниона из раствора (и обратно). При наличии атомной решетки это ограничение естественно не действует.
|
|
|
Важной особенностью поверхностных соединений является также отсутствие стехиометрических отношений ионов или атомов, образующих подобные соединения. Эта особенность поверхностных соединений связана с тем, что входящий в их состав атом или ион представляет собой единое целое со всеми атомами или ионами кристаллической решетки твердого тела, к поверхности которого он присоединился. поэтомуправильнее считать поверхностные соединения не веществами определенного и состава, а своеобразными радикалами, прикрепленными к каким-либо участкам поверхности твердого тела и могущими сосуществовать только с этой поверхностью.
|
|
|
В результате образования того или иного поверхностного соединения увеличивается концентрация определенных элементов или их групп на поверхности раздела фаз. Процесс образования поверхностных соединений с учетом природы действующих при этом сил может быть охарактеризован как хемосорбция со всеми присущими ей особенностями.
На рис. схематически показано поверхностное соединение, образованное ионным кристаллом в среде раствора:
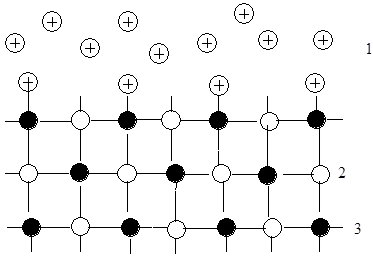
1 – анионы в растворе;
2 – анионы решетки;
3 – катионы решетки.

поверхностное соединение, образованное кристаллом в среде раствора.
Поверхностное соединение угля с кислородом на основе атомной решетки изображено:

Здесь атомы кислорода присоединены к атомам углерода кристаллической решетки угля.
Прочность связи в поверхностных соединениях может быть весьма значительной. Так, адгезия кислорода, хемосорбированного поверхностью вольфрама, настолько велика, что вполне сопоставима с когезией между атомами самого вольфрама, являющегося твердым металлом. Установлено, что кислород хемосорбированный углем при комнатной температуре, может быть выделен с большим трудом и только в составе окиси углерода. Образование поверхностных соединений происходит без разрушения кристаллической решетки минерала, так как энергия последней оказывается в этих случаях более значительной, чем энергия взаимодействия при образовании самого поверхностного соединения. Образование поверхностных химических соединений, так же как и закрепление ионов во внутренней обкладке двойного электрического слоя при ионной адсорбции, осуществляется силами химической связи.
Однако в отличие от поверхностных соединений, переход ионов из раствора во внутреннюю обкладку происходит в тех случаях, когда эти ионы или химически одноименны (т. е. являются теми же ионами, которые образуют кристаллическую решетку минерала) ионам минерала, или близки к ним по своим размерам.
При образованииже поверхностных химических соединений на кристаллической решетке минерала могут закрепляться не только такие ионы, которых нет в составе минерала, но и те, которые значительно отличаются от ионов минерала своими размерами и даже конфигурацией. Например, ионы ксантогената, химически закрепляющиеся на поверхности сульфидов (например, галенита), резко отличаются от ионов в решетке этих минералов своими химическим составом, конфигурацией, а также поперечными и продольными размерами. Так, наибольшие поперечный и продольный размеры иона амилового ксантогената составляют 0,7 и 1,22 нм, в то время как ионные радиусы свинца и серы (по Гольдшмидту) соответственно равны 0,13 и 0,17 нм.
В образовании поверхностного химического соединения на кристалле с ионной или атомной решеткой могут участвовать не только ионы, но также и атомы или молекулы. Подобными соединениями являются, например, соединения кислорода с поверхностью вольфрама и угля.
При переходе из объема на поверхность меняются условия энергообмена, число и характер столкновений, устойчивость и химическая подвижность реагирующих единиц; Теплота активации в хемосорбционном слое сильно снижена по сравнению
с теплотой активации химических реакций в объеме; еще значительнее снижение теплоты активации для самого процесса хемосорбции. Все это ограничивает использование различных констант, характеризующих те или иные объемные реакции для каких-либо количественных построений, относящихся к образованию поверхностных соединений, если хемосорбция не переходит в гетерогенную химическую реакцию. Они могут быть использованы лишь для суждений качественного характера. Так, например, вопрос о применимости закона действующих масс к процессам образования поверхностных соединений является весьма сложным и еще не решен окончательно. Положительное решение этого вопроса трудно согласовать со многими указанными здесь особенностями поверхностных соединений по сравнению с соединениями в объеме (отсутствие стехиометрии у поверхностных соединений и др.). По-видимому, с большей вероятностью о применимости закона действующих масс можно говорить по отношению к тем случаям, когда образование соединений на поверхности может в дальнейшем распространяться в глубь объема твердой фазы, в результате чего образованное соединение уже может трактоваться как объемное. В связи с этим следует иметь в виду часто наблюдающийся при флотации переход хемосорбции в гетерогенную химическую реакцию
Следовательно, нельзя во всех случаях отождествлять процессы образования объемных и поверхностных соединений и тем более сами эти соединения. Теория взаимодействия реагентов с минералами, развитая Таггартом и другими учеными, не смогла преодолеть теоретических трудностей, возникших на основе подобного отождествления.
Следует отметить, что в 30-х годах, когда были сформулированы основные положения этой теории, она сыграла, несомненно, положительную роль, пробудив у обогатителей интерес к химической стороне флотационного процесса и стимулировав многие работы в этом направлении.
Согласно прежним взглядам ученых, закрепление реагента на поверхности минерала, определялось во всех случаях лишь произведением растворимости, точнее, произведением активности образующегося при закреплении соединения, причем произведение растворимости последнего должно быть ниже, чем произведении растворимости самого минерала. Однако экспериментальные данные в ряде случаев не подтверждают этого.
Закрепление флотационных реагентов на поверхности минералов может происходить в ряде случаев, несмотря на то, что произведение растворимости соответствующего соединения реагента с катионом минерала достаточно высоко и превосходит произведение растворимости минерала.
Мицелообразование
Коллоидные поверхностно-активные вещества образуют мицеллы. Мицеллы это - агрегаты из многих молекул, имеющие определенную структуру. Мицеллы образуются при условии, что концентрация ПАВ в растворе достигает определенного для каждого вещества значения концентрации, называемое критической концентрацией мицелообразования (ККМ). Мицелообразование связано со стремлением системы снизить до минимума свободную энергию. Чем короче углеводородные цепи молекул, тем меньше выигрыш энергии при агрегировании молекул в мицеллы, и, следовательно, тем большей должна быть концентрация вещества, при которой начинается мицеллообразование. Поперечный размер мицелл был равен удвоенной длине углеводородной цепи молекулы. При концентрации ниже ККМ растворы ПАВ остаются в молекулярно-дисперсном состоянии, но могут образовывать димеры (измерение электопроводности, на кривой поверхностного натяжения – перегиб). Однако, димеризацию не считают начальной стадией мицеллообразования. Образование димера характерно для ПАВ с достаточно длинными цепями углеводородов и связано с проявлением действия водородных связей. Концентрация димера растет с увеличением объемной концентрации углеводорода вплоть до достижения ККМ.
Кроме молекулярных мицелл существуют еще и ионные.
Существует несколько моделей формы мицелл.
Мак-Бен обосновал две формы мицелл: сферические и пластинчатые. Сферическая состоит не более чем из 10 одинаковых ионов, сохраняющих свои заряды. Подобные мицеллы образуются при концентрациях близких к ККМ. (Мак Бен считал возможным образование мицелл до достижения ККМ). Другой вид образуется при концентрациях, близких к ККМ – нейтральные мицеллы, их Мак-Бен отождествлял с пластинчатыми.
Кроме того существуют модели: палочкообразная (Дебай), сферическая (Хартли), пластинчатая (Филлипов). Считается, что форма и размер мицелл зависит от молекулярной структуры ПАВ, температуры, концентрации, характера межмолекулярных сил, примесей.
Мицеллы характеризуются мицеллярной массой и числом агрегации, т.е. числом молекул образующих мицеллу. Числа агрегации лежат в широких пределах (30-2000). Размер, форма и заряд мицелл измерялись методами светорассеяния и диффузии.
Соотношение между ККМ ионогенных и неионогенных ПАВ.
Пусть 2 вещества имеют одинаковые гидрофобные части, сходные гидрофильные группы, отличающиеся, однако, склонностью к диссоциации. Для образования мицелл из ионогенных и неиногенных ПАВ с одним и тем же числом агрегации требуется в два раза больше ионогенных частиц, чем неионогенных, т.к. способность к образованию мицелл пропорциональна квадрату концетрации ионогенного ПАВ и только первой степени концентрации неионогенного. Т.е. ККМ 10-2 (для ионогенного) и 10-4 моль/л для неиногенного вещества соответствуют друг другу.
Основное положение теории мицеллообразования – уменьшение свободной энергии при агрегировании углеводородных цепей и электостатическое отталкивание заряженных диссоциированных полярных групп.
Влияние длины углводородного радикала
Длина углеводородной цепи – один из главных факторов, определяющих ККМ для данного гомологического ряда. Было показано, что ККМ при увеличении числа углеродных атомов на m уменьшается , согласно выражению: lgC=A-Bm, где А, В константы, характерные для разных гомологических рядов и температуры. А зависит от природы и числа гидрофильных групп, но примерно постоянна для гомологов с различной длиной цепи. В приблизительно равна lg2 для всех коллоидных электролитов, имеющих 1 ионогенную группу. Но другая для соединений с большим числом ионогенных или с неионогенных групп.
Влияние числа ионогенных групп.
Основным объектом являются одновалентные соединения. Для соединений с несколькими ионогенными группами характерна более высокая гидрофильность. ККМ для этих соединений больше числовых значений ККМ для монофункциональных соединений, что по-видимому, связано с увеличением сил отталкивания при возрастании числа ионогенных групп.
Влияние числа углеводородных групп.
ККМ, например, сульфосукцинатов, с разветвленной цепью, имеют более высокие значения. Это связано с тем, что в этом случае снижение свободной энергии в результате агрегации меньше, по сравнению с агрегацией прямоцепочечных молекул.
Влияние положения ионогенных групп в алкильных цепях.
На примере алкилсульфатов натрия (впервые) ККМ увеличивается при перемещении сульфогруппы к середине молекулы.
Наличие бензольного кольца в цепи эквивалентно, примерно, увеличению углеводородной цепи на 3.5метиленовые группы (хотя очень мало реагентов с бензольной группой). Сравнивали алкилсульфонаты с бензолалкилсульонататами. Наличие двойной связи увеличивает ККМ примерно в 3-4 раза по сравнению с насыщенными соединениями. Было замечено, что существенное различие в растворимости молекул насыщенных и ненасыщенных мыл не отражаются на их способости к мицеллообразованию. Наличие в углеводородных цепях полярных заместителей приводит к резкому увеличению растворимости и ККМ.
В различных гомологических рядах при одинаковой длине гидрофобной части величина ККМ определяется природой гидрофильной группы, числом зарядов противоионов и формой молекулы ПАВ. Установлено, что влияние природы гидрофильной группы незначительно. Значения ККМ неионогенных ПАВ с одинаковой углеводородной цепью сильно зависят от размеров и типа гидрофильных групп.
Влияние добавок электролитов.
Свойства растворов ПАВ
Для ПАВ характерны следующие свойства:
- Понижают поверхностное и межфазное натяжение в очень разбавленных растворах (адсорбция и ориентация молекул на поверхностных разделах)
- незначительная концентрация в растворе в молекулярной форме
- образуют мицеллы выше определенной концентрации (ККМ)
- солюбилизация водонерастворимых веществ внутри мицелл.
Методы определения ККМ
Существует множество способов: в этой точке изменяется большинство физико-химических характеристик.
- По электропроводности:
электропроводность растворов зависит от подвижности ионов. Т.к. подвижность отдельных ионов резко отличается от подвижности агрегированной частицы, то при ККМ происходит резкое изменение электропроводности. Очень точный метод, широко используемый.
- По числам переноса:
следует из предыдущего, при изменении подвижности изменяются и числа переноса.
- По адсорбции красителей:
флуоресценция некоторых красителей значительно изменяется в зависимости от того, находятся ли они в растворе или поглощены мицеллами. Концентрация красителя порядка 10-5 моль/л очень мала, поэтому наличие красителя незначительно влияет на величину ККМ. Если при постоянной концентрации красителя постепенно уменьшать концентрацию коллоидного электролита, то по достижении ККМ окраска раствора существенно меняется вследствие изменения спектра поглощения красителя. Красители для катионных и анионных ПАВ используют различные. Недостаток метода в неопределенности значений при большом содержании в системе спиртов или солей. Преимущество состоит в высокой чувствительности метода по оценке небольших сдвигов ККМ (например, в смесях ПАВ)
- По поверхностному натяжению:
поверхностное натяжение раствора ПАВ резко уменьшается при увеличении концентрации вещества в растворе вплоть до ККМ, затем остается постоянным. Обычно используют зависимости поверхностного натяжения от логарифма концентрации. Метод применим для чистых ПАВ. При наличии примесей на графике появляется минимум. Преимущество этого метода заключается в том, что точность определения точки перегиба почти одинаков для веществ с короткими и длинными углеводородными цепями. Для других методов точность измерения ККМ падает с уменьшением самого значения ККМ.
- По показателю преломления:
Метод хорош тем, что не требует введения дополнительных веществ или использования сильного внешнего поля, что само по себе влияет на ККМ. Пригоден для ПАВ и растворителей любого типа. Однако требует строгого температурного контроля и точного определения концентрации.
И другие методы.
Дата добавления: 2018-10-26; просмотров: 460; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
