Антибиотики группы стрептомицина.
Первый АБ этой группы был выделен из культуральной жидкости лучистого гриба Aetinomyces griseus в 1944 г американцами Ваксманом, Бучи, Шатсеном.
Стрептомицин:
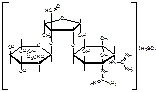
ГФ 11: N-метил-альфа-L-глюкозаминидо-бета-L-стрептозидо-стрептидина сульфат
МФ: O-2-дезокси-2-(метиламино)-альфа-L-глюкопиранозил(1-2)-О-5-дезокси-3-С-формил-альфа-L-миксофураноозил(1-4)-N,N’-бис(аминоиминометил)-D-стрептомина сульфат.
Существует в виде 2-х препаратов:
1. (Стрептомицин)2•3H2SO4 – Streptomycini sulfas – порошок во флаконах по 250 мг, 500 мг и 1 г.
2. (Стрептомицин •3HCl)2•CaCl2 – Streptomycini et calcii chloridum. Порошок во флаконах по 0,1, 0,2 и 0,5 г.
Классификация.
1. АБ широкого спектра действия. Mycobacterium tubercul, кокки, клебсиемы, бруцеллы, протеи. Не активен в отношении риккетсий, хламидий, спироет, вирусов, простейших.
2. По химической структуре – аминогликозид.
3. По механизму действия – сблокирует интез внутриклеточных белков за счет связывания со специальными рецепторами рибосом – нарушение образования комплекса рибосомы и и-РНК. Бактерицидное действие.
Строение и физико-химические свойства.
Состоит из агликона и сахарной части. Агликон – стрептидин, производное многоатомного спирта инозита, в котором ОН группы в положениях 1 и 3 замещены гуанидиновыми остатками. Сахарная часть называется стрептобиозамин.
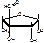
L-стрептоза. 3-С-формил-альфа-L-миксофураноза

N-метил-L-глюкозамин. 2- дезокси-2-метиламино-альфа-L-глюкопираноза.
|
|
|
1. ЛР в воде и НР в органике, гидроксилы. Благодаря наличию ОН групп сособны образовывать комплексы с рядом металлов (Cu, Fe, Cd).
2. Стрептомицин обладает выраженными основными свойствами, за счет наличия 3х основных групп: 2х гуанидиновых и в составе глюкозамина.
3. Образует соли с минеральными и органическими кислотами, которые ОЛР в воде, а некоторые Р и в органических растворителях.
4. Активность его резко снижается в желочной и кислой среде. Оптимальный рН = 7-8, поэтому вводят внутривенно.
Гидролиз по 2-м ступеням:
1. Образуется стрептидин и стрептобиозамин.
2. Образуется N-метил-альфа-глюокозамин и L-стрептоза, в щелочной среде L-стрептоза подвергается дегидротации и изомеризации, превращается в мальтол:
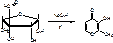
альфа-метил-бета-гидрокси-гамма-пирон.
Взаимосвязь между структурой и биологическим действием:
1. Биологическая активность обусловлена обязательным наличием стрептидина и сахарной части. Отдельно не обладают АБ действием.
2. Гуанидиновые остатки. Удаление одного или обоих à полная потеря активности.
3. Изменение УВ части АБ приводит к существенному изменению его активности. например, восстановление СОН группа в составе стрептозы до СН2ОН снижает активность до 30%, а окисление ее до СООН приводит к полной потери активности.
|
|
|
Стрептомицина сульфат.
Порошок или пористая масса белого цвета без запаха, гигроскопичен, ЛР в воде, ПНР в спирте, метаноле, хлороформе и эфире.
Подлинность:
1. Мальтольная проба. Препарат + 0,5 NaOH, охлаждают и + FeNH4(SO4)2 + 0,5н H2SO4
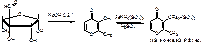
2. Реакция Сакагучи (ФС). Препарат + 10% NaOH + альфа-нафтол, охлаждают, добавляют NaBrO
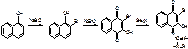
3. Реакция на сульфат с BaCl2 в HCl
НеГФ:
4. Реакции на формильную группу.
а) С реактивом Несслера (а также с реактивами Феллига и Толленса)
R-CHO +K2HgI4 + 3KOH à RCOOK + Hg¯ + 4KI + 2H2O
б) с 2,4-динитрофенилгидразином.
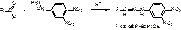
в) Конденсация с резорцином в присутствии H2SO4 à вишневое окрашивание.
5. На гуанидиновый остаток.
а) t° с 30% NaOH à NH3 запах
б) Препарат + нитропруссид натрия à оранжево-красное окрашивание.
6. Реакции на агликон.
Препарат + H2SO4 + H2O à сульфат стрептидина + пикриновая кислота à температура плавления.
Чистота:
1. Прозрачность и цветность
2. Кислотность и щелочность (по рН 28% водного раствора. 4,5-7)
3. Потеря в массе при высушивании (в сушильном шкафу при температуре не более 60°С). Не более 5%.
4. Сульфатная зола до 0,5%.
Биологические методы стандартизации:
|
|
|
1. Токсичность.
2. Пирогенность.
3. Испытание на содержание веществ гистаминоподобного действия.
4. Стерильность.
Количественное определение:
1. Биологический способ. используют метод диффузии в агар в Bacillus mycoides-537. Активность должна быть не менее 730 мкг/мл (на сухое вещество)
2. ФЭК по реакции образования мальтола. При длине волны 625 нм.

НеГФ:
1. Цериметрия. Навеску препарат + 0,1М NaOH и нагревают на водяной бане. Затем охлаждают, добавляют H2SO4 и титруют сульфатом церия в присутствии FeCl3 до исчезновения красной окраски
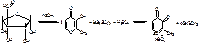
f=1/2 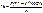
Применение: комплексная терапия туберкулеза. Инфекции мочевыводящих путей, ВДП, туляремии, бруцеллеза. В/м.
Хранение: Список Б, ХУТ, оранжевое стекло.
Антибиотики алициклического ряда. Тетрациклины.
Тетрациклины:
- Природные
- Полусинтетические.
В основе: частично гидрированная конденсированная 4х членная система – тетрацен (нафтацен).
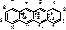
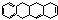 Октагидро-1,4,4а,5,5а,6,11,12а-нафтацен.
Октагидро-1,4,4а,5,5а,6,11,12а-нафтацен.
Tetracyclinum.
4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,6,10,12,12а-пентагидрокси-6-метил-1,11-дикетонафтацен-2-карбоксамид.
[4S-(4α,4aα,5a α,6β ,12a α )]-4-(диметиламино)-1,4,4а,5,5а,6,11,12а-октагидро-3,6,10,12,12а-пентагидрокси-6метил-1,11-диоксо-2-нафтаценкарбоксамид.
|
|
|
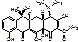
Tetracyclini hydrochliridum.
Oxytetracyclini dihydras. В 5 положении ОН.
4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,6,10,12,12а-гексагидрокси-6-метил-1,11-дикетонафтацен-2-карбоксамида дигидрат.
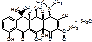
Oxytetracyclini hydrochloridum
Doxycyclini hydrochloridum
4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,10,12,12а-пентагидрокси-6-метил-1,11-дикетонафтацен-2-карбоксамида гидрохлорида гемиэтанолата гемигидрат.
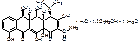
Methacyclini hydrochloridum.
4-диметиламино-1,4,4а,5,5а,6,11,12а-октагидро-3,5,10,12,12а-пентагидрокси-6-метилен-1,11-дикетонафтацен-2-карбоксамида гидрохлорид.
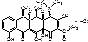
По спектру: АБ широкого спектра. Г+, Г-, бактерии и кокки, риккетсии, хламидии, спирохеты. Простейшие и крупные вирусы.
По структуре: АБ алициклического ряда.
По механизму: нарушает образование комплекса рибосомы и т-РНК, образует устойчивые комплексы с рядом металлов.
Химические свойства:
1. Являются амфотерными соединениями. Основные свойства обусловлены диметиламиногруппами в 4-м положении. рКв=9,7 (образует аммонийные соли с минеральными и органическими кислотами).
Кислотные свойства обусловлены наличием ОН-групп в 10 положении и енольного гидроксила в 3 и 12 положениях. рКа=3,3. По гидроксилам в 3,10,12 возможна реакция с NaOH, щелочными металлами.
Спиртовой гидроксил в 6 и 12а положениях кислыми свойствами не обладают и реагируют только металлами.
2. Наличие 2х систем сопряжения двойных связей обуславливает окраску (желтая) и поглащение в УФ.
3. У тетрациклина 5, у остальных 6 ассиметрических атомов С, обладают оптической активностью. Природные – левовращающие.
4. Фенольный гидроксил в С10 определяет способность тетрациклинов реагировать с FeCl3 и солями других металлов и образовывать азосоединения.
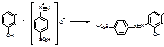
5. При действии растворов щелочей, происходит разрыв связей между С11 и С11а
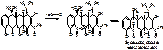 При нагревании этой смеси на водяной бане будем наблюдать хараетерную зелено-желтую флуорисценцию. l=380нм
При нагревании этой смеси на водяной бане будем наблюдать хараетерную зелено-желтую флуорисценцию. l=380нм
6. При действии кислот образуется ангидросоединение.
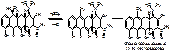
7. Под действием воды и света диметиламиногруппа у С4 может подвергаться инверсии с образованием 4-эпитетрацилина. То же самое может происходить и в положении С6.
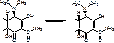
Растворимость в воде:
| Тетрациклин | Тетрациклина гидрохлорид | Окситетрацилин | Окситетрациклина гидрохлорид | доксициклин | Метациклин | |
| Вода | ОМР | ЛР | МР | ЛР | ЛР | УР |
| Спирт | УР | УР | УР | МР | МР | |
| CHCl3 | ПНР | ПНР | ПНР | ПНР | ПНР | |
| Другие | - | - | - | ЛР в NaOH | УР в NaOH |
Описание: ЖКП без запаха. Все ЛР в разведенные кислотах и щелочах. Водные растворы мутнеют при стоянии.
Подлинность:
1. Тетрациклин, тетрациклина гидрохлорид. ТСХ с ГСО на пластине с селикагелем в системе этилацетат-ацетон-вода (4:3:1), выдерживают в парах аммиака, смотрят в УФ свете. Должно быть одно пятно на уровне с ГСО.
2. + H2SO4 à фиолетовое окрашивание, при добавлении воды переходит в желтое, при дальнейшем дабовлении FeCl3 переходит в темно-коричневое.
| Препарат | H2SO4 | H2O | FeCl3 |
| Тетрациклина г/хл | филетовый | желтый | Темно-коричневый |
| Окситетрацилина г/хл | Пурпурно-красный | Темно-желтый | коричневый |
| Доксициклина г/хл | желтый | б/цв | коричневый |
| Метациклина г/хл | алый | Ярко-желтый | Ярко-желтый |
3. С AgNO3 à AgCl
4. Удельный показатель поглащения Е, удельное вращение альфа.
5. Окситетрациклина гидрохлорид (дигидрат):
а) ТСХ
б) с H2SO4к à красный
в) с FeCl3 à коричневый
г) с AgNO3 à AgCl
д) Е, α.
Метациклина гидрохлорид:
а) ТСХ
б) с AgNO3 à AgCl
в) Е, α.
6. Доксициклина гидрохлорид:
а) ТСХ
б) с H2SO4к à желтый
в) с FeCl3 à темно-коричневый
г) С реактивом Несслера à желтый осадок
д) Е, α.
е) с AgNO3 à AgCl
НеГФ:
1. С NaOH à изотетрацилин (см. выше) à желтый
2. Образование азокрасителя (по 9-му положению)
3. С нитропруссидом натрия à темно-красный.
4. С β-п-диметилбензальдегидом à красный.
Чистота:
1. Специфические примеси – ТСХ (ацето-вода 10:1), параллельно СОВС (3 шт). Определяют 4-эпитетрациклин. Допускаются все 3 пятна на уровне СОВС, но их интенсивность не более пятен СОВС
2. Светопоглащение примеси – делают раствор в HCl, измеряют оптическую плотность при l = 430 нм для тетрациклина, оптическая плотность не должна быть более предела, указанного в статье.
3. Остаточные растворители: в тетрациклине – CH3OH, изопропанол. В доксициклине – CH3CH2OH. Проводят количественно ГЖХ. Допустимая примесь.
4. Влажность (метод Фишера) – точка эквивалентности фиксируется потенциометрически
5. рН растворов для гидрохлоридов.
6. α, Е.
Количественное определение:
1. Биологический метод (диффузия в агар). Тест-микроб Bacillus subtill., параллельно проводят активность международного стандарта (не менее 930 мкг/мл)
2. НеГФ:
а) СФМ с ГСО. Растворитель – HCl 0,1M
б) ФЭК по реакции с FeCl3 (или по реакции образования азокрасителя)
в) Флуориметрия (по реакции с NaOH).
г) Неводное титрование – тетрациклина гидрохлорид. Титрант HClO4, растворитель – HCOOH, CH2COOH, диоксан, Hg(CH3COO)2. Фактор=1. Точка эквивалентности потенциометрически.
Применение: пневмония, бронхит, ангина, коклюш, скарлатина, дезентерия.
ЛФ:
Аэрозоль «Оксициклозоль» Окситетрациклина г/хл 0,35; преднизолона 0,1
Аэрозоль «Оксикорт» - тетрациклина 0,3; гидрокортизона 0,1
Таблетки, капсулы, мази, порошки для инъекций, глазные капли.
Анализ препаратов – ТСХ, гормоны с H2SO4. Количественно АБ биологическим методом, гормоны – УФ-спектр.
Хранение: Список Б, сухое защищенное от света место.
Антибиотики тетрациклического ряда. β-лактамины.
β-лактамины: пенициллины (содержат конденсированные с β-лактамным циклом тиазолидиновое кольцо), цефалоспорины (содержат конденсированные с β-лактамным циклом дигидротиазиновое кольцо), карбапенемы ( содержат конденсированное с β-лактамным циклом дигидропирольное кольцо), монобактамы (изолированное от β-лактамного цикла тиазольное кольцо).
Пенициллины.
Строение: производные 6-аминопенициллиновой кислоты (6-АПК)
(2S,5R,6R)-3,3-диметил-7-оксо-6амино-4-тио-1-азобицикло(3,2,0)-гептанкарбоновая кислота.
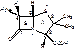
1. Наличие СООН в С2 положении придает выраженные кислотные свойства. Пенициллин легко образует соли со щелочами.
Получение:
1. Микробиологический синтез – подвергают ферментации Penicill штаммы в течении 180 часов, на питательной среде, в которую входят лактоза до 5%, кукур. экстракт, глюкоза до 2% и жир, минеральные соли. Обязательный компанент питальной среды – «предшественник», структура которого соответствует заместителю в С6. Процесс идет в асептических условиях, непрерывная аэрация, рН=6-6,5. Выделение осуществляется центрифугированием или отфильтровыванием. Дльше – замена растворителя. Выделяется сумма пенициллинов. Дальше разделение проводят с помощью адсорбционной хроматографии на активированном угле или Al2O3, распределительной хроматографии на селикогле, противоточного распределения. Удаляют воду в глубоком вакууме при температуре -30°С. Кристаллический пенициллин очищают перекристаллизацией.
Полусинтетический пенициллин получают в 2 стадии:
1. Действие ф-пенициллинацилазы на природный пенициллин.
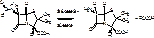 2.
2. 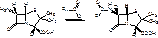
В настоящее время существует 5 природных пенициллинов и 6 полусинтетических:
Benzylpenicillinum-natrium (kalium)
[2S-(2α,5α,6β)]-3,3-диметил-7-оксо-6[(фенацетил)-амино]-4-тио-1-азобицикло(3,2,0)-гептан-2-карбоновой кислоты натриевая (калиевая) соль.
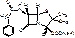
Новокаиновая соль:
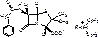
Benzathini benzylpenicillinum = Bicillinum 1
N,N’-дибензил-этилендиамид соединение с [2S-(2α,5α,6β)]-3,3-диметил-7-оксо-6[(фенацетил)-амино]-4-тио-1-азобицикло(3,2,0)-гептан-2-карбоновой кислотой
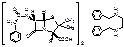
Penoxymethylpenicillinum
[2S-(2α,5α,6β)]-3,3-диметил-7-оксо-6[(феноксиацетил)-амино]-4-тио-1-азобицикло(3,2,0)-гептан-2-карбоновая кислота
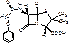
Ampicillini trihydras
Старая ФС: α-аминобензилпенициллина тригидрат.
Новая ФС: (6R)-6-(α-фенил-Д-глициламино)-пенициллановой кислоты тригидрат.
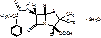
Carbenicillinum-natrium
Динатриевая соль 6-(α-карбоксифенилацетамидо)-пенициллановой кислоты.
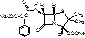
Oxacillinum natrium
Натриевая соль 3-фенил-5-метил-4=изоксазолил-пенициллина моногидрат
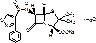
Amoxycillinum trihydras (natrium)
α-амино-п-гидроксибензилпенициллина тригидрат (натриевая соль)

1. По спектру: ограниченного спектра. Природные: Г+ кокки, некоторые Г- кокки (гоно, менингококки), кслостридии, спирохеты. К ним устойчивы: группа кишечных палочек, микобактерии, простейшии, вирусы. Полусинтетические: Г+, Г-, активны к группе кишечных палочек.
2. По структуре: гетероциклического ряда, β-лактамазы
3. По механизму: нарушают синтез пептидогликана клеточной стенки за счет ингибирования транспептидазы. Обладают бактерицидным действием.
Классификация пенициллинов:
1. природные
а) для парентерального введения
-короткого действия: БПК, БПNa
- длительного дейтсия: БПновок. соль, бензотина БП, бициллин 3,5
б) для энтерального введения: феноксиметилпенициллин
2. Полусинтетические:
а) для парентерального введения: карбенициллина динатриевая соль.
б) для энтерального введения: карбенициллин эндонил натрий
в) для энтерального и парэнтерального введения:
- ограничеснного спектра: оксицеиллна натрий
- широкого спектра действия: амоксициллин
Описание: БКП, все натриевые и калиевые соли гигроскопичны.
Растворимость:
| Вещество | вода | Спирт 95% | Хлороформ | Эфир |
| БПNa(K) соль | ОЛР | Р | ПНР | - |
| БПновок соль | МР | МР | УР | - |
| Бензатина Бенз. | ОМР | УР | ПНР | ПНР |
| Феноксиметилпенициллин | ОМР | Р | УР | - |
| Ампициллина тригидрат | МР | ПНР | ПНР | ПНР |
| Ампичиллина натр. соль | ЛР | Р | ПНР | ПНР |
| Карбенициллина динатр. соль | ЛР | Р | ПНР | - |
| Оксациллина натрий | ЛР | УР | ПНР | - |
| Амоксациллина тригидрат | МР | ОМР | ПНР | - |
| Амоксицеллина натр. соль | ЛР | Р | ПНР | - |
Подлинность:
I. Химические методы.
а) общие реакции.
1. Гидроксамовая проба (это по ГФ для БПсолей, фенокси окса натрия).
ЛП + смесь 1н NH2OH•HCl + 1М NaOH, через 3 минуты + 1М AcCOOH и раствор Cu(NO3)2 à зеленый осадок (если вместо нее FeCl3 и HClр., то появляется синее окрашивание)
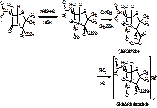
2. Реакция на катионы (Na, K, Nov, N,N-дибензилэтилендиамин).
K, Na соли: ЛП сжигают в тигле, растворяют в воде, фильтруют, в фильтрате определяют. К с винной кислотой, Na с Zn(UO2)3(CH3COO)8
Новокаин определяют по реакции образования азокрасителя с β-нафтолом.
N,N-дибензилэтилендиамин: ЛП + NaOH, выделившийс 1’,1’-диметил ЭДР экстрагируют эфиром, эфир отгоняют, добавляют пикриновую кислоту, перекристолизовывают и определяют температуру плавления.
3. С реактивом Марки.
ЛП + реактив à окрашивание à нагревают, окрашивание меняется.
| Соли БП | Желто-коричневое | Красно-коричневое |
| Феноксимет. | Красное | Красно-коричневое |
| Производные амп. | - | Оранжево-желтое |
| Карбенициллин | - | Коричневое |
| Оксациллин натрий | Слабо-желтое | Темно-желтое |
| Производные амоксициллина | - | Темно-желтое |
4. НеГФ: реакция с хромотроповой кислотой в присутствии H2SO4к.
| Соли БП | Коричневое |
| Фенокси | Сине-фиолетовое |
| Полусинтетические | Желто-коричневое |
5. НеГФ: доказательство серы после минерализации.
а) мокрая минерализация с HNO3к à SO42-
б) сухая минерализация. Спекают с кристаллическим NaOH, затем сушат в виде Na2S c Pb(CH3COO)2
6. НеГФ: с нитропруссидом Na. ЛП + NaOH до сухого остатка красного цвета. Потом добавляют нитропруссид натрия à ярко-фиолетовое быстроисчезающее окрашивание.
7. НеГФ: окисление реактивом Толленса, Феллинга, Несслера. Исключение: ампициллин дает комплекс фиолетового цвета.
8. НеГФ: FeCl3 и HClконц. à красно-фиолетовое окрашивание.
Частные реакции:
1. Образование кислотных форм БП: ЛП + HClр à БП¯ осадок растворяется в избытке HCl.
2. Витали-Морена на производные БП.
3. Ампициллин с р. Феллинга à фиолетовое. С Нингидрином à синее окрашивание.
II. Физико-химические методы:
1. СФМ (факрмакопейный для полусинтетических и производных пенициллина).
2. ИК Спектр (фармакопейный для полусинтетических).
3. ТСХ (фармакопейный для полусинтетических). Группа ампициллина на пластинах «Силуфол» , система ацетон:фосфатный буфер (3:20), детекция I2, должно быть 1 пятно на уровне ГСО.
Ампиокс: на пластине с закрепл. слоем талька. В системе бутанол: эфир:ацетон:вода (28:9:9:10). Проявляют I2 – 2 пятна на уровне РСО.
Чистота:
1. Спец. примеси – продукты синтеза или распада в составе БП NOV соли или карбенициллина динатриевой соли à определяют количество БПNa соли, не более 1% (метод ВЖХ). Феноксиметилпенициллин à феноксиуксусную кислоту методом ВЖХ (не более 0,5%).
2. Остаточные растворители (ГЖХ)
3. Светопоглащающие примеси. Определяют предельное значение Д при определенной длине волн. 1% амп. тригидрат l=322 нм à не более 0,2
4. Определение H2O
- Титрование по Фишеру.
- По схеме потери массы при высушивании. Температура сушилки 100-105°С.
5. Кислотность и щелочность.
6. рН потенциометрически в водной среде.
7. Термостабильность. Греют при 170° в течении 1,5 часа. Уменьшение суммы КО не д.б. более 10%
8. Удельное рващение α – в воде или спиртовых растворах.
9. Биологическая стандартизация: токсичность, стерильность, апирогенность.
Количественное определение:
1. Природные пенициллины.
Первый этап: определение суммы пенициллинов не менее 96%. Методом обратной йодометрии после щелочного гидролиза. ЛП + H2O + 1М NaOH à оставляют на 20 минут à гидролиз. Добавляют 1М HCl, ацетатный буфер до рН 4,5, 0,001М I2, оставляют на 20 минут, потом избыток йода оттитровывают тиосульфатом.
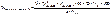
Фактор = 1/8
С – коэфицент пересчета ГСО БПNa на исследуемый пенициллин
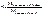
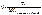
К – поправочный коэфицент титранта.
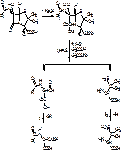
Параллельно ставят контрольный опыт с анализируемым веществом с тем же количеством I2, но без щелочи. Гидролиза при этом нет. Учитывается содержание какой-то примеси.
Параллельно ведут определение ГСО Na соли БП или ГСо феноксиметилпенициллина, смотря что определяют.
Точный механизм окисления невозможно определить и напрвление зависит от температуры и продолжительности процесса. В условиях по ГФ и при комнатной температуре средний фактро: 1/8, а может быть от 1/6 до 1/9.
Феноксиметил – сперва определяют его в ГСО, затем в самом анализируемомо образце.
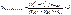
A=%ФМП в ГСО. Сумма пенициллинов в ФМП не менее 95%.
Дата добавления: 2018-09-20; просмотров: 447; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
