Гармоны коркового слоя надпочечников и их синтетические аналоги.
Гормональные ЛП
Получение:
1. Из эндокринных желез убойного скота.
2. Синтетически.
Классификация:
1. Аминокислоты, пептиды, белки (гормоны гипофиза, поджелудочной железы, паращитовидной железы, мозгового вещества надпочечников).
2. Стероидные гормоны (гормоны коры надпочечников). Общая формула:
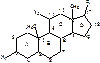
В 9, 8, 14 положении атомы водорода находятся в альфа положении (транс-изомер, связь обозначается пунктиром)
С-10,13 – ангулярные метильные группировки.
Х1, Х2 - =О или –ОН.
С5, С8, С9, С10, С13, С14, С17 – семь центров ассиметрии. Следовательно теоретически существует 27=128 оптических изомеров. Природные стероиды относятся к D-ряду (совпадают с конфигурацией D-глицеринового альдегида).
Эстрогенные гармоны и их синтетические аналоги по действию.
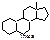

Oestronum (Folliculenum)
 Эстратриен-1,3,5(10)-ол-3-он-17
Эстратриен-1,3,5(10)-ол-3-он-17
Oestriolum
 Эстротриен-1,3,5(10)-триол-3бета,16альфа,17бета
Эстротриен-1,3,5(10)-триол-3бета,16альфа,17бета
Oestrodioli dipropionas
 Эстротриен-1,3,5(10)-диол-3бета,17бета дипропионат
Эстротриен-1,3,5(10)-диол-3бета,17бета дипропионат
Oestradioli benzoas
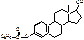 Эстротриен-1,3,5(10)-диол-3бета,17бета бензоат.
Эстротриен-1,3,5(10)-диол-3бета,17бета бензоат.
Синтетические:
Aethinyloestradiolum

Methyloestradiolum

Описание: белые кристаллические порошки.
Растворимость: ПНР в воде, ЛР в хлороформе, ацетоне, бензоле, УР в NaOH.
Получениеи этинилэстрадиола: из эстрона по реакции ацетиленирования по Фаворскому.

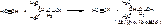
Подлинность:
1. На стероидный цикл
к. H2SO4 + ЭЭ-диол à оранжево-красное окрашивание с желто-зеленой флюорисценцией
+ ЖАК à раствор темнеет и выпадает красно-коричневый осадок
|
|
|
эстрон à желтое окрашивание с зеленой флюорисценцией, при добавлении воды à розовое окрашивание.
2. Гидролиз для сложных эфиров.
Эстрадиоладипроионат  пропионовая кислота
пропионовая кислота 
 (запах)
(запах)
3. Реакция бензоилирования по Фенольному гидроксилу (ГФ)
 Реакцию проводят в щелочной среде, т.к. при таких условиях ОН группа при С3 более реакционоспособна.
Реакцию проводят в щелочной среде, т.к. при таких условиях ОН группа при С3 более реакционоспособна.
Можно проводить реакцию с солями диазония (неГФ)
4. На кетонный цикл.
С кристаллическим м-динитробензолом (NaOH – желотовато-красное).
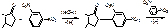
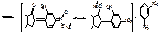
Использование физических констант:
1. Температура плавления
2. Удельное вращение
3. СФМ (поглощение в УФ-области) в сравнении с ФС
Этинилэстрадиол: Максимум при длине волны 281 нм.
Эстрон – максимум при длине волны 280+-3
Чистота:
Физические констатны + специфические примеси.
1. Допустимая примесь эстрона в этинилэтродиоле.
а) в ГФ 10. Реакция … КО, сравнение интенсивности окраски.
б) ИК-спектрометрия
в) ТСХ
Количественное определение
По ГФ 10 кол. определение не предусматривалось, проводили только в ЛФ.
Сейчас: метод косвенной нейтрализации.

HNO3 + NaOH à NaNO3 + H2O
f=1
Точка эквивалетность устанваливается потенциометрически. Растворитель: тетрагидрофуран. Избыток 10% AgNO3 потом потенциометрически титруют.
|
|
|
В ЛФ (ГФ):
Таблетки этинилэстрадиола – фотоколориметрически по реакции с солями диазония.

Параллельно ГСО ЭЭ

Масляный раствор ЭЭдипропионата – обратная алкалиметрия.
+ избыток сп. KOH 
Титруем HCl с индикатором ФФ
ЭД + 2KOH  эстрадиол + 2C2H5COOK
эстрадиол + 2C2H5COOK
KOH + HCl à KCl + H2O
Параллельно КО.

Масляный расвор эстрона. Получаем экстракт – УФ-спектр. Параллельно с РСО.

Хранение: Сп. Б – ЭЭ, МетЭ, Эдипропионат.
Остальные – общий список.
В хорошо упак. таре из оранжевого стекла, в сухом, защищенном от света месте.
Эстриол (Тб) – климакт-са
Эдипроп. (р-р в/м) – «Климактерин».
МетЭ – Тб сублингвальные
ЭЭ – Тб пероральные.
Лечение: бесплодия, климактерические расстройства, злокачественные заболевания у мальчиков и девочек старше 60 лет (молочной, предстательной желез).
Синтетические ЛП эстрогенного действия (нестероидные эстрогены).
Synaestolum
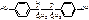 Мезо-3,4-ди(п-оксифенил)-гексан
Мезо-3,4-ди(п-оксифенил)-гексан
Производное дифенилэтана.
ЛП – мезо-изомер.
Активность СЭ = Э
22=4 стереоизомера.
Мезоформа – «внутренний рацемат»
l- и d-изомеры – в 500 раз менее активны мезоформы.
Получение:
Анисовое масло à анетол à синэстрол.
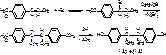
Diaethylstilboestrolum
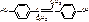 Транс-3,4-ди(п-оксифенил)-гексен-3
Транс-3,4-ди(п-оксифенил)-гексен-3
|
|
|
в 2 раза активнее эстрона.
Diaethylstilboaestili propionas

Транс-3,4-ди(п-пропиония оксифенил)-гексен-2
Octoestrolum

2,4-ди(п-окси-фенил)3-этил-гексан
Активность равна активность эстрона.
Структура-активность:
1. Наличие ароматических систем
2. Наличие ОН-групп и кетогрупп.
3. Межатомное расстояние должно быть близко к 1,1 нм – такое расстояние между гидроксигруппами у природного гармона. У мезоформы расстояние между ОН-группами 1,2 нм. У транс-изомер – 1,22 нм, у цис – 0,75 нм.
Описание: белые кристаллические вещества, у синэстрола может быть желтоватый оттенок, без запаха.
Растворимость: ОМР или ПНР в воде, ЛР в щелочах. СИнэстрол ЛР в спирте, эфире, МР в хлороформе. Октэстрол, диэтилстильб – УР в высш. СП., эфире. Прионат – ЛР в хлороформе.
Подлинность:
1. С к. H2SO4
Растворяют в хлороформе, прибавляют формальдегид и к. H2SO4 à красное окрашивание нижнего сернокислого … Механизм: конденсация + окисление.
Диэтилстильбэстрол à ярко-оранжевое окрашивание, при добавлении воды постепенно исчезает.
Октэстрол à светло-желтое окрашивание, при добавлении воды не изменяется.
2. Реакции на фенольный гидоксил.
SE:
2.1 Бромирование
Синэстрол, октэстрол + 4Br2 à  осадок + 4HBr
осадок + 4HBr
|
|
|
Диэтилстильбэстрол (в присутствии жидкого фенола) + Br2, нагревание à изумрудно-зеленое окрашивание.
ДЭСЭ + 6Br2 à  + 6HBr
+ 6HBr
Получение азокрасителя:
Синэстрол (в о-положение в оба кольца).
Syn + 2[R-Ph-N=N+]Cl- à(NaOH) в о-положении в оба кольца. Красное окрашивание.
3. На фенольный гидроксил.
С FeCl3 à зеленое орашиваниеи, постепенно преходящее в желтый.
Получение сложных эфиров:
Синэстрол à (15 минут, нагревание, пиридин) à(охлаждение) осадок, определение температуры плавления.
Ацетилирование по двум фенольным гидроксилам.
Для синэстрола – анал. дибензоат.
4. На сложно-эфирную группу.
Гдирлиз в СП. NaOH, при нагревании. Определяют температуры плавления исходного продукта и осадка после гидролиза.
Гидроксамовая проба – Беликов.
Физические константы:
Температура плвления, удельный показатель поглащения, УФ-СФМ
Извлечение из ЛФ:
Масляный раствор синестрола: извлекают бунзолом (из щелочнго раствора) масло, в водно-щелочном слое остается синестрол (в виде фенолятов).
Таблетки синестрола: 95% спиртом.
Количественное определение:
Субстанции:
Метод Ацетилирования
Синэстрол, октэстрол, ДЭСЭ кипятят с обратным холодильником 45 минут в среде безводного пиридина, уксусного ангидрида. В результате ацелируется наше соединение по обоим гидроксилам.
Для разложения уксусного ангидрида:
(CH3CO)2O + H2O à(10-15 min) 2CH3COOH
2CH3COOH + 2NaOH à(фф) 2CH3COONa + 2H2O
f=1/2, параллельно КО
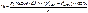
ДЭСЭ пропионат – не предусмотрен метод КО
НО! м.б. метод омыления (по аналогии с эстрадиола дипропионатом).
Масляный раствор синэстрола. Обратная броматометрия
KBrO3 + KBr …
Персиковое масло извлекают щелочным бензолом.
Таблетки синэстрола: УФ-спектрофотомтерия. Извелкают абсолютным спиртом. В сравнении с РСО. Формула обычная.
Тб ДЭСЭ – ФЭК с P-Mo кислотой.
Тб Окт – Фэк с азокрасителем.
Хранение: по СП. Б, хорошо упакованная тара, в защищенном от света месте.
ДЭСЭ Тб
ДЭСЭ пропионат – масляный раствор
О – таблетки
Применяется при гипофункции фичников, бесплодии, лечении злокачественных новообразований.
Нельзя принимать при беременность.
Sygethinum
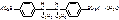
Дикалиевая соль мезо-3,4-ди(п-сульфофенил)-гексан, дигидрат.
ЛР в гор. воде, органических растворителях, ПНР в спирте. Выпускается в виде таблеток, в ампулах.
Эстрогенным действием не обладает, повышает маточные сокращения, применяется как родоускоряющее средство.
Для профилактики и лечения внутриутробной асфиксии плода, легких климаксных расстройствах.
Хранят по списку Б.
Clomifeni cytras (Клостилбегит). Кломифенс цитрат.

1-хлор-2-пара-(2-диэтиламиноэтокси)-фенил-1,2-дифенилэтилена цитрат.
Смесь цис- и транс-измеров. Но цис-изомера д.б. не менее 50%.
Препарат относится к группе антиэстрогенных. Применяется при нарушении овуляции. Выпускается в таблетках, хранится по списку Б, противопоказан при беременности.
Андрогенные гармоны и их синтетические аналоги.
В основе лежит андростан (10,13-дметилгонан).

Андростерон. Андростанол-3-альфа-он-17.

Дегидроэпиандростерон. Андростен-5-ол-3-бета-он-17

Тестостерон. Андростен-4-ол-17-бета-он-3.

Testosteroni propionas. Анростен-4-ол-17-бета-она-3 пропионат.
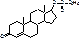
Solutio T.propionatis oleosae pro injectionibus
Methyltestosteronum. Метилтестостерон. 17-альфа-метил-андростен-4-ол-17-бета-он-3.
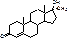
В 3 раза менее активен, чем тестостерона проионат. Но можно принимать перорально. За счет метильной группы – слабое анаболическое действие.
Анаболики:
Необходимы при истощении, начале болезни. Стимулируют синтез белков.
Methylandrostendiol. 17-альфа-метил-андростен-5-диол-3-бета-17-бета.

Methandrostenolonum. 17-альфа-метил-андростадиен-1,4-ол-17-бета-он-3.
 Андрогенная активность в 100 раз меньше, чем у тестостерона.
Андрогенная активность в 100 раз меньше, чем у тестостерона.
Phenobolinum (syn Nandrolonum фенилпропионат). 19-нортестостерона-17-бета-фенилпропионат.
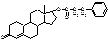 ЛФ – масляный раствор. 1 инъекция в 2 недели.
ЛФ – масляный раствор. 1 инъекция в 2 недели.
Retabolil (нандралон диканоат). 19-нортестостерона-17-бета-диканоат.
 Масляный раствор.
Масляный раствор.
Связь строение – анаболическая активность.
1. Ввод аклильного радикала в положение 17 повышает анаболическую активность.
2. Или этерификация по ОН в 17 положении
3. Двойная связь в положении 1-2
4. Замена О= на НО- в 3 положении с переносом двойной связи в положение 5-6
5. Отсутствие СН3 при С10
Получение:
Из саласодина.
Тестостерон:
Соласодин à ацетат дегидроэпиандростерона

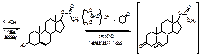

Метилтестостерон:
…


Описание: Белые кристаллические вещества с желтоватым оттенком
Растворимость. ПНР в воде, ЛР в спирте, тестостерона пропионат Р в жирных маслах, ЛР в эфире.
Подлинность:
1. Цветные реакции.
а) с к. H2SO4
МетТ + к H2SO4 à желто-оранжевое окрашиваниеи, при добавлении воды появляется зеленая флюорисценция.
МетАндДиол + к H2SO4 à желто-оранжевое окрашивание с зеленой флюорисценцией, при добавлении воды флюорисценция исчезает.
Метандростеналон + к H2SO4 à красное окрашиваниеи.
2. На сложноэфирную группу.
а) Т.Пропионат нагревают в водном растворе спиртового NaOH à тестостерон + натрия пропионат. Разбавляют водой, подкисляют, тестостерон выпадает в осадок. Его отфильтровывают, сушат, перекристаллизовывают из спирта и измеряют температуру плавления.
б) гидроксамовая проба (AN):
NH2-OH•HCl + NaOH à NH2OH + NaCl + H2O


3. Реакции на кетогруппу.
а) Получение оксима (МетТ, Т):
NH2OH•HCl + CH3COONa  NH2OH + CH3COOH + NaCl
NH2OH + CH3COOH + NaCl

б) Метандростеналон – получение фенил-гидразона.

4. На спиртовый гидроксил
а) Этерефикация. МТ с уксусным ангидридом в среде безводного пиридна.
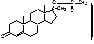 Измеряют температуру плавления осадка.
Измеряют температуру плавления осадка.
5. Физические константы.
а) Т. плавления
б) удельное вращение. Большинство – правовращающие. Исключениеи – МетАндростендиол (-)
в) Удельный показатеь поглащения. Почти для всех УФ-спектр, т.к. имеется хромофор. Искл: метандростендиол.
г) 1 максимум – не отличить друг от дргуга (у всех при длине вол 240-250 нм)
д) ИК-спектр – феноболин в вдие …
Чистота:
1. Определение МетТ в метандростенолоне
Допустимая примесь. Мет. бум. хроматогр. и СОВС. Постор. пятна должны отсутствовать, допускается пятно МетТ, не превышающее пятно СОВС по величине и интенсивности.
2. Определение посторонних стероидов в феноболине. ТСХ. Должно быть одно пятно фиолетового цвета после проявления Ce(SO4)2
3. фенилпропионовая кислота в фенаболине. ЛП растворяют в спирте, найтрализованном по ФФ, титруют NaOH по ФФ, рассчитывают процент содержания кислоты. Примесь допустимая.
Количественное определение:
ТПропионат
1) Субстанция – УФ-спектр в сравнении с ГСО ТПроп.
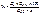
для субстанции фенаболина – УФ-спектр
2) Масляный раствор ТП. Фотокалориметрия по реакции с изониазидом. Получается окрашенное соединение:
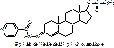
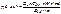
Аналогично для масляного раствора феноболина и ремаболина – спектрофотометрия.
МетТ
1) В субстанции количественное определение не проводят.
2) Таблетки – УФ-спектр спиртового раствора с использованием Е.
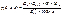
Метиландростендиол (МАД)
Метиландростенолон (МАС)
1) КО в субстанции не проводят.
2) Таблетки МАД – гравиметрия после извлечения спиртом из растертой массы. Ф-ла!
МАС – фотоколориметрия по реакции с H2SO4 – красное окрашивание. В сравнении с ГСО.
Хранение: по списку Б. В хорошо укупоренной таре в защищенном от света и влаги месте.
Применение: ТП, МетТ – при гипофункции половых желез у мальчиков, при климактерических расстройствах, злокачественных образованиях у девочек.
Анаболики – при нарушении обмена Б, при ЯБЖ, травмах, истощении, недоношенных детях.
Гестогенные гармоны и их полусинтетические аналоги.
Проиводные УВ прегнана

Progesteronum. Прегнен-4-дион-3,20.

Получение: из соласодина. Нельзя принимать перорально, т.к. в желудке инактивируется, вводят в/м и п/к в виде масляного раствора.
Praegninum. Прегнен-4-ин-20-ол-17-бета-он-3.

Таблетки для перорального и сублингвального применения.
Получение: из ацетатадегидроэпиандростерона (АДА)
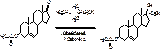

Получение прогестерона:


Описание: белый кристаллический порошок, без запаха.
Растворимость: ПНР в воде. Прогестерон Р в спирте, эфире, ЛР в хлороформе, УР в растительных маслах. Прегнин МР спирте, эфире, хлороформе.
Подлинность:
1. Цветные реакции с к. H2SO4 на стероидный цикл.
+ к.H2SO4 + H2O à у прогестерона желтая окраска с зеленой флюорисценцией. У прегнина – малиновая окраска с зеленой флюорисценцией. При добавлении хлороформа оба слоя обесцвечиваются в обоих случаях.
2. На кетогруппу
Проестероно:
а) с 2,4-динитрофенил-гидразином (при кипячении на водяной бане, катализатор – к.HCl).
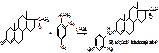
Прегнин
1) Получение оксима
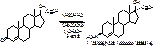
Прогестерон:
2) С м-динитробензолом в щелочной среде. Розовое орашивание, переходящее в красно-коричневое. (смотри лекцию по эстрогенам). Прегнин эту реакцию не дает.
3) Физ. константы
а) Тпл
б) удельное вращение
в) удельный показатель поглащения – по ФС для прогестерона
г) для раствора прогестерона в оливковом масле (1% или 1,5%) – показатель преломления. В персиковом масле – вначале ТСХ с вырезом зоны прогестерона, затем ИК элюата. Он должен совпадать с тем, что предложен в статье.
Примеси не контролируются.
Количественное определение.
Прогестерон:
Субстанция: - гравиметрия с 24ДНФГ
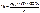

Масляный раствор – по ГФ 10
1. Гравиметрия
2. СФМ. В основе реакция с изониазидом (см. тестостерон). Кипятят 1 час в спартоводной среде. Параллельно опыт с РСО.

Прегнин:
Субстанция:
1. УФ-СФМ спиртового раствора в сравнении с ГСО прегнина.

2. Косвенная нейтрализация после образования серебряной соли. НеГФ. Смотри этинилтетрад…
Таблетки:
1. УФ-спектр.
Применение: при патологических проявлениях, связанных с различными функциями желтого тела.
Хранение: Список Б, в хорошо укупоренной таре, продохраняя от действия света
Эфиры оксипрогестерона.
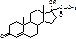
Oxyprogesteroni caproas. Прегнин-4-ол-17-альфа-дион-3,2 капроат (гексаноат). Вводят в/м 1 раз в неделю.
R = -CO-(CH2)4-CH3
Пероральные гестогены прогестероноподобнго действия:
Norcolut (Norethisteron). 17-альфа-этинил-19=нортестостерон.

Применяют при маточных кровотечениях, климактерических расстройствах.
Allyloestrenolum (Turnial). 17-альфа-аллилэстрен-4-ол-17-бета.
 При угрозе выкидыша.
При угрозе выкидыша.
Комбинированные гестаген-эстрагенные ЛП (противозачаточные).
Infecundinum, Bisecurinum – первые ЛП, снятые с производства, из-за побочных эффектов (повышенное тромобообразование, нарушение функции печени)
Non-ovelon.
 Этилилэстрадиол 0,05 мг.
Этилилэстрадиол 0,05 мг.
 Ноэтистерона ацетат 1 Мг
Ноэтистерона ацетат 1 Мг
Ovidon
Левонористрел 0,025. 13-этил-18,19-динор-прегнен-4-ин-20-ол-17-бета-он-3.
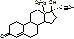
Этинилэстрадиол 0,05 мг
Качественное определение: ТСХ
Количественное: УФ-СФМ
Rigaridon
Тб: этинилэстрадиол 0,03 мг
левоноргестрел 0,025
Trisiston
TriRegol
Marvelon
Этинилэстрадил 0,03 мг
Дезогестрел 0,15 мг.

Гармоны коркового слоя надпочечников и их синтетические аналоги.
Производные УВ прегнана (см. выше). Делятся на глюкокортикоиды и минералокортикоиды.
Desoxycorticosteroni acetas – масляный раствор, таблетки.

Прогнен-4-ол-21-диона-3,20-ацетат.
Cortisoni acetas

Прегнен-4-диол-17-альфа,21-триона-3,11,20-ацетат.
Hydrocortisoni acetas – в 11 положении ОН.
Прегнен-4-триол-11-бета-17-альфа,21-диона-3,20-ацетат.
Получение:
1. Из надпочечников убойного скота.
2. Синтетическим путем из холестерина – смотри Беликова (Desox.). Кортизон и гидрокортизон из салосодина.
Салосодни à прогестерон à кортикостероид.
3. Элементы м/б синтеза
Подробнее смотри в лекциях – но там фигня.
Глюкокортикоиды:
1. Противоаллергические
2. Противоревматические
3. Противошоковые идр.
Кортизона ацетат – в/м, Тб.
г/кортизона ацетат – активнее кортизона ацетата –мазь.
Prednisonum – Тб.

Прегнандиен-1,4-диол-17-альфа,-21-трион-3,11,20
В 3-5 раз активнее кортизона ацетата. Побочный эффект менее выражены.
Prednisolonum – таблетки, раствор, мази.

Прегнадиен-1,4-трион-11-бета,17-альфа,21-дион-3,20
Описание: кристаллические порошки белого цвета с желтоватым (у гидрокортизона) или кремовым оттенком, без запаха.
Растворимость: ПНР в воде, в большинстве органических растворителей растворяются мало или умеренно. ДКСацетат ЛР в хлороформе, УР в спирте, МР в эфире. К ацетат ЛР в хлороформе, МР в эфире, ПНР в спирте, Г/кортизона ацетат МР в хлороформе, ОМР в спирте, ПНР в воде.
Подлинность:
1. С к. H2SO4 на стероидный цикл.
ДКС ацетат à желток окрашивание, при добавлении воды переходит в фиолетовоео.
Г/к ацетат à желтое окрашивание с зеленой флюорисценцией, через пять минут переходит в красное окрашивание с зеленой фллюорисценцией.
К. ацетат à желтое
преднизалон à красное
преднизон à жето-зеленое
2. На кетогруппу (ГФ)
К спиртовому раствору ЛП добавляют спиртовой раствор фенилгидразона, нагревают 5 минут на водяной бане, появляется желтое окрашивание гидразона.
 В С11 – стерическое затруднение, но может идти по С20, поэтому температуру плавления не определяют.
В С11 – стерическое затруднение, но может идти по С20, поэтому температуру плавления не определяют.
3) На сложно-эфирную группу.
а. Гидроск. пр. – смотри тестостерона пропионат. ЛП растворяют в спирте.
б. Гидролиз, получение этилацетата.
Гидролиз в сп. KOH à CH3COOK à(H2SO4) CH3COOH à(C2H5OH, H2SO4 к.) CH3COOC2H5 запах
4) На альфа-кетольную кетогруппу. Наиболее специфичны.

а. С реактивом Феллинга (ГФ) à CH2O (красно-фиолетовое окрашивание)
б. реакция серебряного зеркала
в. с P-Mo кислотой
г. С 2,4,5-трифенилтетразолия хлоридом

5) Физические константы.
а. УФ-СФМ по хромотофору -3-он-4-ен
б. Удельный показатель поглащения Е.
в. ИК-спектр
Чистота:
Е, Лямбда, Т пл, Альфа
1. на посторонние стероиды: бумажная или ТСХ.
В корт. ац. – бум. хр. с СОВС, д.б. совпадение пятен.
Г/корт ац – ТСХ с СОВС (гидрокотр, г/к ацетат) – может быть пятно г/кортизона, но размер не должен превышать пятен СОВС.
КО
1. УФ-спектр
2. Фотоколориметрия
Хранение: список Б.
Альдостерон – не является ЛП, т.к. легк окисляется:

Spironolactonum (Verospiron) – Тб.

PrednisolonHemisuccinas. Преднизолонгемисукцинат.

Р в воде.
Описание: белая пористая масса или порошок, выпускаемая в лиофильном виде, также в ампулах.
Применение аналогично преднизолону, но! вводят в/в или в/м
Подлинность:
1. Na2HPO4 + AgNO3 à Ag3PO4 желтый осадок.
2. На Натрий
КО:
1. Неводное титрование (на Na2HPO4) в ЛУК + преднизолон.
Хранение – список Б.
Галогенпроизводные полусинтетических аналогов глюококортикоидов:
Dexamethasonum
9-альфа-F-16-альфа-метил-преднизолон
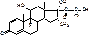
ПНР в воде, УР в спирте, орг. раств.
УФ-спектр.
2,1>=Dлямбда макс/Dлямбда>=1,9
Реактив фелинга – альфа (вращение)
Специфические примеси – посторонние стероиды- ТСХ.
СФМ – расчет через Е
Список Б.
Triameinolonum – Тб.
9-альфа-F-16-альфа-окси-преднизолон

Triameinolonum – ацетонид

F-производное, пр не влияют на солевой обмен. Мин. побочные эффекты.
Дифторпроизводные:
Flumethasoni pivalas
6-альф,9-альфа-диF-16-альфа-метил-преднизолона-21-триметацетат

Fluocinoloni acetonidum = синофлан, флюцинар.
6-альфа, 9-альфа-дифтор-16-альфа-оксипреднизолона-16,17-ацетонид.

1. Наличие фтора уменьшает процессы гидроксилирования молекулы, увеличиывает устойчивость соединения.
2. Заместитель в 16 положении экранирует неустойчивую альфа-кетольную группу.
Дата добавления: 2018-09-20; просмотров: 188; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
