Зависимость скорости фотохимических реакций от температуры
Скорость фотохимической реакции не зависит от температуры, если конечные продукты реакции образуются непосредственно из возбужденных частиц, если лимитирующей стадией образования конечных продуктов является фотохимический процесс, или энергия активации "темновых" реакций очень мала. Энергия электронного возбуждения молекул обычно имеет более высокое значение, чем прирост средней тепловой энергии при нагревании от комнатной до повышенных температур. Например, повышение температуры ацетальдегида от 20 до 220°С приводит к увеличению средней тепловой энергии на 12,5 кДж/моль,в то время как энергия электронного возбуждения молекулы ацетальдегида составляет около 418,4 кДж/моль. Поэтому направление и эффективность фотолиза мало зависят от температуры. Зависимость скорости первичного фотохимического процесса от температуры может быть значительной, если энергии поглощенного кванта не хватает для разрыва связи.
Однако независимость скорости фотохимической реакции от температуры еще не говорит о том, что продукт образуется в первичном процессе. Это может происходить и вследствие того, что в реакции участвуют "горячие" радикалы или вторичные реакции протекают с малыми энергиями активации.
Если считать, что избыток энергии при фотодиссоциации переходит только в кинетическую энергию поступательного движения (нет колебательно-, враодательно- и электронно-возбужденных радикалов), то полный избыток кинетической энергии частиц А и В, образующихся по реакции АВ + hv→A + В будет
|
|
|

где Da-b- энергия диссоциации молекулы АВ.
Эта избыточная энергия распределяется между радикалами таким образом, что радикал, имеющий меньшую массу, приобретает большой избыток энергии (и становится "горячим". Его участие в последующих реакциях характеризуется энергией активации близкой к нулю.
Фотолиз исходных молекул обычно приводит к появлению вращательно-, колебательно- или электронно-возбужденных радикалов, имеющих, кроме того, и повышенную кинетическую энергию поступательного движения. Энергия активации реакций с их участием также будет близка к нулю.
6. Кинетика флуоресценции, фосфоресценции и интеркомбинационной конверсии
Количественное изучение флуоресценции и фосфоресценции позволяет определить ряд важных величин, характеризующих фотохимический процесс; время жизни возбужденных молекул, скорость интеркомбинационной конверсии, число и природу возбужденных состояний, эффективные сечения тушения молекул, эффективность переноса электронной энергии, первичный квантовый выход. Рассмотрим процесс, который слагается из стадий первичного возбуждения исходных молекул светом и последующих процессов флуоресценции или фосфоресценции, конверсии энергии электронного возбуждения в энергию теплового движения и химического превращения возбужденных частиц, т. е.
|
|
|

где Iа — число квантов, поглощенных в единицу времени в единице объема, которое принимается равным числу молекул, возбужденных в единицу времени в единице объема (это соответствует φ = 1).
Скорость, накопления возбужденных частиц запишется в виде

Из условия стационарности ∂[А*]/∂t=0 вытекает:

Пользуясь этим выражением, легко найти первичный квантовый выход распада А* на вещества В и С:

Подставляя выражение, получим

Принимая, что число излучаемых квантов в единицу времени из единицы объема равно
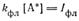
из условия стационарности находим

После подстановки в него Iфл получим
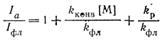 (4)
(4)
Как видно из выражения (4), зависимость Iа/Iфл от [М] является линейной. Наклон прямой равен kконв/kфл, а отрезок по оси ординат составляет 1 + kр/kфл. Отсюда вытекает, что определяя независимым путем kфлможно из этих данных вычислить величины kконвиkфл. Предположение о том, что Iа иIфл одинаковы по воему объему, не всегда верно. Учет изменения I в объеме возможен и приводит к более сложным зависимостям.
|
|
|
Хемилюминесценция
Свечение, сопровождающее некоторые химические реакции, возникает в результате образования электронно-возбужденных продуктов реакции. Схема реакции, сопровождающейся хемилюминесценцией

Согласно схеме

где W— скорость реакции А с В; φвозб -выход возбуждения; φлюм - квантовый выход люминесценции продукта.
В присутствии активатора Dдополнительно идут реакции:

Дата добавления: 2018-09-22; просмотров: 527; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
