Различие кинетики фотохимических и темновых реакций
Различия между кинетикой фотохимических и обычных ("темновых") реакций хорошо могут быть проиллюстрированы на примере образования бромистого водорода, Темновая реакция Н2 + Вг2→2НВг была детально исследована в интервале температур 200-300 °С и оказалась состоящей из следующих элементарных стадий (ΔН0в кДж/моль)!
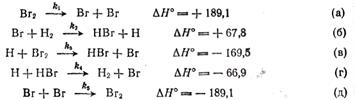
Из приведенной схемы вытекает, что скорость образования бромистого водорода может быть выражена следующим уравнением:
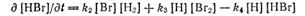
Применяя принцип стационарности к реакциям возникновения и уничтожения атомов водорода и брома, получим
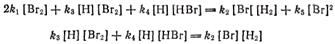
Откуда находим 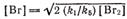 . Подставляя получим
. Подставляя получим
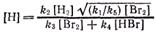 .
.
Подставляя концентрации атомов брома и водорода получим окончательное уравнение, определяющее скорость образования НВг
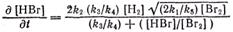
хорошо удовлетворяющее опытным данным. Как видно, скорость реакции оказывается прямо пропорциональной 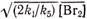 , т. е.концентрации атомов брома.
, т. е.концентрации атомов брома.
Для температуры 246 °С Боденштейн и Линд получили следующие значения констант:
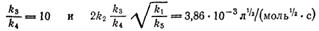
По смыслу принятой схемы k1/k5- константа диссоциации молекулярного брома К, которая может быть вычислена с использованием значения энергии диссоциации брома, равного 190 кДж/моль. Для температуры 246°С эта константа оказывается равной K = 3,26∙10-15 моль/л. Эти данные позволяют вычислить константу скорости элементарной реакции
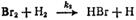
которая будет равна
|
|
|

Полученное значение отношения k3/k4 показывает, что при температуре 246°С скорость взаимодействия атомов водорода с молекулярным бромом в десять раз больше скорости взаимодействия с бромистым водородом.
Фотохимическая реакция хорошо идет уже при комнатной температуре при облучении смеси водорода и брома светом с длиной волны, большей 300 нм. Скорость фотохимической реакции примерно в 300 раз превышает скорость темновой.
Фотохимическая реакция должна отличаться схемой элементарных процессов образования атомов брома: термический процесс (а) заменяется фотолизом молекулярного брома 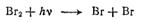 (а').
(а').
Очевидно, что при избытке молекул брома каждый квант приводит к образованию двух атомов брома, и, таким образом, скорость образования активных частиц зависит только от плотности излучения, т. е. от концентрации фотонов [hv]. Замена процесса (а) процессом (а') приводит к кинетическому уравнению
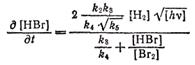
которое полностью описывает фотохимическую реакцию. Отношение k3/k4оказалось равным 10. Это указывает на полную однотипность вторичных процессов в обоих случаях, разнящихся лишь по способу образования атомов брома.
Данные для фотохимической реакции позволяют получить еще ряд сведений о кинетике элементарных вторичных процессов. При [hv] = 9,8∙10-10 моль/(см3-с), парциальных давлениях 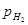 =41,6 и
=41,6 и 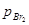 =16,5 кПа и 491 К отношение скоростей фотохимической и термической реакцией оказалось равным 3,1 ∙102. При этой же температуре К = k1/k5=" 2,48∙10-17 моль/л.
=16,5 кПа и 491 К отношение скоростей фотохимической и термической реакцией оказалось равным 3,1 ∙102. При этой же температуре К = k1/k5=" 2,48∙10-17 моль/л.
|
|
|
В итоге получаем
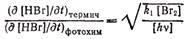
откуда может быть вычислена константа скорости диссоциации брома при термической реакции 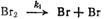 ,а следовательно, и обратная ей кинетическая константа для обоих процессов.
,а следовательно, и обратная ей кинетическая константа для обоих процессов.
Поскольку
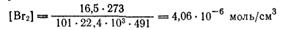
(где 101 кПа — атмосферное давление и 22,4∙103см3/моль стандартный объемгаза) получаем
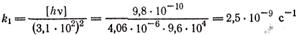
откуда
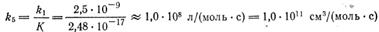
Сравним полученное значение с тем, которое дается теорией столкновений при условии, что все столкновения между атомами брома приводят к рекомбинации (диаметр столкновения примем равным 0,3 нм)
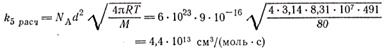
Таким образом
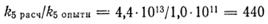
т. е. только одно из 440 столкновений атомов брома ведет к их соединению в молекулу. Поскольку энергия активации рекомбинации равна нулю, этот результат указывает на необходимость тройного столкновения для стабилизации получающейся молекулы брома.
Дата добавления: 2018-09-22; просмотров: 402; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
