Классификация фотохимических процессов
Украинский Государственный Химико-Технологический Университет
Кафедра физической химии
Реферат на тему:
"Кинетика фотохимических реакций"
Выполнил:
студент группы 3-ТЕХ-14
Рудень А.А.
Проверила:
Кшыш В.А
Днепропетровск 2016
тохимический кинетика флуоресценция конверсия
Введение
Раздел физической химии, посвященный закономерностям реакций, протекающих под действием света, носит название фотохимии. Еще в начале XIX в. Гроттгус в России, а затем Дрейпер в США сформулировали закон, согласно которому фотохимически активны только те лучи, которые поглощаются при реакции. Этот закон в настоящее время очевиден и не имеет исключений. Обратное утверждение, что лучи, которые поглощаются при реакции, являются фотохимически активными, не верно, так как не вce они вызывают фотохимическую реакцию.
|
|
|
Особенностью фотохимической активации является ее селективность. Поглощенные кванты света возбуждают и тем самым приводят в активное состояние отдельную связь или группу атомов в данной молекуле. В этом большое преимущество активации молекул светом по сравнению с термической активацией.
Другой закон, которому подчиняются фотохимические реакции, был найден Бунзеном и Роско в 1855 г. в результате изучения реакции соединения хлора с водородом на свету. Этот закон формулируется так: химическое действие света прямо пропорционально произведению интенсивности света I на время его воздействия t. Закон этот носит приближенный характер, потому что не вся поглощаемая световая энергия расходуется на химический процесс.
Основным законом, позволившим разобраться в механизме фотохимических реакций, является закон фотохимической эквивалентности А. Эйнштейна, согласно которому каждый поглощенный квант света вызывает превращение одной молекулы.
Фотохимические реакции – химические превращения, протекающие под действием света в видимой и ультрафиолетовой области спектра.
Типы фотохимических реакций:
1. Фотодиссоциация (фотолиз) приводит к разложению исходного вещества, поглотившего световую энергию. Примерами реакции фоторазложения служат такие: разложение галогенидов серебра (основа серебряной фотографии), фотолиз паров ацетона CH3CO CH3 → CO + другие продукты.
|
|
|
2. Фотосинтез приводит к образованию более сложных соединений. Примерами реакций фотосинтеза служат:
· фотосинтез озона в верхних слоях атмосферы, создающий защитный озоновый слой:
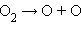
| фотодиссоциация |
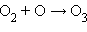
| фотосинтез; |
· фотосинтез органических соединений из углекислого газа, воды, минеральных веществ зелеными растениями. В частности, синтез глюкозы может быть описан уравнением:

|
3. Фотохромизм – явление обратимого изменения пространственного или электронного строения молекул под действием света, сопровождающееся изменением окраски вещества. На основе фотохромных материалов изготовляются линзы с переменным светопропусканием, оконные стекла, фотохромные системы на основе некоторых органических и координационных соединений.
Классификация фотохимических процессов
Для характеристики фотохимических реакций было введено понятие квантового выхода γ. Квантовым выходом называется отношение числа прореагировавших молекул к числу поглощенных квантов
|
|
|

где N' — число прореагировавших молекул; Q — количество поглощенной све товой энергии; hv— энергия одного светового кванта.
Для расчетов более удобно пользоваться не числом молекул, а числом молей. Тогда квантовый выход запишется в виде

где п — число прореагировавших молей вещества; NA— число Авогадро.
Количество энергии, необходимое для фотопревращения одного моля вещества при данной длине волны, равно 6,02∙1023hvи носит название Эйнштейн. Таким образом

где 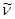 — волновое число.
— волновое число.
Числовое значение одного Эйнштейна зависит от частоты колебаний.
Согласно закону эквивалентности Эйнштейна квантовый выход должен быть равным единице. Однако, как показывает опыт, все фотохимические реакции можно разделить по значениям квантового выхода на четыре группы: 1) реакции, в которых квантовый выход γ = 1 (например, образование бромцикло-гексана, пероксида водорода, нитрозометана, брома в результате реакции хлора с трихлорбромметаном, разложение сероводорода в бензольном растворе и др.); 2) реакции, в которых квантовый выход γ< 1 (например, разложение аммиака, йодистого и бромистого метана, ацетона, уксусной кислоты, образование гексабромбензола); 3) реакции, в которых квантовый выход γ > 1 (например, образование сульфурилхлорида, бромистого водорода, озона, разложение бромистого водорода, диоксида азота, азометана, хлорноватистой кислоты и др.), и 4) реакции, в которых квантовый выход γ>> 1 (например, реакция взаимодействия хлора с водородом и оксидом углерода и др.).
|
|
|
Отклонение квантового выхода от единицы не означает отклонения от закона эквивалентности Эйнштейна. Как показывает опыт, фотохимический процесс слагается из первичного, протекающего в результате поглощения светового кванта и обычно приводящего к диссоциации молекулы с образованием свободных атомов и радикалов, и вторичных процессов, протекающих в результате вступления в реакцию образовавшихся в первичном процессе атомов и радикалов, или же дезактивации возникших в результате поглощения света молекул, или рекомбинации атомов и радикалов. Первичные фотохимические процессы, являющиеся истинно фотохимическими, всегда подчиняются закону эквивалентности Эйнштейна. Таким образом, отклонение квантового выхода от единицы указывает на наличие вторичных процессов, которые идут уже без участия света.
Для реакций, протекающих в растворах или в газах при очень малых давлениях, квантовый выход очень часто оказывается меньше единицы.
В газах (если реакция идет с участием возбужденных молекул) это может происходить вследствие того, что возбужденные молекулы до столкновения с реагирующими молекулами дезактивируются путем испускания света. Для растворов квантовый выход меньше единицы может быть вследствие дезактивации возбужденных молекул молекулами растворителя или вследствие рекомбинации возникших при фотодиссоциации атомов и молекул. Процесс рекомбинации также облегчается молекулами растворителя, окружающими рекомбинирующие частицы и образующими как бы "клетку", играющей роль третьей частицы, которой передается избыточная энергия. Такое уничтожение реакционноспособных частиц получило название эффекта "клетки". Реакция рекомбинации в растворе при большой концентрации растворителя имеет большую вероятность, чем в газе, следовательно, выход свободных атомов и радикалов (и квантовый выход) в растворе меньше. Квантовый выход часто зависит от температуры. Так, при изменении температуры фотолиза (разложения под действием света)' аммиака от 20 до 500 °С квантовый выход изменяется от 0,2 до 0,5. Это объясняется следующими обстоятельствами. Первичный процесс поглощения фотона сопровождается отщеплением одного из атомов водорода

после чего могут произойти вторичные процессы;
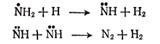

приводящие к образованию водорода и азота. Однако существует возможность рекомбинационного процесса
 (в)
(в)
Его вероятность при комнатной температуре в три раза больше вероятности процесса (б). Таким образом, три четверти активных продуктов фотолиза возвращается в исходное состояние (образуются молекулы аммиака). Этот процесс приводит к уменьшению квантового выхода, который становится меньшим единицы. С увеличением температуры вероятность рекомбинации несколько падает и соответственно увеличивается квантовый выход.
В целом ряде случаев квантовый выход оказывается больше единицы. Довольно часты случаи, когда квантовый выход равен 2, или 3. Примером такого типа фотохимического процесса могут служить реакции разложения в газовой фазе йодистого и бромистого водорода!

или реакция разложения нитрозилхлорида

для которых квантовый выход равен двум.
Реакции фотолиза бромистого и йодистого водорода объяснены наиболее полно. Первичный процесс состоит в диссоциации галогеноводорода на атомы

Для возникновения атомов Н и I возможны следующие реакции (ΔН° в кДж/моль):

Для атомов водорода существенной является только реакция (а), так как если I2 удаляется из сферы реакции, реакция (б), так же как и реакции (д) и (ж), практически не имеет значения из-за малой концентрации партнеров. Для атомов I возможна только реакция (е), так как из-за эндотермичности реакций (в) и (г) их энергия активации очень велика, а реакция (ж) невозможна из-за малой концентрации атомов Н, которые потребляются в основном по реакции (а). Поэтому протекающая реакция состоит из совокупности следующих процессов:

Таким образом, квантовый выход реакции получается равным двум. Атомы I, возникающие в элементарном фотохимическом процессе, по реакции (е) рекомбинируют, образуя молекулярный йод. Добавление к йодистому водороду молекулярного йода тормозит, вследствие реакции (б), процесс разложения йодистого водорода.
Квантовый выход фотолиза HI в газовой фазе, в конденсированном HI и в 0,8 н. растворах приведен ниже:

Как видно, в растворе квантовый выход меньше, хотя механизм фотолиза остается прежним.
Интересно, что с увеличением длины волны квантовый выход растет; это объясняется уменьшением вероятности возбуждения молекул растворителя с уменьшением энергии инициирующего распад йодистого водорода излучения.
Для некоторых реакций квантовый выход оказывается равным трем. Примером такой реакции может служить реакция образования озона из кислорода (под давлением 4813 кПа), которая, по-видимому, протекает по схеме
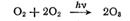
Иногда квантовый выход может быть порядка нескольких десятков. Например, фотохимическая полимеризация газообразного ацетилена идет с квантовым выходом γ= 9,2, а квантовые выходы реакций разложения пероксида водорода в воде лежат в пределах от 7 до 500. Детальный механизм реакций с квантовым выходом больше единицы во многих случаях неизвестен.
Примером реакции, квантовый выход которой много больше единицы, является реакция соединения хлора с водородом на свету. Квантовый выход для этой реакции γ=105, т. е. одному поглощенному кванту соответствует около ста тысяч превратившихся молекул хлора и водорода. Реакция хлора с водородом, инициируемая светом протекает по схеме

Экспериментальные данные показывают, что устанавливающиеся в ходе реакции концентрации атомов Н несравненно меньше концентрации атомов Сl. Поэтому среди реакций обрыва достаточно принимать во внимание только одну реакцию рекомбинации атомов хлора.
Скорость образования атомов хлора равна 2φI (где φ — квантовый выход первичного процесса, обычно лежит в пределах от 0 до 1; I — число поглощенных квантов в единицу времени в единице объема, ее часто называют интенсивностью поглощения света). Скорость исчезновения атомов хлора при достаточно длинных цепях, когда реакции развития цепи можно не принимать во внимание, будет равна k3[С1]2[М]. В стационарном состоянии
 откуда
откуда 
Скорость образования хлористого водорода

При достаточно длинных цепях скорости возникновения и гибели атомов водорода и хлора (реакции развития цепи) в стационарном состоянии будут одинаковыми, поэтому последнее выражение можно записать в виде

В итоге получим:

Норриш показал, что это уравнение для скорости реакции согласуется с опытными данными, если исходная смесь газов хорошо очищена от следов кислорода В присутствии следов кислорода происходят реакции обрыва цепи по реакциям  или
или 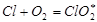 . Если учесть эти реакции обрыва, скорость образования хлористого водорода окажется прямо пропорциональной не
. Если учесть эти реакции обрыва, скорость образования хлористого водорода окажется прямо пропорциональной не 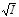 , а I и будет уменьшаться с ростом, концентрации кислорода.
, а I и будет уменьшаться с ростом, концентрации кислорода.
Таким образом, в случае цепной реакции, инициируемой светом, если реакция обрыва будет первого порядка относительно концентрации радикала, скорость реакции прямо пропорциональна интенсивности поглощения света I. Обрыв цепи по реакции второго порядка приводит к пропорциональности 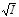 . Обрыв по второму порядку происходит при больших концентрациях радикалов или больших значениях I. Обрыв по первому порядку преобладает при малых значениях I и низких концентрациях, когда имеет место быстрая диффузия.
. Обрыв по второму порядку происходит при больших концентрациях радикалов или больших значениях I. Обрыв по первому порядку преобладает при малых значениях I и низких концентрациях, когда имеет место быстрая диффузия.
Квантовый выход может зависеть от концентрации исходных веществ. Такая зависимость наблюдается в хорошо изученной фотохимической реакции димеризации антрацена. Если антрацен, растворенный в бензоле, облучать светом, то происходит его ди-меризация и одновременно наблюдается флуоресценция. С увеличением концентрации антрацена квантовый выход димеров возрастает, а интенсивность флуоресценции падает. Уравнения происходящих при этом процессовмогут быть записаны в виде схемы:

где А — молекула антрацена; А* — молекула возбужденного антрацена; А2 — молекула димера; v — частота излучения; v' — частота флуоресценции.
Так как концентрация возбужденных молекул, являющихся промежуточным продуктом реакции, мала, скорость изменения их концентрации тоже мала и в некотором приближении может быть приравнена нулю. Таким образом, концентрация возбужденных молекул на начальной стадии реакции становится стационарной. В стационарном состоянии скорость образования активных молекул должна равняться скорости их гибели. Скорость образования возбужденных молекул равна φI. Скорость исчезновения активных молекул, как видно из схемы реакции, равна 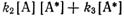 . Поэтому в стационарном состоянии
. Поэтому в стационарном состоянии
 откуда :
откуда :

Скорость образования димера: 
Получаем: 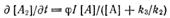
Квантовый выход димеров: 
Из последнего выражения видно, что при малых концентрациях антрацена [А] <k3/k2

т. е. квантовый выход димеров (в соответствии с данными опытов) растет с увеличением концентрации антрацена. При высоких концентрациях антрацена [А] >k3/k2и γ=φ, т. е. достигается предельное значение квантового выхода димеров.
К первичным фотохимическим процессам близко стоят так называемые сенсибилизированные реакции, происходящие не с теми молекулами, которые непосредственно поглощают лучистую энергию, а с соседними, нечувствительными к излучению данной частоты и получающими энергию непосредственно от поглощающих ее молекул. Примером такого процесса является диссоциация молекулярного водорода в присутствии паров ртути, атомы которой поглощают свет, соответствующий резонансной линии ртути с длиной волны λ = 253,67 нм. В настоящее время известно большое число сенсибилизированных реакций. Кроме сенсибилизации парами ртути известны реакции, в которых сенсибилизаторами являются галогены, хлорофилл, ионы железа и др.
Как видно, во всех реакциях с квантовым выходом, отличным от единицы, первичный фотохимический процесс подчиняется закону эквивалентности Эйнштейна, а характер отклонения от этого закона позволяет разобраться во вторичных нефотохимических процессах.
Для фотохимических реакций характерна возможность смещения равновесия под действием света, так как изменяется запас свободной энергии системы и соответственно константа равновесия. Очевидно, что заметное изменение положения равновесия можно наблюдать только в тех случаях, когда квантовый выход реакции близок к единице.
Дата добавления: 2018-09-22; просмотров: 1499; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
