Получение железа, никеля, хрома и марганца в промышленности.
Получение железа, никеля, хрома и марганца в промышленности.
Железо
Железная руда (30-40 % Fe) обогащается (65-70% Fe), из концентрата при 1300 градусах получают агломерат или окатыши, большие куски долбят и загружают с коксом и флюсом в доменную печь. В результате доменного процесса получается чугун (раствор угля в железе), практически не находящий применения и полностью перерабатываемый в сталь.
Более эффективно прямое восстановление оксидов железа. После обогащения руды (более 70 % Fe) из нее получают прочные окатыши, более прочные, чем при доменном процессе. Природный газ подвергают конверсии и получают смесь CO и H2. Печи работают по принципу противотока: сырье идет сверху, а снизу подается газ-восстановитель. Руда в печи не плавится, так как в печи температура около 850 градусов. В результате получается губчатое железо, содержащее около 90% Fe и 1,2-2% C.
Особо чистое железо получают:
Fe(CO)5(при нагревании)= Fe + 5CO (не знаю почему тут 5 после скобок у соли)
FeC2O4(при нагревании)= Fe + 2CO2
Никель
Руда Ni после обогащения подвергается обжигу, при этом получаемый NiO восстанавливается коксом в электропечах. Дальнейшая очистка металлов производится электролизом.
Хром
Поскольку основное применение хрома это изготовление сталей, то хромистый железняк восстанавливают коксом, не разделяя металлы и получая феррохром:
Fe(CrO2)2 + 4C (при нагревании)= Fe + 2Cr + 4CO
С целью получения самого металла хромистый железняк подвергают окислительному плавлению с поташем:
|
|
|
4Fe(CrO2)2 + 8K2CO3 + 7O2(при 1100 градусах)= 8CO2 + 2Fe2O3 + 8K2CrO4
Хромат калия хорошо растворим в воде, и его выщелачивают их смешанного продукта водой. Далее хромат переводят в бихромат:
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
Который восстанавливают до Cr2O3 коксом или серой:
K2Cr2O7 + 2C(при нагревании)= Cr2O3 + K2CO3 + CO
K2Cr2O7 + S(при нагревании)= Cr2O3 + K2SO4
Металл получают, восстанавливая Cr2O3 алюминием или кремнием. Возможно получение металлов и электролизом раствором соединений Cr(VI).
Марганец
Получают металл, восстанавливая рудный материал коксом:
MnO2 + 2C(при нагревании)= 2CO + Mn
Практикуется и совместное восстановление MnO2 с оксидами железа, при этом получается ферромарганец.
Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд.
Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд.
Свинец
Схема получения свинца: PbS обжигают и получается PbO, оксид восстанавливается CO при нагревании.
2PbS + 3O2 = 2PbO + 2SO2
PbO + CO(при нагревании)= Pb + CO2
Медь
В пирометаллургических методах сульфидную медную руду (после обогащения и концентрирования) плавят в окислительной атмосфере, при этом сульфиды железа окисляются, а сульфиды меди нет. Отделенный таким образом Cu2S продувают в конверторе воздухом и получают черновую медь(98,5% Cu). Её подвергают окислительной плавке с флюсами. Возможна дальнейшая очистка электролизом.
|
|
|
2Cu2S + 3O2 = 2Cu2O + 2SO2
2Cu2O + Cu2S = 3Cu + SO2
Цинк
Схема получения цинка: сульфид обжигают до оксида, оксид восстанавливается до чистого металла.
2ZnS + 3O2 = 2ZnO + 2SO2
ZnO + C(при нагревании)= Zn + CO
Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении).
Хлораты калия, натрия
4KClO3 =(t)= KCl + 3KClO4 2KClO3 =(t, MnO2)= 2KCl + 3O2
Примеры окислительной активности хлоратов
KClO3 + 3Mg =(t)= KCl + 3MgO NaClO3 + 5NaCl + 3H2SO4 = 3Na2SO4 + 3Cl2 + 3H2O
Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании.
Аммиакаты: Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком:
AgCl(т) + 2 NH3 . H2O = [Ag(NH3)2]Cl + 2 H2O
Cu(OH)2(т) + 4 NH3 . H2O = [Cu(NH3)4](OH)2 + 4 H2O
NiSO4 + 6 NH3 . H2O = [Ni(NH3)6]SO4 + 6 H2O
CoCl2 + 6 NH3(г) = [Co(NH3)6]Cl2
Разрушение [Ag(NH3)2]+ + 2Н+ → Ag+ + 2NH4+,
[Ni(NH3)6]SO4 + 3 H2SO4 = NiSO4 + 3 (NH4)2SO4
Водный раствор аммиака при взаимодействии с ионами меди (II) сначала осаждает основные соли переменного состава зеленого цвета, легкорастворимые в избытке реагента. При этом образуется аммиачный комплекс меди сине-фиолетового цвета: Cu2+ + 4NH4OH = [Cu(NH3)4]2+ + 4H2O
|
|
|
Гидроксокомплексы металлов:Men+ + mOH– = [Me(OH)m]n-m
Гидроксокомплексы образуются в реакциях протолиза из аквакомплексов:
[Al(H2O)6]3+ + H2O 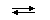 [Al(H2O)5(OH)]2+ + H3O+
[Al(H2O)5(OH)]2+ + H3O+
либо при растворении амфотерных гидроксидов в водных растворах гидроксидов щелочных металлов:
Zn(OH)2 + 2 OH = [Zn(OH)4]2
При рассмотрении способов разрушениягидроксокомплексов можно выделить несколько случаев.
1) При действии избытка сильной кислоты получаются две средних соли и вода:
Na[Al(OH)4] + 4HCl (изб.) = NaCl + AlCl3 + 4H2O,
K3[Cr(OH)6] + 6HNO3 (изб.) = 3KNO3 + Cr(NO3)3 + 6H2O.
2) При действии сильной кислоты (в недостатке) получаются средняя соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3  + H2O,
+ H2O,
K3[Cr(OH)6] + 3HNO3 = 3KNO3 + Cr(OH)3  + 3H2O.
+ 3H2O.
3) При действии слабой кислоты получаются кислая соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3  + H2O,
+ H2O,
K3[Cr(OH)6] + 3H2CO3 = 3KHCO3 + Cr(OH)3  + 3H2O.
+ 3H2O.
Дата добавления: 2018-08-06; просмотров: 512; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
