Классификация по влиянию на обмен веществ
| Белковый обмен | Инсулин, СТГ, АКТГ и кортизол, ТТГ и тироксин |
| Липидно-углеводный обмен | Инсулин, СТГ, АКТГ и кортизол, ТТГ и тироксин, адреналин, глюкагон |
| Водно-солевой обмен | Альдостерон, АДГ |
| Обмен кальция и фосфора | Кальцитонин, паратгормон, кальцитриол |
| Репродуктивная функция | Гонадотропные гормоны и эстрадиол, эстриол, прогестерон, тестостерон, пролактин, окситоцин |
Классификация по месту синтеза
| Гипоталамус | Кортиколиберин, тиреолиберин, гонадолиберин, соматолиберин, меланолиберин. Пролактостатин, соматостатин, меланостатин. АДГ (вазопрессин), окситоцин. |
| Гипофиз | СТГ (соматотропин), АКТГ (кортикотропин), ЛТГ (лактотропин), ТТГ (тиреотропин), МСГ (меланотропин), ФСГ (фоллитропин), ЛГ (лютеотропин). |
| Периферические железы | Инсулин, глюкагон, кортизол, тироксин, адреналин, альдостерон, эстрадиол, эстриол, тестостерон, кальцитонин, паратгормон. |
Принципы передачи гормонального сигнала в клетках-мишенях
Известны два основных типа передачи гормонального сигнала клеткам-мишеням. Липофильные гормоны проникают в клетку, а затем поступают в ядро. Гидрофильные гормоны оказывают действие на уровне кпеточной мембраны.
Липофильные гормоны, к которым относятся стероидные гормоны, тироксин и ретиноевая кислота, свободно проникают через плазматическую мембрану внутрь клетки, где взаимодействуют с высокоспецифическими рецепторами. Гормон-рецепторный комплекс в форме димера связывается в ядре с хроматином и инициирует транскрипциюопределенных генов (регуляция транскрипции: см. с. 120, 366). Усиление или подавление синтеза мРНК (mRNA) влечет за собой изменение концентрации специфических белков (ферментов), определяющих ответ клетки на гормональный сигнал.
|
|
|
Гормоны, являющиеся производными аминокислот, а также пептидные и белковые гормону, образуют группу гидрофильных сигнальных веществ (см. с. 368). Эти вещества связываются со специфическими рецепторами на внешней поверхности плазматической мембраны. Связывание ropмона передает сигнал на внутреннюю поверхность мембраны и тем самым запускает синтез вторичных мессенджеров (посредников). Молекулы-посредники потенциируют клеточный ответ на действие гормона
21 Гормоны-сигнальные вещества, образующиеся а клетках эндокринных желез. После синтеза гормоны поступают в кровь и переносятся к органам-мишеням, где выполняют определенные биохимические и физиологические регуляторные функции.А. Система гормональной регуляции. Гормоны синтезируются в виде предшественников, прогормонов и депонируются, в специализ клетках эндокринных желез. Отсюда они поступают в кровоток. Большинство горм переносится в виде комплексов с плазматическими белками-переносчиками гормонов. Гормоны разрушаются соответствующими ферментами, обычно в печени. гормоны и продукты их деградации выводятся из организма экскреторной системой, обычно почками.
|
|
|
В органах-мишенях имеются рецепторы, способные связывать гормоны и воспринимать гормональный сигнал. После связывания гормонов рецепторы передают информацию клетке и запускают цепь биохимических реакций, определяющих клеточный ответ на действие гормона.Б.
Известны 2 основных типа передачи гормонального сигнала клеткам-мишеням.Липофильные гормоны проникают в клетку, а затем поступают в ядро тироксин и ретиноевая кислота . Гидрофильные гормоны оказывают действие на уровне кпеточной мембраны. связываются со специфическими рецепторами на внешней поверхности плазматической мембраны. Связывание ropмона передает сигнал на внутреннюю поверхность мембраны и тем самым запускает синтез вторичных мессенджеров (посредников).
22Если молекула гормона липофильна, то она может проникать через липидный слой наружной мембраны клеток-мишеней. Если молекула имеет большие размеры или является полярной, то ее проникновение внутрь клетки невозможно. Поэтому для липофильных гормонов рецепторы находятся внутри клеток-мишеней, а для гидрофильных - рецепторы находятся в наружной мембране.
|
|
|
Для получения клеточного ответа на гормональный сигнал в случае гидрофильных молекул действует внутриклеточный механизм передачи сигнала.этопроисх с участием посредников. Это циклические нуклеотиды (цАМФ и цГМФ), инозитолтрифосфат, кальций-связывающий белок - кальмодулин, ионы кальция, ферменты, участвующие в синтезе циклических нуклеотидов, а также протеинкиназы - ферменты фосфорилированиябелков. Они участвуют в регуляции активности отдельных ферментных систем в клетках-мишенях. Сигнальные G-белки являются универсальными посредниками при передаче гормональных сигналов от рецепторов клеточной мембраны к эффекторным белкам
23Механизмы регуляции могут быть гуморальными-т.е. регуляция химическими соединениями, циркулирующими в крови и других жидкостях организма и вырабатываемыми специальными железами внутренней секреции-эндокринными железами.
Роль центра играет гипоталамус. В ГС локализованы нервные ядра и центры, имеющие непосредственное отношение к регуляции голода и насыщения, теплообмена, осморегуляции. В ГС нейроны, реагирующие на изменения концентрации глюкозы, водородных ионов, температуры тела, осмотического давления, т.е. важнейших гомеостатических констант внутренней среды организма. В ядрах ГС осущ анализ состояния внутренней среды организма и формируются управляющие сигналы, которые посредством эфферентных систем приспосабливают ход метаболизма к потребностям организма.
|
|
|
Либерины (рилизинг-гормоны)-нейрогормоны, секретируемые ГС и стимулирующие выделение тропных гормонов гипофиза. Статины снижают уровень холестерина. Либерины и статины синтезируются нейронами переднего и среднего ГС
24В перед. доле (аденогипофизе )– синетезируютсятропные г.
Соматоропин (СТГ – гормон роста) – стимулирует синтез белка, вызывая рост тканей и костей.
Фоллитропин (ФСГ) - стимулирует сперматогенез и овогенез.
Лютропин (ЛГ) – стимулирует синтез андрогенов – у М, усиливает синтез женск.пол.г и разрыв фолликул.
Пролактин (ЛТГ-лактикотропный г.)-рост молоч.ж, образование молока, синтез прогестерона, контр. беременность.
Тиротропин – (ТТГ – тиротропный г.) – стимулирует синтез йодированных гормонов щитовд.ж (при недостатке I в кр.)
Кортикотропин – (АКТГ-адренокортикотропный г.)- стимулирует синтез кортикостеройдов, и расщепление жира
25.Гормоны задней доли гипофиза - вазопрессин и окситоцин. Оба гормона продуцируются в гипоталамусе, но сохраняются и высвобождаются в задней доле гипофиза, лежащей книзу от гипоталамуса. Вазопрессин поддерживает тонус кровеносных сосудов и является антидиуретическим гормоном, влияющим на водный обмен. Окситоцин вызывает сокращение матки и «запускает» лактацию после родов.Оба гормоны представляют собой нонапептиды:
 Вазопрессин отличается от окситоцина двумя аминокислотами: он содержит в положении 3 от N-конца фенилаланин вместо изолейцина и в положении 8 – аргинин вместо лейцина. Основной биологический эффект окситоцина у млекопитающих связан со стимуляцией сокращения гладких мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрецию молока. Вазопрессин стимулирует сокращение гладких мышечных волокон сосудов, оказывая сильное вазопрессорное действие, однако основная роль его в организме сводится к регуляции водного обмена, откуда его второе название антидиуретического гормона. В небольших концентрациях (0,2 нг на 1 кг массы тела) вазопрессин оказывает мощное антидиуретическое действие – стимулирует обратный ток воды через мембраны почечных канальцев. В норме он контролирует осмотическое давление плазмы крови и водный баланс организма человека. При патологии, в частности атрофии задней доли гипофиза, развивается несахарный диабет – заболевание, характеризующееся выделением чрезвычайно больших количеств жидкости с мочой. При этом нарушен обратный процесс всасывания воды в канальцах почек. Относительно механизма действия нейрогипофизарных гормонов известно, что гормональные эффекты, в частности вазопрессина, реализуются через аденилатциклазную систему.
Вазопрессин отличается от окситоцина двумя аминокислотами: он содержит в положении 3 от N-конца фенилаланин вместо изолейцина и в положении 8 – аргинин вместо лейцина. Основной биологический эффект окситоцина у млекопитающих связан со стимуляцией сокращения гладких мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрецию молока. Вазопрессин стимулирует сокращение гладких мышечных волокон сосудов, оказывая сильное вазопрессорное действие, однако основная роль его в организме сводится к регуляции водного обмена, откуда его второе название антидиуретического гормона. В небольших концентрациях (0,2 нг на 1 кг массы тела) вазопрессин оказывает мощное антидиуретическое действие – стимулирует обратный ток воды через мембраны почечных канальцев. В норме он контролирует осмотическое давление плазмы крови и водный баланс организма человека. При патологии, в частности атрофии задней доли гипофиза, развивается несахарный диабет – заболевание, характеризующееся выделением чрезвычайно больших количеств жидкости с мочой. При этом нарушен обратный процесс всасывания воды в канальцах почек. Относительно механизма действия нейрогипофизарных гормонов известно, что гормональные эффекты, в частности вазопрессина, реализуются через аденилатциклазную систему.
26. Гормоны щитовидной железы делят на две группы: йодированные гормоны — тироксин (тетрайодтиронин), трийодтиронин, и неиодированный гормон — тиреокальцитонин (кальцитонин). Йодированные гормоны образуются в фолликулах железистой ткани.
Биосинтез тироксина и трийодтиронина осуществляется за счет йодирования аминокислоты тирозина, поэтому в щитовидной железе происходит активное поглощение йода. Содержание йода в фолликулах в 30 раз превышает его концентрацию в крови, а при гиперфункции щитовидной железы это соотношение становится еще больше. Поглощение йода осуществляется за счет активного транспорта. После соединения тирозина, входящего в состав тиреоглобулина, с атомарным йодом образуется монойодтирозин и дийодтирозин. За счет соединения двух молекул дийодтирозина образуется тетрайодтиронин, или тироксин; конденсация моно- и дийодтирозина приводит к образованию трийодтиронина. В дальнейшем в результате действия протеаз, расщепляющих тиреоглобулин, происходит высвобождение в кровь активных гормонов.
Тироксин (тетрайодтиронин)-производное аминокислоты тирозина, имеет четыре атома йода, синтезируется в фолликулярной ткани.
 Тироксин и трийодтиронин связываются с белками плазмы. Попав в кровь, 99% тироксина и трийодтиронина немедленно связываются с белками плазмы крови, синтезируемыми печенью, главным образом с тироксин-связывающим глобулином и в меньшей степени — с тироксин-связывающим преалъбумином и альбумином.
Тироксин и трийодтиронин связываются с белками плазмы. Попав в кровь, 99% тироксина и трийодтиронина немедленно связываются с белками плазмы крови, синтезируемыми печенью, главным образом с тироксин-связывающим глобулином и в меньшей степени — с тироксин-связывающим преалъбумином и альбумином.
Влияние на обмен веществ. Тиреоидные гормоны воздействуют на обмен белков, жиров, углеводов, минеральный обмен. Тироксин усиливает расходование всех видов питательных веществ, повышает потребление тканями глюкозы. Под влиянием гормонов щитовидной железы заметно уменьшаются запасы жира и гликогена в печени. Многообразное действие йодированных гормонов на обмен веществ связано с их влиянием на внутриклеточные процессы окисления и образования белка.
Особенности взаимодействия тиротропного гормона с щитовидной железой.ТТГ взаимодействует с рецепторами плазматических мембран тироцитов щитовидной железы.Рецептор к ТТГ имеет 7 трансмембранных фрагментов и отличается длинным внеклеточным доменом, который содержит большое количество лейциновых остатков и отвечает за связывание с гормоном. Рецептор к ТТГ локализуется на базально-латеральной области тироцита.Ген, ответственный за синтез рецептора к ТТГ,экспрессируется в виде двух субъединиц: внеклеточная a- и мембранная b-субъединица.Результатом взаимодействия ТТГ с рецептором является активация аденилатциклазы и стимуляция образования цАМФ. У человека ТТГ активирует также и фосфолипазу С с последующим увеличением вторичных мессенджеров инозитолтрифосфата и диацилглицерина. Таким образом, в передаче биологического действия ТТГ участвуют несколько вторичных мессенджеров: цАМФ, инозитолтрифосфат и диацилглицерин.
Тиреотоксикоз возникает вследствие повышенной продукции йодтиронинов.Характерные признаки тиреотоксикоза: увеличение основного обмена, учащение сердцебиений, мышечная слабость, снижение массы тела (несмотря на повышенный аппетит) , потливость, повышение температуры тела, тремор и экзофтальм (пучеглазие). Эти симптомы отражают одновременную стимуляцию йодтиронинами как анаболических (рост и дифференцировка тканей), так и катаболических (катаболизм углеводов, ли-пидов и белков) процессов.
Гипотиреоз развивается вследствие недостаточности йодтиронинов. Обычно гипотиреоз связан с недостаточностью функции щитовидной железы, но может возникать и при заболеваниях гипофиза и гипоталамуса.Наиболее тяжёлые формы гипотиреоза, сопровождающиеся слизистым отёком кожи и подкожной клетчатки, обозначают термином "микседема" (от греч. туха - слизь, oedema - отёк). Отёчность обусловлена избыточным накоплением гликозаминогликанов и воды. В подкожной клетчатке накапливается глюкуроновая и в меньшей степени хондроитинсерная кислоты. Избыток гликозаминогликанов вызывает изменения коллоидной структуры межклеточного матрикса, усиливает его гидрофильность и связывает ионы натрия, что приводит к задержке воды.Характерные проявления заболевания: снижение частоты сердечных сокращений, вялость, сонливость, непереносимость холода, сухость кожи. Эти симптомы развиваются вследствие снижения основного обмена, скорости гликолиза, мобилизации гликогена и жиров, потребления глюкозы мышцами, уменьшения мышечной массы и снижения теплопродукции.
Гипотиреоз может быть также результатом недостаточного поступления йода в организм - эндемический зоб. Эндемический зоб (нетоксический зоб) часто встречается у людей, живущих в районах, где содержание йода в воде и почве недостаточно. Если поступление йода в организм снижается (ниже 100 мкг/сут), то уменьшается продукция йодтиронинов, что приводит к усилению секреции ТТГ (из-за ослабления действия йодтиронинов на гипофиз по механизму отрицательной обратной связи), под влиянием которого происходит компенсаторное увеличение размеров щитовидной железы (гиперплазия), но продукция йодтиронинов при этом не увеличивается.
27. Инсулин - полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками
СИНТЕЗ.Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи. На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для "созревания" гормона . По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn2+.
Секреция инсулина происходит постоянно.Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л.Стимуляция синтеза инсулина происходит от момента проникновения глюкозы в клетку до трансляции инсулиновой мРНК. Она регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой мРНК и увеличением трансляции инсулиновой мРНК.
Стимуляция секреции инсулина
1. После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе),
2. Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3. В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4. Накопление АТФ стимулирует закрытие ионных K+-каналов, что приводит к деполяризации мембраны,
5. Деполяризация мембраны приводит к открытию потенциал-зависимых Ca2+-каналов и притоку ионов Ca2+ в клетку,
6. Поступающие ионы Ca2+ активируют фосфолипазу C и запускают кальций-фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол-трифосфата,
7. Появление инозитол-трифосфата в цитозоле открывает Ca2+-каналы в эндоплазматической сети, что ускоряет накопление ионов Ca2+ в цитозоле,
8. Резкое увеличение концентрации в клетке ионов Ca2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9. Далее происходит распад кристаллов, отделение ионов Zn2+ и выход молекул активного инсулина в кровоток.
Инсулин - главный анаболический гормон. Он участвует в регуляции метаболизма, транспорта глюкозы, аминокислот, ионов, в синтезе белков. Инсулин влияет также на процессы репликации и транскрипции.
Влияние на обмен веществ
Углеводный:
Основное влияние - вместе с глюкагоном поддерживает нормальный уровень глюкозы в крови (артериальная кровь - 3,5-5,5 мМ/л, венозная кровь - 6,5).
Активирует регуляторные ферменты синтеза гликогена (гликогенсинтаза), гликолиза (глюкокиназа, ФФК, пируваткиназа), ПФП (глюкоза-6Ф-дегидрогеназа).
Липидный:
Стимулирует депонирование жиров (увеличивает синтез ЛП-липазы)
Стимулирует синтез жиров в печени и жировой ткани
Способствует синтезу жиров из углеводов в жировой ткани (активирует ГЛЮТ-4)
Активирует синтез жирных кислот (ацетил-КоА-карбоксилаза)
Активирует синтез холестерола (ГМГ-редуктаза).
Белковый:
Стимулирует синтез белков (анаболический эффект)
Увеличивает транспорт аминокислот в клетки
Усиливает синтез ДНК и РНК.
Стимулирует синтез глюкозы.
28.Глюкагон
Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клетках островков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. Основные клетки-мишени глюкагона - печень и жировая ткань. Связываясь с рецепторами на плазматической мембране клеток-мишеней, глюкагон повышает содержание цАМФ (см. раздел 5). В гепатоцитах это приводит к активации фосфорилазы гликогена и к снижению активности гликогенсинтазы. В результате ускоряется мобилизация гликогена. Фосфорилированиепируваткиназы и БИФ вызывает торможение гликолиза и ускорение глюконеогенеза. Кроме того, глюкагон стимулирует глюконеогенез, индуцируя синтез ферментов: глюкозо-6-фосфатазы, фосфоенол-пируваткарбоксикиназы, фруктозо-1,6-бисфосфатазы). В клетках жировой ткани глюкагон через аденилатциклазный каскад активирует гормончувствительную ТАГ-липазу и стимулирует липолиз (см. раздел 8). Таким образом, в противоположность инсулину глюкагон стимулирует мобилизацию основных энергоносителей - углеводов и жиров. Глюкагон: во-первых, он ускоряет расщепление белков в печени; во-вторых, увеличивается активность ряда ферментов, таких как фруктозо-1,6-бисфосфатаза, фосфоенолпируваткарбоксикиназа, глюкозо-6-фосфатаза. также происходит увеличение поступления глюкозы в кровь.Глюкагон стимулирует липолиз в липоцитах, увеличивая тем самым поступление в кровь глицерола и высших жирных кислот. В печени гормон тормозит синтез жирных кислот и холестерола из ацетил-КоА, а накапливающийся ацетил-КоА используется для синтеза ацетоновых тел. Таким образом, глюкагон стимулирует кетогенез.
29 сахарный диабет- проявление абсолютной или недостаточности инсулина. Типы и проявления сахарного диабета. Нарушения углеводного и энергетического обменов. Нарушения обмена липидов, причина и последствия кетонемии. Нарушения обмена белков и аминокислот. Биохимические методы диагностики сахарного диабета. Гликозилированные белки.
Абсолютная недостаточность обусловлена уменьшением выработки инсулина В-клетками островков Лангерганса поджелудочной железы в результате их дистрофических изменений или некроза под влиянием повреждающих факторов или нарушением синтеза инсулина, приводящим к инкреции гормона со сниженной биологической активностью.
Абсолютной инсулиновой недостаточности способствуют аутоиммунные процессы (нарушение системы иммуногенеза, приводящее к развитию процессов аутоиммуноагрессии с избирательным поражением В-клеток), вирусная инфекция, воспалительные заболевания, фиброз или кальциноз поджелудочной железы, циркуляторные изменения (атеросклероз), опухолевые процессы.
Абсолютная инсулиновая недостаточность является причиной развития сахарного диабета лишь у 10% больных. В большинстве случаев возникновение заболевания происходит при нормальной и даже повышенной концентрации эндогенного инсулина в крови. Причиной развития обменных нарушений в этих случаях является относительная инсулиновая недостаточность, в основе которой лежит снижение чувствительности инсулинозависимых тканей к действию эндогенного инсулина - тканевая инсулинорезистентность.
Выделяют два основных типа сахарного диабета:
1. Инсулинзависимый сахарный диабет (ИЗСД, диабет I типа) – диабет детей и подростков (ювенильный), его доля составляет около 20% от всех случаев СД.
2. Инсулиннезависимый сахарный диабет (ИНЗСД, диабет II типа) – диабет взрослых, его доля – около 80%.
Подразделение типов СД на взрослый и ювенильный не всегда корректно, так как встречаются случаи развития ИНЗСД в раннем возрасте, также ИНЗСД может переходить в инсулинзависимую форму.
НАРУШЕНИЯ ОБМЕНА ВЕЩЕСТВ
Углеводный обмен
Нарушения углеводного обмена могут проявляться гипергликемией, глюкозурией и гиперлактатацидемией.
• Гипергликемия возникает вследствие недостаточности эффектов инсулина и нарушения утилизации глюкозы клетками.
• Глюкозурия является, в основном, следствием гипергликемии.
• Гиперлактатацидемия - развивается вследствие торможения катаболизма лактата в цикле Кребса, нарушения ресинтеза гликогена из лактата.
Обмен белков
Нарушения белкового обмена при СД характеризуются гиперазотемией и азотурией.
• Гиперазотемия - увеличение содержания в крови небелковых азотистых соединений. Гиперазотемия обусловлена усилением катаболизма белка, который при дефиците глюкозы в клетках служит источником энергии. Небелковый азот представлен азотом мочевины, аминокислот, мочевой кислоты, креатинина, аммиака (остаточный азот).
• Азотурия - повышение экскреции азотистых соединений с мочой вследствие гиперазотемии.
Липидный обмен. Нарушения жирового обмена при СД проявляются гиперлипидемией, кетонемией, кетонурией. • Гиперлипидемия - увеличение содержания в крови липидов выше нормы (более 8 г/л). Это обусловлено активацией липолиза, торможением транспорта и утилизации липидов клетками, снижением активности ЛПЛазы. • Кетонемия - повышение концентрации в крови КТ выше нормы (более 2,5 мг%). К КТ относят ацетон, ацетоуксусную и β-оксимасляную кислоты. Кетонемия, как правило, развивается при дефиците инсулина и обусловлена активацией окисления ВЖК в клетках с образованием КТ. тяжелые формы кетонемии при диабете,, сопровождающиеся развитием ацидоза и возникновением комы. • Кетонурия - выделение КТ из организма с мочой - симптом неблагоприятного течения СД. Причина: высокая концентрация в крови КТ, которые хорошо фильтруются в почках.
Методы диагностики сахарного диабета подразделяются на основные и дополнительные. К основным способам исследования относятся: 1Анализ на уровень сахара в крови; 2 Диагностика на количество гликозилированного гемоглобина; 3Исследование на глюкозотолерантность; 4 Анализ на наличие сахара в моче; 5 Исследование мочи и крови на присутствие кетоновых тел и их концентрацию; 6 Диагностика уровня фруктозамина.
Дополнительные методы диагностики, которые необходимы для уточнения диагноза: 1) Исследование на уровень инсулина в крови; 2)Анализ на аутоантитела к бета-клеткам поджелудочной железы, вырабатывающим инсулин; 3) Диагностика на проинсулин; 4)Анализ на грелин,адипонектин, лептин, резистин; 5)Исследование на ИИС-пептид; 6)HLA-типирование.
Основной механизм повреждения тканей - гликозилирование белков - это неферментативная реакция глюкозы со свободными аминогруппами белковой молекулы (Лиз, Арг, N-концевая аминокислота):
Неферментативное гликозилирование различных белков, изменение их свойств и активация их синтеза за счет избытка энергии:
увеличивается синтез гликопротеинов базальной мембраны почечных клубочков, что приводит к окклюзии капилляров и нарушению фильтрации,
увеличивается синтез гликопротеинов в стекловидном теле и сетчатке глаза, что вызывает отек сетчатки и кровоизлияния,
гликозилированные белки хрусталика объединяются в крупные агрегаты, рассеивающие свет, что вызывает помутнение хрусталика и катаракту,
гликозилирование гемоглобина в эритроцитах, образование гликозилированного гемоглобина HbA1C,
гликозилирование белков свертывающей системы, что увеличивает вязкость крови,
гликозилирование белков ЛПНП уменьшает их связывание с рецепторами и повышает концентрацию ХС в крови, что вызывает макроангиопатии и развитие атеросклерозасосудов мозга, сердца, почек, конечностей.
гликозилирование белков ЛПВП, что усиливает их сродство к рецепторам и быструю элиминацию из кровотока,
в конечном итоге возникают макроангиопатии, развивается атеросклероз сосудов мозга, сердца, почек, конечностей. Характерно в основном для ИНЗСД.
30 Гормоны мозгового слоя надпочечников. Строение, биосинтез, метаболлические эффекты адреналина и норадреналина. Особенности действия на обмен углеводов и липидов в печени и скелетных мышцах.
Мозговой слой надпочечников вырабатывает гормоны, относящиеся к катехоламинам. Основной гормон – адреналин, вторым по значимости является предшественник адреналина – норадреналин.
Значение адреналина и норадреналина
Адреналин выполняет функцию гормона, он поступает в кровь постоянно, при различных состояниях организма (кровопотере, стрессе, мышечной деятельности). Возбуждение симпатической нервной системы приводит к повышению поступления в кровь адреналина и норадреналина. Адреналин влияет на углеродный обмен, ускоряет расщепление гликогена в печени и мышцах, расслабляет бронхиальные мышцы, угнетает моторику ЖКТ и повышает тонус его сфинктеров, повышает возбудимость и сократимость сердечной мышцы. Он повышает тонус кровеносных сосудов, действует сосудорасширяюще на сосуды сердца, легких и головного мозга. Адреналин усиливает работоспособность скелетных мышц.
Повышение активности адреналовой системы происходит под действием различных раздражителей, которые вызывают изменение внутренней среды организма. Адреналин блокирует эти изменения.
Норадреналин выполняет функцию медиатора, он входит в состав симпатина – медиатора симпатической нервной системы, он принимает участие в передаче возбуждения в нейронах ЦНС.
Секреторная активность мозгового слоя надпочечников регулируется гипоталамусом. 
Биосинтез катехоламинов (адреналин и норадреналин) может быть представлен в виде следующей упрощенной схемы:
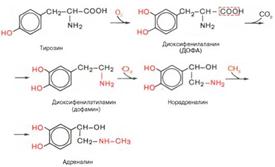
Адреналин, и норадреналин быстро разрушаются в организме; с мочой выделяются неактивные продукты их обмена, главным образом в виде 3-метокси-4-оксиминдальной кислоты, оксоадренохрома, метоксинорадреналина и метоксиадреналина. Эти метаболиты содержатся в моче преимущественно в связанной с глюкуроновой кислотой форме. Ферменты, катализирующие указанные превращения катехоламинов, выделены из многих тканей и достаточно хорошо изучены, в частности моно-аминоксидаза (МАО), определяющая скорость биосинтеза и распада катехоламинов, и катехолметилтрансфераза, катализирующая главный путь превращения адреналина, т.е. о-метилирование за счет S-аденозилметиони-на. Структура двух конечных продуктов распада катехоламинов:

31 Мужские половые гормоны. Структура тестостерона и андростендиона, регуляция секреции, биологическая роль. влияние на обмен веществ, особенности транспорта в крови и метаболизма в жировой ткани и печени. Стероидные анаболизаторы.
Из мочи мужчин был выделен гормон в кристаллическом виде- андростерон (от греч. andros – мужчина) Позже из мочи мужчин был выделен еще один гормон – дегидроэпиандростерон, который обладал меньшей биологической активностью.
гормон, выделенный из тканисеменников, оказался активнее андростерона почти в 10 раз и был идентифицирован в виде тестостерона (от лат. testis –семенник). Строение всех трех андрогенов может быть представлено в следующем виде:

Андрогены в отличие от эстрогенов имеют две ангулярныеметильные группы (у С10- и С13-атомов); в противоположность ароматическому характеру кольца А эстрогенов тестостерон, кроме того, содержит кетон-ную группу (как и кортикостероиды).
Биосинтез андрогенов осуществляется главным образом в семенниках и частично в яичниках и надпочечниках. Основными источниками и предшественниками андрогенов, в частности тестостерона, являются уксусная кислота и холестерин. Существуют экспериментальные доказательства, что путь биосинтеза тестостерона от стадии холестерина включает несколько последовательных ферментативных реакций через прегненолон и 17-α-окси-прегненолон (см. ранее). Регуляция биосинтеза андрогенов в семенниках осуществляется гонадотропными гормонами гипофиза (ЛГ и ФСГ), хотя механизм их первичного эффекта до сих пор не раскрыт; в свою очередь андрогены регулируют секрецию гонадотропинов по механизму отрицательной обратной связи, блокируя соответствующие центры в гипоталамусе.
Биологическая роль андрогенов в мужском организме в основном связана с дифференцировкой и функционированием репродуктивной системы, причем в отличие от эстрогеновандрогенные гормоны уже в эмбриональном периоде оказывают существенное влияние на дифференцировку мужских половых желез, а также других тканей, определяя характер секрециигонадотропных гормонов у взрослых. Во взрослом организмеандрогены регулируют развитие мужских вторичных половых признаков, сперматогенез в семенниках и т.д. Следует отметить, что андрогены оказывают значительное анаболическое действие, выражающееся в стимуляции синтеза белка во всех тканях , но в большей степени в мышцах. Для реализации анаболического эффекта андрогенов необходимым условием является присутствие соматотропина. Имеются данные, свидетельствующие об участии андрогенов в регуляции биосинтеза макромолекул в женских репродуктивных органах, в частности синтеза мРНК в матке.
Распад мужских половых гормонов в организме осуществляется в основном в печени по пути образования 17-кетостероидов (см. ранее). Период полураспада тестостерона не превышает нескольких десятков минут. У взрослых мужчин с мочойэкскретируется не более 1% неизмененного тестостерона, что свидетельствует о его расщеплении преимущественно в печенидо конечных продуктов обмена. Дегидроэпиандростерон в основном экскретируется с мочой в неизмененном виде. При некоторых заболеваниях увеличивается экскреция с мочойгидроксилированных форм андро-генов при эквивалентном снижении выделения классических форм 17-кето-стероидов. Следует указать также на возможность образования 17-кетосте-роидов из тестостерона у женщин. Отмечен высокий уровень частоты рака молочных желез у женщин с пониженной экскрецией 17-кетостероидов. Тестостерон и его синтетические аналоги (тестостерон-пропионат) нашли применение в медицинской практике в качестве лекарственных препаратов при лечении раковой опухоли молочной железы.
32 Женские половые гормоны. Структура эстрадиола, эстрона, эстриола, биологическая роль, влияние на обмен веществ. Прогестерон : структура, биологическая роль. Изменения содержания эстрогенов и прогестерона в крови, в отдельные фазы менструального цикла женщин. Регуляция секреции эстрогенов и прогестинов.
Основным местом синтеза женских половых гормонов – эстрогенов – являются яичники и желтое тело; доказано также образование этих гормонов в надпочечниках, семенниках и плаценте. Впервые эстрогены обнаружены. в моче беременных, далее был выделен из мочи эстрон, который оказался первым стероидным гормоном, полученным в кристаллическом виде.
В настоящее время открыты 2 группы женских половых гормонов, различающихся своей химической структурой и биологической функцией: эстрогены (главный представитель – эстрадиол) и прогестины (главный представитель – прогестерон). Химическое строение основных женских половых гормонов:

Наиболее активный эстроген – эстрадиол, синтезируется преимущественно в фолликулах; два остальных эстрогенаявляются производными эстра-диола и синтезируются также в надпочечниках и плаценте. Все эстрогены состоят из 18 атомов углерода. Секреция эстрогенов и прогестерона яичником носит циклический характер, зависящий от фазы полового цикла: в первой фазе цикла синтезируются в основном эстрогены, а во второй – преимущественно прогестерон.
Предшественником этих гормонов, как и кортикостероидов, в организме является холестерин, который подвергается последовательным реакциям гидроксилирования, окисления и отщепления боковой цепи с образованием прегненолона. Завершается синтез эстрогенов уникальной реакцией ароматизации первого кольца, катализируемой ферментным комплексом микросом ароматазой. Предполагают, что процесс ароматизации включает минимум три оксидазные реакции и все они зависят от цито-хрома Р-450.
Следует указать, что во время беременности в женском организме функционирует еще один эндокринный орган, продуцирующий эстрогены и прогестерон,– плацента. Установлено, что одна плацента не может синтезировать стероидные гормоны и функционально полноценным эндокринным органом, скорее всего, является комплексплаценты и плода – фетоплацентарный комплекс (от лат. foetus – плод). Особенность синтеза эстрогеновзаключается также в том, что исходный материал – холестерин – поставляется организмом матери; в плацентеосуществляются последовательные превращения холестерина в прегненолон и прогестерон. Дальнейший синтез осуществляется только в тканях плода.
Ведущую роль в регуляции синтеза эстрогенов и прогестерона играют гонадотропные гормоны гипофиза(фоллитропин и лютропин), которые опосредованно, через рецепторы клеток яичника и систему аденилатцик-лаза–цАМФ и, вероятнее всего, путем синтеза специфического белка, контролируют синтез гормонов. Основная биологическая роль эстрогенов и прогестерона, синтез которых начинается после наступления половой зрелости, заключается в обеспечении репродуктивной функции организма женщины. В этот период они вызывают развитие вторичных половых признаков и создают оптимальные условия, обеспечивающие возможность оплодотворения яйцеклетки после овуляции. Прогестерон выполняет в организме ряд специфических функций: подготавливает слизистую оболочку матки к успешной имплантации яйцеклетки в случае ее оплодотворения, а при наступлении беременности основная роль – сохранение беременности; оказывает тормозящее влияние на овуляцию и стимулирует развитие ткани молочной железы. Эстрогены оказывают анаболическое действие на организм, стимулируя синтез белка.
Распад эстрогенов, по-видимому, происходит в печени, хотя природа основной массы продуктов их обмена, выделяющихся с мочой, пока не выяснена. Они экскретируются с мочой в виде эфиров с серной или глюкуроновой кислотой, причем эстриол выделяется преимущественно в виде глюкуронида, а эстрон – эфира с серной кислотой. Прогестерон сначала превращается в печени в неактивный прегнандиол, который экскре-тируется с мочой в виде эфира с глюкуроновой кислотой.
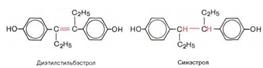
В медицинской практике широкое применение получили природные гормоны и синтетические препараты, обладающие эстрогенной активностью, которые в отличие от первых не разрушаются в пищеварительном тракте. К синтетическим эстрогенам относятся диэтилстильбэстрол и син-эстрол, являющиеся производными углеводородастильбена.
Дата добавления: 2018-08-06; просмотров: 463; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
