Ферментов на энергию активации реакции
Для того, чтобы заставить субстраты вступить в реакцию, необходима энергия, она называется энергией активации (ΔG‡). Чем больше требуемая энергия активации, тем ниже скорость реакции при данной температуре. Ферменты, действуя как катализаторы, снижают энергию активации, которая требуется для того, чтобы могла произойти реакция. Они повышают общую скорость реакции, не изменяя в сколько-нибудь значительной степени температуру, при которой эта реакция протекает.
Фермент, соединяясь с субстратом, образует короткоживущий фермент-субстратный комплекс (E-S-комплекс). В таком комплексе шанс на то, что реакция произойдет, значительно возрастают. По завершении реакции E-S-комплекс распадается на продукт (или продукты) и фермент. Фермент в реакции не изменяется: по окончании реакции он остается таким же, каким был до нее, и может теперь взаимодействовать с новой молекулой субстрата.
Фермент + Субстрат → E-S-комплекс → Фермент/Продукт(ы)
Механизм действия холинэстеразы
Природными субстратами ХЭ являются ацетилхолин (АцХ),сложный эфир уксусной кислоты и холина, и бутирилхолин, сложный эфир масляной кислоты и холина. ХЭ катализирует гидролиз
субстратов с образованием соответствующей кислоты и холина.
В активном центре ХЭ локализованы:
• «карман», служащий для связывания ацильного остатка молекулы субстрата за счет гидрофобного взаимодействия с валином;
|
|
|
• эстеразный центр, включающий «каталитическую триаду»: серин, гистидин, глутамин;
• анионный центр, в состав которого входит остаток триптофана.
Он связывает часть субстрата, содержащую четвертичный азот.Кроме того, в молекуле фермента имеется периферический анионный центр, локализованный вблизи края щели. Он содержит
аспарагин, несущий положительно заряженную амидную группу и ароматическую аминокислоту триптофан. Субстрат имеет более высокое сродство к периферическому центру, чем эстеразному,и его присоединение к периферическому центру вызывает активацию фермента.
Номенклатура и классификация. Характеристика отдельных классов и подклассов ферментов.
По типу катализируемых реакций ферменты подразделяются на 6 классов .Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
|
|
|
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
13.Определение активности ферментов
о количестве ферментов судят по скорости катализируемой реакции в определенных согласованных условиях измерения.
При оптимальных условиях: температура, рН среды и полном насыщении фермента субстратом, скорость катализируемой реакции прямо пропорциональна концентрации фермента.
О скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции. Для выражения концентрации фермента и количественной оценки его активности в условных единицах комиссией по ферментам Международного биохимического союза была рекомендована стандартная международная единица Е.
|
|
|
Единицы ферментативной активности
За единицу ферментативной активности (Е) принимают количество фермента, катализирующего превращение 1 микромоля субстрата за 1 мин:
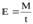 , (1)
, (1)
где М – количество превращенного субстрата, мкмоль;
t – время инкубации, мин.
предложено выражать активность фермента в каталах (кат, kаt):
Екат есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с. (1 моль/с).
Таким образом, 1Е фермента соответствует 16,67 нкат.
Удельную активность фермента определяют путем деления числа единиц ферментативной активности на массу белка (или ткани), г или мг.
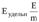 , (2)
, (2)
где Е – число единиц ферментативной активности;
m – масса белка (ткани), г или мг
Молярную активность фермента определяют путем деления числа единиц ферментативной активности в образце на массу фермента, выраженную в микромолях (для очищенных ферментов):
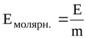 , (3)
, (3)
где Е – число единиц ферментативной активности;
m – масса фермента, мкмоль
|
|
|
14.
Изоферменты
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
Органные — ферменты гликолиза в печени и мышцах.
Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
Мутантные — образуются в результате единичной мутации гена.
Аллоферменты — кодируются разными аллелями одного и того же гена.
Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Изоформылактатдегидрогеназы.Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты)
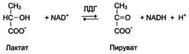
Лактатдегидрогеназа- олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle - мышца) и Н (от англ, heart - сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформлактатдегидрогеназы ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ
Изоформыкреатинкиназы.Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
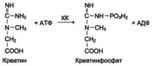
121
Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle - мышца) и В (от англ, brain - мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
Щелочная фосфатаза (ЩФ, КФ 3.1.3.1.) катализирует гидролиз органических эфиров фосфорной кислоты (фосфоэтаноламин, пирофосфаты, пиридоксаль‑5‑фосфат, β‑глицерофосфат), при этом она специфична по отношению к однозамещенным ортофосфатам, дву- и тризамещенные производные гидролизу не подвергаются. Наиболее высокая удельная активность обнаружена в эпителии тонкого кишечника и канальцев почек, в предстательной и молочной железах, в остеобластах, в плаценте. В печени ЩФ локализована в клетках эндотелия синусоидов и в гепатоцитах, примыкающих к желчным канальцам.
При электрофорезе в агаровом геле выделено 5 изоферментов: почечный, костный, кишечный, плацентарный, холестатический. Оптимум pН для активности щелочной фосфатазы находится в интервале 8,6‑10,1 в отличие от кислой фосфатазы (КФ 3.1.3.2.), находящейся в простате, тромбоцитах и работающей при кислых значениях pH. Активаторами ЩФ являются ионы Mg2+, Co2+, Mn2+, ингибиторами фермента являются оксалаты, глутаминовая кислота, цистеин, глутатион, цианиды, борнокислые соли, фосфаты.
Применение ферментов с лечебной целью в свою очередь подразделяется на два вида: 1) применение в целях заместительной терапии и 2) с целью воздействия фермента на очаг заболевания.
С целью заместительной терапии наиболее широко используют пищеварительные ферменты, когда у пациента обнаруживается их недостаточность. В качестве примера можно привести препараты желудочного сока или чистыйпепсин или ацидин-пепсин, который незаменим при гастритах с секреторной недостаточностью, при диспепсиях у детей. Панкреатин - препарат, представляющий смесь ферментов поджелудочной железы, применяют при панкреатитах, в основном хронического характера. Такое же значение имеют известные препараты холензим, панзинорм и др.
Другая область применения заместительной терапии - это лечение заболеваний, связанных с так называемымиэнзимопатиями. Это заболевания врожденные или наследственные, при которых нарушен синтез каких-либо ферментов. Эти заболевания обычно чрезвычайно тяжелые, дети с наследственным отсутствием какого-либо фермента живут недолго, страдают тяжелыми умственными и расстройствами, отсталостью физического и умственного развития. Заместительная терапия иногда может помочь преодолеть эти нарушения.
Целый ряд ферментных препаратов используют в хирургической практике для очистки раневой поверхности от гноя, микробов, излишков грануляционной ткани; в клинике внутренних болезней их применяют:с целью разжижения вязких секретов, экссудатов, сгустков крови, например, при тяжелых воспалительных заболеваниях легких и бронхов. это в основном ферменты - гидролазы, способные расщеплять природные биополимеры - белки, НК, полисахариды. В связи с их противовоспалительным действием их применяют также при тромбофлебитах, воспалительно-дистрофических формах пародонтоза, остеомиелите, гайморите, отитах и др. воспалительных заболеваниях.
Среди них такие ферменты, как трипсин,химотрипсин, РНК-за, ДНК -аза, фибринолизин. Фибиринолизин также используют для удаления внутрисосудистых тромбов. РНК-азу и ДНК-азу с успехом применяют для лечения некоторых вирусных инфекций, например для уничтожения вируса герпеса.
15.
Мультиферментные комплексы это надмолекулярные образования которые включают, несколько ферментов и коферментов. Они катализируют последовательные этапы реакции преобразования одного субстрата. Примером мультиферментов являются реакции окисли тельного декарбоксилирования αкетокислот (пирувата и αкетоглутарата) под влиянием пи руватдегидрогеназы и αкетоглутаратдегидрогеназы. Например пируватдегидрогеназный комплекс включает 3 фермента и использует 5 коферментов
Биологическое значение мультиферментных комплексов состоит в том, что благодаря их существованию облегчается перенос реагирующих веществ между отдельными ферментами и коферментами, что ускоряет протекание реакций. Мультиферментные комплексы, как правило, формируются на мембранах путем самосборки.В олигомерах, катализирующих одну реакцию, выделяют изоферменты. Изоферменты – это ферменты, катализирующие одну реакцию, но отличающиеся друг от друга аминокислотным составом, последовательностью аминокислот, физико-химическими свойствами, локализацией в разных тканях.
Профермент — неактивный предшественник фермента. Другие названия: зимоген, проэнзим, энзимоген. Физиологический смысл проферментов заключается в том, чтобы ткани, продуцирующие ферменты, не подвергались воздействию этих самых ферментов. Поэтому акт продукции фермента (профермента) отделен от акта его активации — превращения в фермент. И поэтому проферменты, в основном, встречаются у протеолитических ферментов, расщепляющих белки, в отличие отлиполитических ферментов, расщепляющих жиры.
16
Определение активности энзимов (энзимодиагностика) широко используется в целях диагностики и динамического контроля при лечении многих заболеваний. Измерение активности или концентрации энзима проводят в биологических жидкостях организма, но чаще всего - в плазме крови.
 Основанием для таких измерений служит следующее обстоятельство: большинство энзимов являются тканеспецифическими, то есть выполняют свою функцию внутри ткани (внутриклеточно). При заболевании органа (повреждении клеточных мембран) энзимы поступают в сосудистую систему (кровь), мочу и другие жидкости, где может быть определена их избыточная концентрация (избыточная активность), превышающая следовые параметры. Следовые параметры или нормы содержания (активности) клеточных энзимов в жидкостях организма отражают результат нормального процесса обновления клеток. Энзимодиагностика основана на измерении содержания конкретного энзима.
Основанием для таких измерений служит следующее обстоятельство: большинство энзимов являются тканеспецифическими, то есть выполняют свою функцию внутри ткани (внутриклеточно). При заболевании органа (повреждении клеточных мембран) энзимы поступают в сосудистую систему (кровь), мочу и другие жидкости, где может быть определена их избыточная концентрация (избыточная активность), превышающая следовые параметры. Следовые параметры или нормы содержания (активности) клеточных энзимов в жидкостях организма отражают результат нормального процесса обновления клеток. Энзимодиагностика основана на измерении содержания конкретного энзима.
Дата добавления: 2018-08-06; просмотров: 1047; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
