СХОДСТВО И ОТЛИЧИЯ ФЕРМЕНТОВ И НЕОРГАНИЧЕСКИХ КАТАЛИЗАТОРОВ
Ферменты (энзимы) – это биокатализаторы преимущест- венно белковой природы (иРНК тоже имеют ферментативную активность), которые при- нимают участие в химических реакциях в организме. Слово «фермент» происходит от слова «fermentatio» - брожение, а энзим – от «enzyme», что означает закваска в дрожжах. Наука, изучающая ферменты, называется энзимологией или ферментологией. По своей химической природе ферменты – это белки, они имеют несколько уровней структурной организации и обладают всеми другими свойствами белков. Очень большое количество ферментов не имеют 4-ую структуру, т.е. являются олигомерами. Ферменты могут быть простыми и сложными. Простые состоят только из полипептидной цепи, а сложные имеют пептидную (апофермент) и небелковую части (кофермент). Значение ферментов: ферменты принимают участие в большинстве процессов проис- ходящих в организме – 1) реакциях синтеза и распада веществ, 2) процессах переваривания и всасывания, 3) освобождения энергии, 4) обеспечивают координацию биохимических реак- ций. Нарушение синтеза или активности ферментов приводит к возникновению болезней. История энзимологии: В 1814 году Кирхгоф открыл, что солод ячменя вызывает броже- ние крахмала. Дальнейшее развитие ферментологии связано с именами Либиха, Пастера, Манасеиной, Лебедева. В 1913 году Ментен и Михаэлис выдвинули теорию механизма дей- ствия ферментов. В 1926 году (год рождения ферментологии как науки) Самнер выделил кристаллическую уреазу и доказал ее белковую природу. В 1969 году Меррифильд (Нью- Йорк) синтезировал искусственно рибонуклеазу. 2. Особые свойства ферментов: 1) высокая каталитическая активность. Металлы увеличивают скорость реакции в тысячи раз, а ферменты в миллионы раз. Например, уреаза ускоряет скорость реакции в 1014 раз. Каталаза ускоряет распад H2O2 в 1 млдр. раз! 2H2O2®2H2O +O2. Без катализатора выделения кислорода не видно. Металлический катализатор увеличивает скорость реакции в 1000 раз, а при добавлении каталазы – бурное вспенивание. 2) специфичность действия – наиболее характерная черта. Строение активного центра фермента, катализирующего реакции, различна. Структура активного центра фермента комплементарна структуре его субстрата, поэтому фермент из множества веществ присоединяет только свой субстрат – субстратная специфичность фермента. Каждый фермент катализирует не любое превращение субстрата, а какое либо одно – специфичность пути превращения. Например, на АК ГИС действуют 2 фермента: гистидаза (отщепляет NH3) и гистидиндекарбоксилаза (отщепляет CO2). Выделяют несколько видов специфичности: а) абсолютная специфичность. Фермент действует только на один единственный субстрат. Пр.: уреаза разрушает мочевину: NH2-CO-NH2® (над стрелкой уреаза, под – вода) 2NH3+ CO2. Аргиназа катализирует распад аргинина. б) групповая специфичность. Фермент действует на определённую связь в разных субстратах. Пр.: пептидазы разрывают пептидные связи [-NH-CH(R)-CO--NH-CH(R)-CO-]. Пепсин действует только на связи, образованные карбоксильной группой ароматических АК (ФЕН, ТИР, ТРИ). Эстеразы разрывают сложно-эфирную связь [-CO-NH-] в различных липидах. Гликозидазы действуют на гликозидную связь. Действие ферментов, обладающих групповой специфичностью, позволяет организму содержать небольшое количество ферментов. в) стереоспецифичность. Фермент действует на определённый стереоизомер (D- и L-, цис- и транс-). Пр.: бутен-2-диовая кислота имеет 2 стереоизомера: транс-изомер или фумаровая к-та, и цис-изомер или малеиновая кислота. Фумараза действует на фумаровую к-ту с превращением последней в яблочную. В стереоспецифичности выделяют оптическую специфичность – избирательное действие ферментов на оптические изомеры. Например, под действием ЛДГ разрушается только L-форма молочной к-ты. 3.Зависимость скорости реакции от температуры – описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента. Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С,т.е. в значениях до денатурации белков. Наряду с этим,как исключение, имеются ферменты некоторых микроорганизмов, существующих в воде горячих источников и гейзеров.При понижении температуры активность ферментов понижается, но не исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных (суслики, ежи), температура тела которых понижается до 3-5°С. Это свойство ферментов также используется в хирургической практике при проведении операций на грудной полости, когда больного подвергают охлаждению до 22°С. 4. Зависимость скорости реакции от рН – описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значении рН.Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5,трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0. 5. Зависимость скорости реакции от концентрации субстратаПри увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата.При дальнейшем увеличении концентрации субстрата между его молекулами возникает кон- куренция за активный центр фермент и скорость реакции снижается. 4. Зависимость от концентрации фермента.При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта.
|
|
|
|
|
|
|
|
|
|
|
|
СХОДСТВО И ОТЛИЧИЯ ФЕРМЕНТОВ И НЕОРГАНИЧЕСКИХ КАТАЛИЗАТОРОВ
С ХОДСТВО: 1. Катализируют только энергетически
возможные реакции.2. Не изменяют направления реакции.3. Ускоряют наступление равновесия реак-
ции, но не сдвигают его.4. Не расходуются в процессе реакции.
Отличия:1. Скорость ферментативной реакции намного выше.2. Высокая специфичность.3. Мягкие условия работы (внутриклеточные).4. Возможность регулирования скорости реакции.5. Скорость ферментативной реакции пропорциональна количеству фермента.
Обнаружение Ф.основано на их высокой специфичности.Ф.обнаруживают по производимому ими действию,т.е по факту протекания той р-ции,которую катализируют данный Ф.Напр.:Амилазу обнаруживают по р-ции расщепления крахмала до глюкозы.
3. Хим.природа ФЕРМЕНТОВ. Ферменты по химической природе – этот белки. В отличие от белков у ферментов имеется активный центр (АЦ).Примеры простых ферментов: трипсин, уреаза, рибонуклеаза. По строению все ферменты можно разделить на однокомпонентные (простые, или ферменты-протеины) и двухкомпонентные (сложные, или ферменты-протеиды). Ферменты-протеины построены по типу простых белков – состоят только из аминокислот. Примеры простых ферментов: трипсин, уреаза, рибонуклеаза. Ферменты-протеиды состоят из белковой части –апофермента и небелковой части – кофермента.Апофермент обуславливает субстратную специфичность, т.е. играет роль субстратного участка АЦ, а кофермент играет роль каталитического участка АЦ, т.е. обуславливает специфичность действия. Коферментами могут быть металлы, витамины и другие небелковые низкомолекулярные вещества.Апофермент и кофактор отдельно друг от друга не могут обеспечивать катализ химической реакции. Объединение их дает активную молекулу фермента - холофермент.В зависимости от строения ферменты делятся на мономерные и олигомерные. Мономерные ферменты (например, рибонуклеаза, трипсин) содержат одну полипептидную цепь и имеют первичную, вторичную и третичную структуры. Олигомерные ферменты содержат 2 и более полипептидных цепей (субъединиц) и имеют помимо вышеуказанных и четвертичную структуру. Чаще всего встречаются олигомерные ферменты с четным числом субъединиц (лактатдегидрогеназа - 4, уреаза - 8).Если различные олигомерные ферменты катализируют разные, но взаимосвязанные между собой реакции, то они образуют мультиферментный комплекс (например, пируватдегидрогеназный комплекс содержит 3 фермента - пируватдегидрогеназу, дигидролипоилдегидрогеназу, дигидролипоилтрансацетилазу, катализирующие связанные между собой реакции в процессе аэробного окисления пировиноградной кислоты).
Молекула фермента взаимодействует с субстратом не всей своей поверхностью, а определенными участками. На поверхности фермента различают:
Активный центр – это участок фермента, который взаимодействует с субстратом. Активных центров может быть 2, 4, 6, 8, в каждый входят 7-15 аминокислот. Наиболее часто в состав активных центров ферментов входят функциональные группы таких аминокислот:- ОН – группы серина, треонина, тирозина;- SН – группы цистеина;- NН – группа гистидина;-СООН – группы глутамата и аспартата;-NН 2 – группы аргинина и лизина.В сложных ферментах в активный центр входят кофакторы (небелковые компоненты):простетические группы, коферменты, ионы металлов. Активный центр является комплемен-тарным к строению S, имеется соответствие (комплементарность) Е и S как “ключа и замка”.
В структуре активного центра выделяют:• участок, который связывается с субстратом: контактный (“якорный”) участок;• каталитический участок, в состав которого входят химические группы, принимающие непосредственное участие в преобразовании субстрата (-ОН, -SH, =N, -NH 3 + , СООН).
Кроме активного центра, некоторые ферменты имеют дополнительный, регуляторный, аллостерический (allos – другой, steros – пространственный) центр, с которым взаимодействуют аллостерические регуляторы (эффекторы, модуляторы). Аллостерические эффекторы могут быть позитивными (активаторами), которые повышают каталитическую активность фермента или негативными (ингибиторами), которые ее снижают.Активный и аллостерический центры локализуются на разных субъединицах фермента.При взаимодействии аллостерического центра с эффекторами происходят конформационные изменения активного центра фермента, что приводит к увеличению или снижению его активности. Ферменты, имеющие аллостерический центр, называются регуляторными.
4. Хим.природаКофакторов и Коферментов.Кофакторы могут быть неорганической природы (представлены ионами металлов Zn2+, Mg2+, Fe2+, Cu2+ и др.) и органической природы (коферменты, которые в большинстве случаев в своей структуре содержат остатки водорастворимых витаминов, например тиаминпирофосфат содержит остаток витамина В1, флавинмононуклеотид и флавинадениндинуклеотид - остаток витамина В2, кофермент ацилирования - остаток витамина В3, никотинамидадениндинуклеотид и никотинамидадениндинуклеотидфосфат - остаток витамина В5, пиридоксальфосфат - остаток витамина В6). Кофакторы в процессе катализа выполняют следующие функции:- изменяют трехмерную структуру фермента или субстрата для улучшения взаимодействия между ними;- многие из них служат основой для формирования активного центра фермента;- участвуют в процессе переноса протонов, электронов, атомов и атомных групп;- могут выступать в реакции в роли дополнительного субстрата.именно коферменты выступают в качестве дополнительных субстратов. Они обычно играют роль промежуточных переносчиков, электронов или химических групп, которые в результате ферментативной реакции переносятся от одного соединения на другое. Кофакторы термостабильны, тогда как белковая часть фермента денатурирует при нагревании. Кофактор ответственен за каталитическую активность фермента, белковая же часть усиливает каталитическое действие и определяет специфичность фермента. Один и тот же кофактор может функционировать в составе разных ферментов. Например, одна и таже NAD+ (никатинамидадениндинуклеотид) является коферментом многих дегидрогеназ (окислительно-восстановительных ферментов), отличие – в апоферментной части (белке).
Коферменты– это небелковые компоненты сложных ферментов, которые проявляют высокую химическую активность и входят в состав активных центров сложных ферментов.Классификация коферментов.
1. По химической природе: 1) витаминные; 2) витаминоподобные; 3) невитаминные.
2. По механизму действия: 1) переносчики атомов водорода, электронов и протонов.
2) переносчики отдельных химических групп.
Коферменты І группы переносчики атомов водорода, электронов и протонов:
А. Невитаминные: гем, глутатион,
Б. Витаминные: аскорбиновая кислота (АК), НАД и НАДФ, ФАД и ФМН,
5-дезоксиаденозилкобаламин.
В. Витаминоподобные: убихинон (коэнзим Q), липоєвая кислота (ЛК), тетрагидробиоптерин
(ТГБП), хиноновые коферменты.
Коферменты ІІ группы (переносчики различных химических групп):
А. Невитаминные: фосфаты нуклеозидов, фосфаты углеводов.
Б. Витаминные: ТДФ, КоА, ПАЛФ, биоцитин, ТГФК, метилкобаламин, витамины К и А
7.Скорость ферментативной реакции зависит от многих факторов: от концентрации субстрата и фермента, температуры, рН среды, наличия различных регуляторных веществ, способных увеличивать или снижать активность ферментов. При низких концентрациях субстрата скорость прямо пропорциональна его концентрации, далее с ростом концентрации скорость реакции увеличивается медленнее, а при очень высоких концентрациях субстрата скорость практически не зависит от его концентрации и достигает своего максимального значения (Vmax). 
График зависимости активности фермента от концентрации субстрата описывается уравнением Михаэлиса – Ментен, которое получило свое название в честь выдающихся ученых Л.Михаэлиса и М.Ментен, внесших большой вклад в исследование кинетики ферментативных реакций, где v – скорость ферментативной реакции; [S] – концентрация субстрата; KM – константа Михаэлиса.
Рассмотрим физический смысл константы Михаэлиса. При условии, что v = ½ Vmax, получаем KM = [S]. Таким образом, константа Михаэлиса равна концентрации субстрата, при которой скорость реакции равна половине максимальной.
Скорость ферментативной реакции зависит и от концентрации фермента.
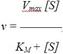
5.Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).

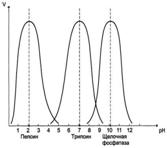
Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
Оптимум значения рН у разных ферментов различный (рис. 2-18). Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН (табл. 2-1).
6.Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):
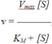
Это уравнение получило название уравнения Михаэлиса-Ментен.В случае, когда скорость реакции равна половине максимальной, Km = [S] (рис. 2-19). Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости.УравнениеМихаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.Если концентрация субстрата значительно больше Km (S >>Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата.Если концентрация субстрата значительно меньше Km(S <<Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок).Vmах и Km - кинетические характеристики эффективности фермента.Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньшеКm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату.
8. Активаторы – вещества, повышающие скорость ферментативных реакций. Различают специфические активаторы, повышающие активность одного фермента (НСl - активатор пепсиногена) и неспецифические активаторы, увеличивающие активность целого ряда ферментов (ионы Mg – активаторы гексокиназы, К, Na –АТФ-азы и других ферментов). В качестве активаторов могут служить ионы металлов, метаболиты, нуклеотиды.
Достраивание активного центра фермента, в результате чего облегчается взаимодействие фермента с субстратом. Таким механизмом обладают в основном ионы металлов.
Аллостерический активатор взаимодействует с аллостерическим участком (субъединицей) фермента, через его изменения опосредованно изменяет структуру активного центра и увеличивает активность фермента. Аллостерическим эффектом обладают метаболиты ферментативных реакций, АТФ.
Аллостерический механизм может сочетаться с изменением олигомерности фермента. Под действием активатора происходит объединение нескольких субъединиц в олигомерную форму, что резко увеличивает активность фермента. Например, изоцитрат является активатором фермента ацетил-КоА карбоксилазы.
Фосфолирирование - дефосфолирирование ферментов относится к обратимой модификации ферментов. Присоединение Н3РО4 чаще всего резко увеличивает активность фермента. Например, два неактивных димера фермента фосфорилазы соединяются с четырьмя молекулами АТФ и образуют активную тетрамернуюфосфорилированную форму фермента. Фосфолирирование ферментов может сочетаться с изменением их олигомерности. В некоторых случаях фосфорилирование фермента, наоборот, снижает его активность (например, фосфорилирование фермента гликогенсинтетазы)
Частичный протеолиз (необратимая модификация). При этом механизме от неактивной формы фермента (профермента) отщепляется фрагмент молекулы, блокирующий активный центр фермента. Например, неактивный пепсиноген под действием HCL переходит в активный пепсин.
Ингибиторы ферментов.
ингибиторы – соединения, тормозящие каталитический процесс, или активаторы – вещества, которые этот процесс ускоряют. Учение об ингибиторах ферментов имеет большое теоретическое и практическое значение для фармакологии и токсикологии. Многие лекарственные препараты являются ингибиторами ферментов.
По типу действия ингибиторы можно разделить на обратимые и необратимые. Удаление обратимых ингибиторов из системы (диализом, гельфильтрацией и др.) восстанавливает каталитическую активность фермента.
Обратимо действуют эффекторы:
1. Близкие аналоги субстрата, которые связываются активным центром фермента, но
не подвергаются превращению. Занимая активный центр, они препятствуют связыванию истинного субстрата, конкурируя с ним, и поэтому называются конкурентными ингибиторами.
2. Кофакторы ферментов, без которых апофермент вообще не обладает активностью.
Постепенное добавление их приводит к появлению активности, которая затем повышается до определенного предела, соответствующего полному насыщению.
3. Вещества, которые взаимодействуют с дополнительными, регуляторными центрами, несовпадающими с активным центром. Тем не менее, это взаимодействие изменяет конформацию в районе активного центра и влияет на кинетику ферментативного процесса. Такие соединения называются аллостерическими эффекторами. Они имеют важное биологическое значение, так как с их помощью осуществляется один из механизмов регуляции каталитической активности.
Необратимую инактивацию вызывают соединения (найденные в живой природе или полученные путем синтеза), которые вступают в химическую реакцию с участком фермента, важным для проявления каталитической активности. Такие соединения, специфически реагирующие с определенными группами в молекулах ферментов (групп-специфические реагенты), используют для идентификации функциональных групп активного центра (метод химической модификации).
С этой целью широко используются соединения, блокирующие SH-группы (иодацетамид, n-хлормеркурибензоат и др.), окисляющие остатки триптофана в кислой среде (N-бромсукцинимид), ацетилирующие остатки тирозина (N-ацетилимидазол), связывающие металлы (азид натрия) и т.д.
Дата добавления: 2018-08-06; просмотров: 957; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
