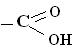Загальна характеристика ліпідів
Nbsp; ОДЕСЬКИЙ ДЕРЖАВНИЙ АГРАРНИЙ УНІВЕРСИТЕТ Кафедра садівництва, виноградарства, біології та хімії Завдання для самостійної роботи студентів з дисципліни «Органічна хімія» Частина ІІ «ОКСИГЕНОВМІСНІ СПОЛУКИ» До уваги студентів!
Кожен студент виконує самостійне завдання
Тільки згідно свого варіанту.
Перед виконанням самостійних завдань
необхідно розібрати відповідний матеріал
за конспектом лекцій, підручником та
додатками 1-4.
2018
ОКСИГЕНОВМІСНІ СПОЛУКИ
План.
1. Визначення, класифікація, загальні формули, функціональні групи, номенклатура
основних класів оксигеновмісних сполук.
2. Основні представники оксигеновмісних сполук та їх застосування.
3. Фізичні властивості оксигеновмісних сполук.
4. Хімічні властивості оксигеновмісних сполук.
5. Способи добування оксигеновмісних сполук.
Оксигеновмісні сполуки – складаються з трьох хімічних елементів – Карбону, Гідрогену та Оксигену. Це похідні вуглеводнів, в молекулах яких вуглеводневий радикал пов'язаний з певною функціональною групою, в залежності від якої їх поділяють на 3 групи (див. додаток 1):
ОКСИГЕНОВМІСНІ СПОЛУКИ
| Функціональна група | Загальна формула класу | Закінчення | Основні представники | ||
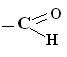
| –OH гідроксо- група | Спирти R–OH R–(OH)n | -ол -діол -тріол | 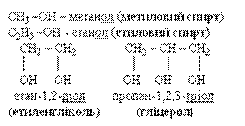
| ||
Феноли
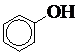
| фенол | 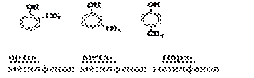
| |||
|
карбонільна група | Альдегіди
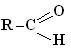
| -аль | 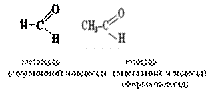
| ||
Кетони
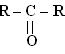
| -он | 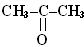 пропан-2-он
(ацетон)
пропан-2-он
(ацетон)
| |||
|
або
− СООН карбоксильна група | Карбонові кислоти
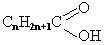 R-(СООН)2
R-(СООН)2
| - ова кислота - діова кислота | 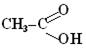 етанова кислота (ацетатна)
НООС–СООН
етандіова кислота (щавлева)
етанова кислота (ацетатна)
НООС–СООН
етандіова кислота (щавлева)
| ||
Гідроксикислоти
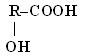
| гідрокси- - ова кислота | β α
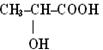 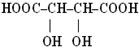 2-гідрокси- 2,3-дигідрокси-
пропанова бутандіова к-та
кислота (винна)
(молочна)
2-гідрокси- 2,3-дигідрокси-
пропанова бутандіова к-та
кислота (винна)
(молочна)
|
Тема 1.СПИРТИ, ФЕНОЛИ.
1. Класифікація, номенклатура, ізомерія спиртів та фенолів.
2. Будова функціональної групи спиртів та фенолів.
Фізичні властивості спиртів. Спирти до С10 – при звичайній температурі – рідини, С11 – та вище тверді речовини. По мірі збільшення молекулярної маси розчинність спиртів у воді падає і зменшується запах спиртів.
Фізичні властивості фенолів. Феноли кристалічні речовини, погано розчинні у воді. Летючі з парами води. Мають характерний запах. Феноли добрі антисептики. Отруйні. При попаданні на шкіру викликають опіки. Карболова кислота міститься у сечі людини та тварин, оскільки білкові речовини, які містять бензольне кільце, при розщепленні дають фенол. Фенол застосовується у великих кількостях у техніці для одержання пластмас. Крезоли застосовуються для одержання пластмас, суміш крезолів з милами застосовується під назвою лізол, креолін і застосовуються переважно у ветеринарній практиці.
|
|
|
Резорцин (1,3-дигідроксибензен) - застосовується в медицині для дезинфекції, з хлорним залізом дає фіолетове забарвлення. Флороглюцин (2,3,6–тригідроксибензен) – водить до складу флавонових і антоціанових пігментів, які надають колір квітам.
3.Хімічні властивості спиртів та фенолів: реакції за рахунок рухливості атомів карбону спиртової групи (утворення алкоголятів, фенолятів); взаємодія зі спиртами (утворення простих ефірів (етерів) – міжмолекулярна дегідратація); внутрішньо молекулярна дегідратація (утворення алкенів); окислення спиртів (первинні спирти окислюються до альдегідів, вторинні – до кетонів); порівняння кислотності спиртів та фенолів; якісні реакції багатоатомних спиртів та фенолів.
3. Способи одержання та застосування спиртів та фенолів.
Завдання 1. Складіть структурні формули названих спиртів та вкажіть до яких типів вони належать за кожною з ознак класифікації.
|
|
|
| Варіант | Назви спиртів | ||
| А | Б | В | |
| 1 | 2-метилбутан-1-ол | пропан-1,3-діол | о-метилфенол |
| 2 | 3-третбутил-1-ол | 3-метилбутан-1,2,3-тріол | 3-етилфенол |
| 3 | 2-метилпентан-1-ол | гліцерол (гліцерин) | 4-ізопропілфенол |
| 4 | 3-метилпент-4-ен-1-ол | етиленгліколь (етандіол) | м-крезол (м-метилфенол) |
| 5 | 2-метил-4-етил-гексан-2-ол | гексан-1,3,4-тріол | 2-бутилфенол |
| 6 | 2-метил-пропан-1-ол | пентан-2,3,4-тріол | п-ізобутилфенол |
| 7 | 2-фенілпропан-1-ол | 3-метилгептан-1,3-діол | п-крезол (п-метилфенол) |
| 8 | 2-метилпент-1-ол | 2-феніл-пропан-2-ол | карболова кислота (фенол) |
| 9 | ізопропанол | бутан-1,4-діол | 3-пропілфенол |
| 10 | гекс-4-ен-2-ол | 2,3-диметилбутан-1,2-діол | 2-етилфенол |
| 11 | 3-фенілбутан-2-ол | пентан-1,3-діол | м-етилфенол |
| 12 | 3-етилпентан-1-ол | бутан-1,2,3-тріол | 2-пропілфенол |
| 13 | 2,3-диметилбутан-1-ол | гекс-3-ін-1,2-діол | 4-бутилфенол |
| 14 | 3-метилбутан-2-ол | пропан-1,2-діол | 3-бутилфенол |
| 15 | 3,3-диметилбутан-1-ол | бутан-1,3-діол | п-етилфенол |
| 16 | 2-фенілбутан-1-ол | 3,3-диметилпентан-1,4-діол | 2-ізопропілфенол |
| 17 | пентан-3-ол | 3,4-пентан-1,2,5-тріол | 2-метилфенол |
| 18 | бутан-2-ол | пентан-1,5-діол | 2-третбутилфенол |
| 19 | бутан-1-ол | 3-метилгексан-3-ол | 3-третбутилфенол |
| 20 | 4-метилпентан-1-ол | пентан-1,2-діол | 2,3-диметилфенол |
| 21 | 2-метилгексан-1-ол | гептан-1,3,4-тріол | 3-бромофенол |
| 22 | гексан-3-ол | пент-3-ен-1-ол | 3,4-дибромофенол |
| 23 | 3-етилгептан-2-ол | гексан-1,2,3-тріол | о-амінофенол |
| 24 | пентан-1-ол | пентан-1,2-діол | 3-нітрофенол |
| 25 | 3,4-диметилпентан-1-ол | гексан-1,3-діол | 3-амінофенол |
| 26 | 3-фенілпентан-2-ол | пропан-1,2,3-тріол | о-ізопропілфенол |
| 27 | 2-метилгексан-3-ол | пентан-2,3,4-тріол | 4-етилфенол |
| 28 | 4-фенілбутан-2-ол | 4-етилгептан-1,3-діол | орто-етилфенол |
| 29 | 3-етилгексан-2-ол | 2-метилпент-3-ен-1-ол | мета-втор.бутилфенол |
| 30 | 2-метилгептан-3-ол | гекс-3-ен-1-ол | 2-ізобутилфенол |
Завдання 2. Для речовин Ата В, вказаних у завданні 1, складіть схеми реакцій:
|
|
|
1) Взаємодії з металічним натрієм (речовина А) та натрій гідроксидом (речовина В);
2) Внутрішньо молекулярної дегідратації (речовина А);
3) Утворення простого ефіру (речовина А);
4) Окислення (речовина А).
Назвіть продукти реакцій.
Тема 2. АЛЬДЕГІДИ ТА КЕТОНИ
1.Класифікація, номенклатура, ізомерія альдегідів та кетонів.
2. Будова функціональної групи альдегідів та кетонів.
3.Фізичні властивості альдегідів та кетонів. Мурашиний альдегід — газ, нижчі альдегіди та кетони — леткі рідини. Киплять вони при нижчій температурі, ніж відповідні спирти, бо не здатні утворювати водневі зв'язки. Температура кипіння кетонів трохи вища, ніж в ізомерних до них альдегідів.
4.Хімічні властивості альдегідів та кетонів: реакції за рахунок карбонільної групи (відновлення воднем альдегідів та кетонів); взаємодія зі спиртами (утворення напівацеталей); окислення альдегідів та кетонів.
5.Способи одержання та застосування альдегідів та кетонів.
6. Поширення альдегідів і кетонів в природі. Альдегіди присутні в зелених частинах рослин (ванілін, виноградний цукор). Представники вищих альдегідів, мають різні аромати і входять до складу ефірних масел. Альдегіди присутні в ефірних маслах цитрусових і застосовуються в харчовій промисловості, косметиці.
Завдання 1.Напишіть структурні формули речовин, назви яких наведено. Вкажіть до якого класу належить кожна з них.
| Варіант | Назва речовини | Варіант | Назва речовини |
| 1 | а ) бутаналь; б) пентан-2-он | 16 | а) 3,3-диметилбутаналь; б) 3,4-диметилпентан-2-он |
| 2 | а) пентаналь; б) 4-метилгексан-3-он | 17 | а) масляний альдегід; б) ацетон |
| 3 | а) 3-метилгексаналь; б) пропанон | 18 | а) 3-метилбутаналь; б) гептан-4-он |
| 4 | а) 2-метилпентаналь; б) гептан-2-он | 19 | а) 5-метилгептаналь; б) 4-метилгексан-2-он |
| 5 | а) 4-метилгептаналь; б) 3-метилпентан-2-он | 20 | а) мурашиний альдегід; б) гексан-3-он |
| 6 | а) гексаналь; б) 4,4-диметилпентаналь | 21 | а) етаналь; б)5-метилгептан-3-он |
| 7 | а) 3,4-диметилпентаналь; б) гептан-2-он | 22 | а) 3-етилгептаналь; б) октан-4-он |
| 8 | а) 3-метилгептаналь; б) 5-метилгексан-3-он | 23 | а) валеріановий альдегід; б) 3-етил-5-метилгексан-2-он |
| 9 | а) гептаналь; б) 3,4-диметилпентан-2-он | 24 | а) 3-метилмасляний альдегід; б) 4-етилгексан-2-он |
| 10 | а) 3,3-диметилпентаналь; б) гексан-3-он | 25 | а) пропіоновий альдегід; б) октан-2-он |
| 11 | а) 3-метилпентаналь; б) 5,5-диметилгексан-2-он | 26 | а) 2-метилпропаналь; б) пентан-3-он |
| 12 | а) 4,4-диметилпентаналь; б) гексан-2-он | 27 | а) 3-метилпентаналь б) 5-метилгексан-2-он |
| 13 | а) октаналь; б) 4,4-диметилпентан-2-он | 28 | а)3,3-диметилбутаналь б) пентан-2-он |
| 14 | а) 3,4-диметилгексаналь; б) пентан-2-он | 29 | а)4-етилгептаналь б) 5,5-диметилгексан-2-он |
| 15 | а) 4-метилпентаналь; б) 3,5-диметилгексан-2-он | 30 | а) 4-етилгексаналь б) 4-метилгептан-2-он |
Завдання 2.Напишіть структурні формули двох ізомерів (один альдегід та один кетон) для кожної з наведених у завданні 1 речовин. Назвіть всі речовини за номенклатурою ІЮПАК.
Завдання 3. Для сполук аі б, наведених у завданні 1, складіть схеми реакцій:
а) окислення; б) відновлення воднем; в) для речовини Авзаємодія з етанолом.
Тема 3. КАРБОНОВІ КИСЛОТИ
1.Класифікація, номенклатура, ізомерія карбонових кислот.
2. Будова карбоксильної групи.
3.Фізичні властивості карбонових кислот. Мурашина кислота — рідина з досить високою температурою кипіння, початкові члени ряду мають різкий запах, пропіонова має запах поту, запах масляної кислоти відчувається при підгоранні їжі на сковороді, запах інших рідких кислот так само неприємний. Карбонові кислоти із числом атомів Карбону більшим від 10 є твердими речовинами.
4.Хімічні властивості карбонових кислот: взаємодія з активними металами, основними оксидами, основами; взаємодія зі спиртами (утворення естерів); взаємодія з NН3 при нагріванні (утворення амідів); поведінка при нагріванні двохосновних кислот.
5.Способи одержання та застосування карбонових кислот.
6. Поширення в природі карбонових кислот. Мурашина кислота міститься у хвої, кропиві, виділеннях мурашок та бджіл. Пальмітинова і стеаринова кислоти у вигляді складних ефірів гліцеролу входять до складу рослинних і тваринних жирів.
Естери дуже поширені в природі. Багато з них входить до складу ефірних масел і обумовлює приємний запах квітів, плодів і ягід.
7. Застосування карбонових кислот. Мурашина кислота– застосовується при фарбуванні тканин, в консервній промисловості, спиртовій та пивоваренній промисловості – для дезинфекції бродильних чанів. Оцтова кислота– застосовується в харчовій промисловості, хімічній – при фарбуванні тканин, при виробництві лаків та фарб. Янтарна кислота бере участь в процесі клітинного дихання організмів, що дихають киснем. Солі та ефіри янтарної кислоти називаються сукцинатами. В харчовій промисловості використовується як харчова добавка Е363. Летальна доза – 2,26 г/кг (для щурів). Використовується для одержання пластмас, лікарських препаратів, в аналітичній хімії.
Завдання 1.Назвіть вказані речовини за номенклатурою ІЮПАК та вкажіть до яких типів вони належать за класифікацією.
| № варіанту | Структурні формули речовин |
| 1 | а) 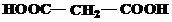 б) б) 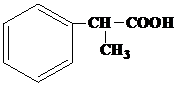
|
| 2 | а) 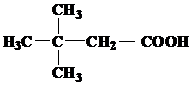 б) б) 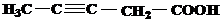
|
| 3 | а) 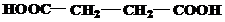 б) б) 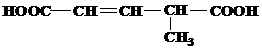
|
| 4 | а) 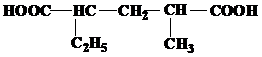 б) б) 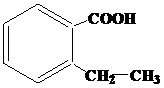
|
| 5 | а) 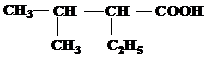 б) б) 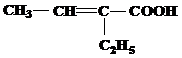
|
| 6 | а) 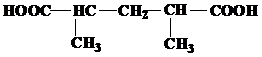 б) б) 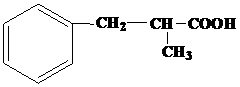
|
| 7 | а) 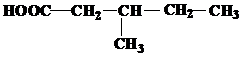 б) б) 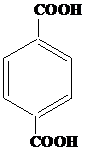
|
| 8 | а)  б) б) 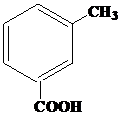
|
| 9 | а) 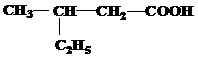 б) б) 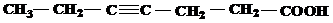
|
| 10 | а) 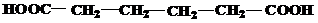 б) б) 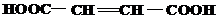
|
| 11 | а) 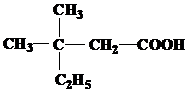 б) б) 
|
| 12 | а) 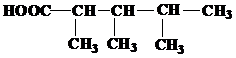 б) б) 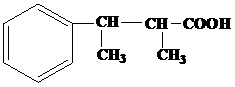
|
| 13 | а) 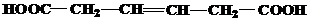 б) б) 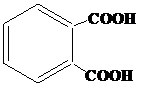
|
| 14 | а) 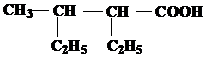 б) б) 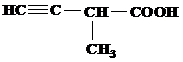
|
| 15 | а) 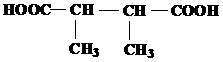 б) б) 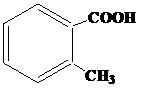
|
| 16 | а) 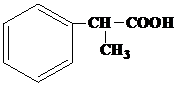 б) б) 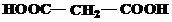
|
| 17 | а) 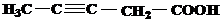 б) б) 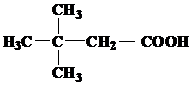
|
| 18 |
а) 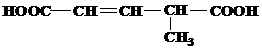 б) б) 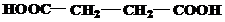
|
| 19 | а) 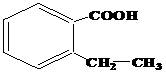 б) б) 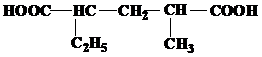
|
| 20 | а) 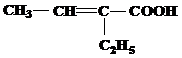 б) б) 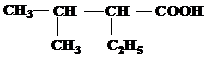
|
| 21 | а) 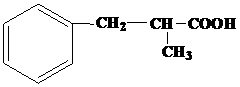 б) б) 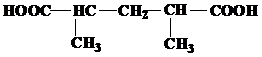
|
| 22 | а)  б) б) 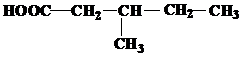
|
| 23 | а) 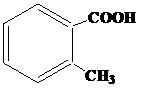 б) б) 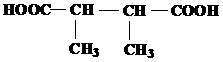
|
| 24 | а) 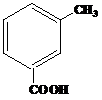 б) б) 
|
| 25 | а) 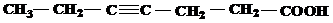 б) б) 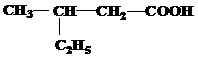
|
| 26 | а) 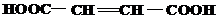 б) б) 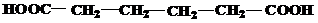
|
| 27 | а)  б) б) 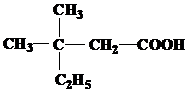
|
| 28 | а) 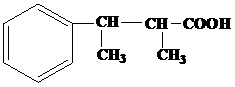 б) б) 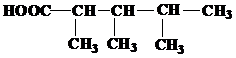
|
| 29 | а) 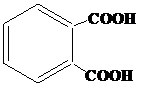 б) б) 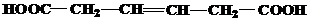
|
| 30 | а) 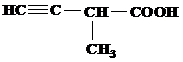 б) б) 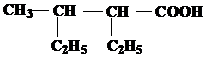
|
Завдання 2.Складіть структурну формулу для вказаної речовини.
| № варіанту | Назви речовин |
| 1 | 2-метил-пропанова кислота |
| 2 | етанова кислота |
| 3 | мета-метил-бензенова кислота |
| 4 | 3-етил-бензенова кислота |
| 5 | щавлева кислота |
| 6 | проп-2-ен-ова кислота |
| 7 | мурашина кислота |
| 8 | 4-етил-2,2-диметил-капронова кислота |
| 9 | акрилова кислота |
| 10 | 4-етил-бензенова кислота |
| 11 | масляна кислота |
| 12 | метанова кислота |
| 13 | янтарна кислота |
| 14 | пропандіова кислота |
| 15 | валеріанова кислота |
| 16 | етанова кислота |
| 17 | малонова кислота |
| 18 | пропанова кислота |
| 19 | пропіонова кислота |
| 20 | 3-етил-пентанова кислота |
| 21 | гексанова кислота |
| 22 | 4-ізопропіл-бензенова кислота |
| 23 | орто-етил-бензенова кислота |
| 24 | етандіова кислота |
| 25 | оцтова кислота |
| 26 | бутанова кислота |
| 27 | бензенова кислота |
| 28 | бут-2-ен-ова кислота |
| 29 | пара-метил-бензенова кислота |
| 30 | бутандіова кислота |
Завдання 3.Складіть слідуючи схеми реакцій та назвіть їх продукти
для вказаної речовини у завданні 2:
а) взаємодія з гідроксидом кальцію;
б) взаємодія з аміаком при нагріванні;
в) взаємодії з етиловим спиртом (утворення естеру).
Тема 4: ЕСТЕРИ, НЕЙТРАЛЬНІ ЖИРИ
1. Загальна формула естерів.
2. Класифікація, будова молекул, номенклатура, ізомерія.
3. Способи добування, застосування, поширення в природі естерів карбонових кислот.
4. Рівняння хімічних реакцій які відображають властивості жирів (гідроліз, гідрування, окиснення жирів), утворення жирів.
5. Біологічна роль жирів.
Завдання 1.Складіть схеми реакцій утворення жиру та його лужного гідролізу (омилення).
| № варіанту | Назви речовин |
| 1 | триолеїн |
| 2 | 1-пальміто-2,3-дистеарин |
| 3 | 1,3-диолео-2-пальмітин |
| 4 | 1-олео-2,3-дилінолен |
| 5 | 2-пальміто-1,3-дистеарин |
| 6 | 1,2-диолео-3-пальмітин |
| 7 | 1-олео-2,3-дистеарин |
| 8 | 1-олео-2,3-дипальмітин |
| 9 | 1-лінолео-2,3-диолеїн |
| 10 | тристеарин |
| 11 | 1,2-диолео-3-стеарин |
| 12 | 2-олео-1,3-дистеарин |
| 13 | 1,3-дипальміто-2-стеарин |
| 14 | 1,2-дилінолео-3-стеарин |
| 15 | 2,3-дипальміто-1-стеарин |
| 16 | 1,3-диолео-2-стеарин |
| 17 | 2-олео-1,3-дипальмітин |
| 18 | трипальмітин |
| 19 | 1-пальміто-2,3-дистеарин |
| 20 | 1,3-диолео-2-пальмітин |
| 21 | 1-олео-2,3-дилінолен |
| 22 | 2-пальміто-1,3-дистеарин |
| 23 | 1,2-диолео-3-пальмітин |
| 24 | 1-олео-2,3-дистеарин |
| 25 | 1-олео-2,3-дипальмітин |
| 26 | 2,3-диолео-1-лінолен |
| 27 | 1,3-дипальміто-2-стеарин |
| 28 | 1,2-дилінолео-3-стеарин |
| 29 | 2,3-дипальміто-1-стеарин |
| 30 | 1,3-диолео-2-стеарин |
Загальна характеристика ліпідів
Ліпіди – це складні ефіри, молекули яких містять залишки вищих жирних кислот та спиртів. До ліпідів відносяться жири, воски та споріднені з'єднання.
Вони добре розчинні в органічних розчинниках (ефірі, бензені) та нерозчинні або погано розчинні у воді.
Жири є необхідною складовою частиною харчування. З жирами організм одержує більшу кількість енергії, ніж при вживанні такої ж кількості білків та вуглеводів. При згоранні 1 г жиру утворюється 37,7 кДж (9 ккал), тоді як при згоранні 1 г вуглеводів - 16,7 кДж (4 ккал). Жири беруть участь в пластичних процесах, є структурною частиною клітин та їх мембранних систем, захищають організм від переохолодження. В природних жирах міститься велика кількість вітамінів –А, D, E. Середній добовий раціон жирів для людини – 50-70 г жирів.
Класифікація ліпідів
Прості ліпіди– складні ефіри вищих жирних кислот з різними спиртами.
Нейтральні жири - складні ефіри вищих жирних кислот з гліцеролом.
В залежності від характеру вищої жирної кислоти розрізняють тверді жири (до складу яких входять насичені кислоти - пальмітинова,стеаринова) та рідкі жири (до складу яких входять ненасичені кислоти - олеїнова, лінолева, ліноленова, арахідонова). Є жири посереднього стану (до складу яких входять насичені та ненасичені кислоти). Наприклад тверді жири – свинячий, баранячий, яловичий; рослинні масла (олії) - соняшникове, оливкове, льняне, бавовняне та ін.; гусячий жир легко плавиться, тому його можна віднести до посереднього жиру.
Воски - складні ефіри вищих жирних кислот з одноатомними спиртами.
Невисихаючі масла - не утворюють плівку (тип олеїнової кислоти): оливкове, арахісове, мигдальне, персикове, касторове.
Висихаючи масла- утворюють смолоподібну плівку (тип ліноленової кислоти): макове, конопляне, льняне.
Складні ліпіди -складні ефіри вищих жирних кислот зі спиртами, які містять додатково інші групи:
Фосфоліпіди - містять залишок фосфатної кислоти. До складу часто входять азотисті основи і інші компоненти.
Гліколіпіди (глікосфінголіпіди) - містять жирну кислоту, сфінгозин і вуглеводний компонент (глюкозу).
Сульфоліпіди, аміноліпіди (ліпопротеїди) – ліпіди і білки, з’єднані ковалентним зв’язком.
Дата добавления: 2018-08-06; просмотров: 1585; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!