Пути использования аминокислот в организме: декарбоксилирование, образование биогенных аминов.
ЛИПИДЫ.БИОЛ.РОЛЬ.КЛАССИФИКАЦИЯ.Липиды —большая группа веществ биологического происхождения, хорошо растворимых в органических растворителях, таких, как метанол, ацетон, хлороформ и бензол. Липиды — наиболее важный из всех питательных веществ источник энергии. Ряд липидов принимает участие в образовании клеточных мембран.Некоторые липиды выполняют в организме специальные функции. Стероиды,эйкозаноиды и некоторые метаболиты фосфолипидов выполняют сигнальные функции. Они служат в качестве гормонов, медиаторов и вторичных переносчиков. Липиды подразделяются на омыляемые и неомыляемые. Омыляемые липиды. Омыляемые липиды включают три группывеществ: сложные эфиры, фосфолипиды и гликолипиды. В группу сложных эфиров входят нейтральные жиры, воски и эфиры стеринов.Группа фосфолипидов включает фосфатидовые кислоты , фосфатиды и сфинголипиды.К группе гликолипидов относятся цереброзиды и ганглиозиды ). Группа неомыляемых липидов включает предельные углеводороды и каротиноиды, а также спирты. В первую очередь это спирты с длинной алифатической цепью, циклические стерины (холестерин) и стероиды(эстрадиол, тестостерон и др.). Важнейшую группу липидов образуют жирные кислоты. К этой группе относятся такжеэйкозаноиды, которые можно рассматривать как производные жирных кислот. 2. Переваривание липидов и всасывание продуктов переваривания липидов. В полости рта жиры не подвергаются никаким изменениям, т.к. в слюне не содержится ферментов, расщепляющие жиры. Хотя в желудке взрослого человека не происходит заметного переваривания жиров пищи, все же в желудке отмечается частичное разрушение липопротеидных комплексов мембран клеток пищи, что делает жиры более доступными для последующего воздействия на них липазы панкреатического сока. Расщепление жиров, входящих в состав пищи, происходит у человека и млекопитающих преимущественно в верхних отделах тонкого кишечника, где имеются весьма благоприятные условия для эмульгирования жиров. После того как химус попадает в двенадцатиперстную кишку, здесь прежде всего происходит нейтрализация соляной кислоты желудочного сока.Жирные кислоты с короткой углеродной цепью и глицерин, будучи хорошо растворимыми в воде, свободно всасываются в кишечнике и поступают в кровь воротной вены, оттуда - в печень, минуя какие-либо превращения в кишечной стенке.Жирные кислоты с длиннои угл. цепью всасываются сложнее. С помощью желчи, солеи желчных кислот, фосфолипидов и холестерина образ. Мицеллы, которые свободно всасываются в кишечнике. 3.Гидролиз триацилглицеридов. Ресинтез жиров.Триацилглицериды – самые распространенные липиды в природе. Их принято делить на жиры и масла. При гидролизе триацилглицеринов образуются глицерин и жирные кислоты.Полный гидролиз триглицеридов происходит постадийно: сначала быстро гидролизуются связи 1 и 3, а потом уже медленно идет гидролиз 2-моноглицерида.. (гидролиз) . Ресинтез жиров в стенке кишечника. В стенке кишечника синтезируются жиры, в значительной степени специфичные для данного вида животного и отличающиеся по своей природе от пищевого жира. Механизм ресинтеза триглицеридов в клетках стенки кишечника в общих чертах сводится к следующему: первоначально из жирных кислот образуется их активная форма - ацил-КоА, после чего происходит ацилирование моноглицеридов с образованием сначала диглицеридов, а затем триглицеридов: 4.Желчные кислоты.строение, биол.роль. В печени из холестерина образуются желчные кислоты. Эти стероидные соединения с 24 атомамиуглерода являются производные холановой кислоты, имеющими от одной до трех α-гидроксильных групп и боковую цепь из 5 атомов углерода с карбоксильной группой на конце цепи. В организме человека наиболее важна холевая кислота. Желчные кислоты обеспечивают растворимость холестерина в желчи и способствуют перевариванию липидов. 5. Биосинтез липидов и их компонентов. Сами липиды и некоторые их структурные компоненты поступают в организм человека в основном вместе с пищей. При недостаточном поступлении липидов извне организм способен частично ликвидировать дефицит липидных компонентов путем их биосинтеза. Так, некоторые предельные кислоты могут быть синтезированы в организме ферментативным путем. Приведенная ниже схема отражает суммарный итог процесса образования пальмитиновой кислоты из уксусной: CH3COOH + 7HOOC - CH2 - COOH + 28[H] C15H31COOH + 7CO2 + 14H2O Этот процесс осуществляется при помощи кофермента А, который превращает кислоты в тиоэфиры и активирует их участие в реакциях нуклеофильного замещения: Некоторые ненасыщенные кислоты (например, олеиновая и пальмитолеиновая) могут синтезироваться в организме человека путем дегидрирования насыщенных кислот. Линолевая и линоленовая кислоты не синтезируются в организме человека и поступают только извне. Основным источником этих кислот служит растительная пища. Линолевая кислота служит источником для биосинтеза арахидоновой кислоты.Она является одной из важнейших кислот, входящих в состав фосфолипидов.Триацилглицерины и фосфатидовые кислоты синтезируются на основе глицеро-3-фосфата, который образуется из глицерина путем его переэтерификации с АТФ. Из общего количества холестерина, содержащегося в организме, только 20% его поступает вместе с пищей. Основное количество холестерина синтезируется в организме с участием кофермента ацетил-КоА. 6.Транспортные формы липидов в крови.Коэффицент атерогенности.Липопротеины – это высокомолекулярные водорастворимые частицы, представляющие собой комплекс белков и липидов. В этом комплексе белки вместе с полярными липидами формируют поверхностный гидрофильный слой, окружающий и защищающий внутреннюю гидрофобную липидную сферу от водной среды и обеспечивающий транспорт липидов в кровяном русле и их доставку в органы и ткани. Плазменные липопротеины – это сложные комплексные соединения, имеющие характерное строение: внутри липопротеиновой частицы находится жировая капля (ядро), содержащая неполярные липиды. Жировая капля окружена оболочкой, в состав которой входят фосфолипиды, белок и свободный холестерин.Классификация: хиломикроны – самые легкие частицы, затем липопротеины очень низкой плотности , липопротеинынизкой плотности и липопротеины высокой плотности . Холестериновый коэффициент атерогенности (К), представЛЯЕТ собой отношение уровня холестерина ЛПНП и ЛПОНП к содержанию холестерина ЛПВП: В клинике очень удобно рассчитывать этот коэффициент на основании определения уровня общего холестерина ихолестерина ЛПВП: Чем выше этот коэффициент (у здоровых лиц он не превышает 3), тем выше опасность развития (и наличия) ИБС.
|
|
|
|
|
|
|
|
|
|
|
|
В-окисление жирных кислот.
окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. 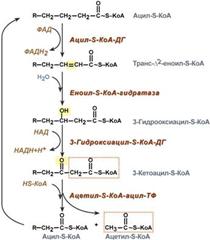
Первая стадия β-окисления — дегидрирование активированной жирной кислоты (ацил-КоА) с образованием β-ненасыщенной жирной кислоты с двойной связью в транс-конфигурации (реакция 1: дегидрирование). При этом оба атома водорода с электронами переносятся от фермента наэлектронпереносящий флавопротеин (ETF). ETF-дегидрогеназа переносит восстановительные эквиваленты на убихинон (кофермент Q), который является составной частью дыхательной цепи. Вторая стадия деградации жирной кислоты состоит в присоединении молекулы воды к двойной связи ненасыщенной жирной кислоты (реакция [2]: гидратирование). На третьей стадии происходит окисление гидроксильной группы при С-3 в карбонильную группу (реакция [3]:дегидрирование). Акцептором для восстановительных эквивалентов является НАД+ который передает их в дыхательную цепь. На четвертой стадии активированная β-кетокислота расщепляется ацилтрансферазой (β-кетотиолазой) в присутствии кофермента А (реакция [4]: тиолитическое расщепление). Продуктами реакции являются ацетил-КоА и активированная жирная кислота, углеродная цепь которой короче на два углеродных атома по сравнению с длиной цепи исходной жирной кислоты.
8.Холестерин, биологическое значение. Биосинтез холестерина до меваловои кислоты. 
Холестери́н - органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов, за исключением безъядерных (прокариоты). Нерастворим в воде, растворим в жирах и органических растворителях. Около 80% холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20% поступают с пищей. 80% холестерина в организме свободные, а 20% — связанные. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов, включая кортизол, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормонатестостерона, играет важную роль в деятельности нервной и иммунной системы. Биосинтез : 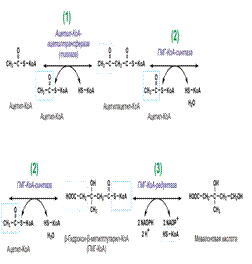
Патологии липидного обмена.
Нормальное содержание общих липидов в сыворотке крови составляет 4-8 г/л. Увеличение общих липидов называется гиперлипемией.
Высокое содержание липидов отмечается при сахарном диабете и голодании, когда гиперлипемия вызвана усиленной мобилизацией из жировых депо жира, необходимого для утоления «энергетического голода» клеток организма. Особенно высоких цифр достигают липиды сыворотки крови при липоидном нефрозе. При этом заболевании отмечается появление липидов в моче – липурия.
Уменьшение содержания липидов сыворотки крови – гиполипемия – отмечается при тяжелых поражениях печени (циррозах) и при гипертиреозе вследствие повышенного окисления жиров.
Триацилглицерины (нейтральные жиры) – нормальное содержание в сыворотке крови составляет 0,27-1,65 ммоль/л. Увеличение их содержания наблюдается при ожирении, нефрозе, диабете, атеросклерозе, гипофункции щитовидной железы параллельно с увеличением общих липидов.
Фосфолипиды – нормальное содержание в сыворотке крови составляет 1,9-4,9 ммоль/л. Повышенное содержание фосфолипидов отмечается при тех же заболеваниях, которые сопровождаются увеличением триацилглицеринов. Уменьшением уровня фосфолипидов сопровождаются тяжелые формы острого гепатита и жировая дистрофия печени, так как именно в печени происходит образование фосфолипидов.
Холестерин. Его содержание в сыворотке крови зависит от возраста. У детей составляет 3,6-3,9 ммоль/л, у пожилых людей – 3,9-6,5 ммоль/л. Увеличение содержания холестерина – гиперхолестеринемия – наблюдается при диабете, липоидном нефрозе, атеросклерозе, механической желтухе, гипофункции щитовидной железы. Особенно высокое содержание холестерина отмечается при наследственной гиперхолистеринемии, когда нарушены процессы регуляции синтеза и распада холестерина.
Снижение содержания холестерина – гипохолестеринемия сопровождает острый панкреатит, острые инфекционные заболевания, туберкулез легких, гиперфункцию щитовидной железы. Особую диагностическую ценность имеет определение холестерина при гепатитах. В начальной стадии заболевания содержание холестерина увеличивается, а затем падает ниже нормы.
10.Эикозаноиды. Пути образования и биологическая роль в организме.Эйкозаноиды большая группа медиаторов, обладающих широким спектром биологической активности.Предшественником эйкозаноидов является арахидоновая кислота. Депонироваться эйкозаноиды не могут, разрушаются в течение нескольких секунд, поэтому клетка должна синтезировать их постоянно из поступающих в неё соответствующих жирных кислот.Выделяют три основные группы эйкозаноидов:простогландины, тромбоксаны, леикотриены. Пути образования из арахидоновои кислоты: 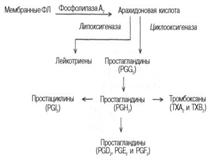
Роль эикозаноидов: Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например бронхиальной астме и аллергическим реакциям.
11.Биологическая ценность белков, потребность в белке и аминокислотах. Азотистыи баланс и его виды.Биологическая ценность белков. Определяется следующими критериями:1.Чем ближе аминокислотный состав пищевого белка к аминокислотному составу беков тела, тем выше его биологическая ценность.2.В составе белка должны быть все незамеимые аминокислоты: вал, илей, лей, лиз, мет, тре, три, фен. Исключение какой-либо незаменимой аминокислоты из пищи сопровождается развитием отрицательного азотистого баланса.3.В составе белка установлены пропорциональные величины незаменимых аминокислот, относительно триптофана, принятого за единицу, лиз-5, лей-4, вал-3,5.Недостаток в пище одной незаменимой аминокислоты ведет к неполному усвоению других аминокислот.Для человека наиболее ценны белки молока, яиц, мяса, т.к. их аминокислотный состав ближе к аминокислотному составу органов и тканей человека.Потребность в белках зависит от пола, веса, интенсивности труда и других факторов. Все эти факторы влияют на суточную потребность в белке(1-1.5г на кг веса) – общее количество белковой пищи, которую человек должен получить в течение светлого времени суток. Азотистый баланс – разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена.Различают 3 вида азотистого баланса:Положительный – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности.Отрицательный – количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей.
Азотистое равновесие – количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека.
12.Переваривание и всасывание белков в ЖКТ.В желудке имеются все условия для переваривания белков. Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная pH среды. Чистый желудочный сок имеет кислую среду (pH 0,9-1,6), а оптимум pH действия пепсина равен 1,5-2,5. Следует особо указать на существенную роль соляной кислоты в переваривании белков: она переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина, в присутствии свободной НС1 происходят набухание белков (увеличение поверхности соприкосновения фермента с субстратом), частичная денатурация и, возможно, гидролиз пищевых белков.
Пепсин гидролизует преимущественно пептидные связи, образованные аминогруппами ароматических аминокислот (фенилаланин, тирозин). Он расщепляет практически все природные белки. Исключение составляют некоторые кератины, протамины, гистоны и мукопротеиды. Дальнейшее превращение белков пищи осуществляется в тонком кишечнике, где на белки действуют ферменты панкреатического и кишечного соков. В поджелудочной железе вырабатываются три белковых фермента: трипсин, химотрипсин и карбоксипептидаза. Первые два фермента действуют на белки аналогично пепсину, но в отличие от него они разрывают другие внутренние пептидные связи. Кроме того, они активны в слабощелочной среде (оптимум pH действия их составляет 7,2-7,8). Благодаря гидролитическому действию всех трех эндопептидаз (пепсина, трипсина, химотрипсина) на белки образуются различной длины пептиды и некоторое количество свободных аминокислот. Дальнейший гидролиз пептидов до свободных аминокислот осуществляется под влиянием группы ферментов - пептидаз.
Продукты гидролиза белков всасываются в желудочно-кишечном тракте в основном в виде свободных аминокислот. Кинетика всасывания аминокислот в кишечнике в опытах in vivo и in vitro свидетельствует о том, что аминокислоты, подобно глюкозе, всасываются свободно с ионами натрия.
Пути использования аминокислот в организме: декарбоксилирование, образование биогенных аминов.
В организме человека содержится около 100 г свободных аминокислот, которые образуют его аминокислотный фонд. Этот фонд постоянно пополняется за счёт поступления новых молекул аминокислот взамен тех, которые были использованы в метаболических процессах. Процесс отщепления карбоксильной группы аминокислот в виде СO2 получил название декарбоксилирования. Несмотря на ограниченный круг субстратов (аминокислот и их производных), подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции (названные биогенными аминами) обладают сильным фармакологическим действием на множество физиологических функций человека и животных. Общая схема процесса декарбоксилирования аминокислот может быть представлена в следующем виде:
R-CH(NH2)-COOH --> R-CH2-NH2 + CO2
В живых организмах открыто четыре типа декарбоксилирования аминокислот.
1.α-Декарбоксилирование.Продуктами реакции являются СО2 и биогенные амины:R-CH(NH2)-COOH -->R-CH2-NH2 + CO2
2.ω-Декарбоксилированне, характерное для микроорганизмов. Например, из аспарагиновой кислоты этим путем образуется α-аланин:НООС-СН2-CH(NH2)-СООН --> СН3-CH(NH2)-СООН + СО2
3.Декарбоксилирование, связанное с реакцией трансаминирования: 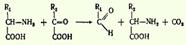 4.Декарбоксилирование, связанное с реакцией конденсации двух молекул:
4.Декарбоксилирование, связанное с реакцией конденсации двух молекул: 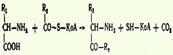
Превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название гниения белков в кишечнике. Так, в процессе постепенного и глубокого распада серосодержащих аминокислот (цистина, цистеина и метионина) в кишечнике образуются сероводород (H2S) и метилмеркаптан (CH3SH). Диаминокислоты, в частности орнитин и лизин, подвергаются процессу декарбоксилирования с образованием протеиногенных аминов. Из ароматических аминокислот фенилаланина, тирозина и триптофана при аналогичном бактериальном декарбоксилировании образуются соответствующие биогенные амины: фенилэтиламин, парагидроксифенилэтиламин (или триптамин) и индолилэтиламин (триптамин). После всасывания эти продукты через воротную вену попадают в печень, где они подвергаются обезвреживанию В печени аминокислоты используются не только для синтеза собственных белков и белков плазмы крови, но также для синтеза ряда специфических азотсодержащих соединений
Накопление биогенных аминов может отрицательно сказаться на физиологическом статусе и вызывать ряд серьезных нарушений в организме. Однако органы и ткани как и целостный организм располагают специальными механизмами обезвреживания биогенных аминов.
14.Дезаминирование, пути использования безазотистых остатков. Доказано существование четырех типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты распада. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака: 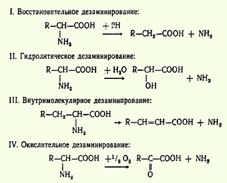
Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Большая часть безазотистых остатков аминокислот превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно аминокислоты пищи.
15.Трансаминирование аминокислот. Диагностическое значение определения активности трансаминаз в организме.
Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. При добавлении к гомогенату мышц глутаминовой и пировиноградной кислот образуются α-кетоглутаровая кислота и аланин без промежуточного образования аммиака; добавление аланина и α-кетоглутаровой кислоты соответственно приводило к образованию пировиноградной и глутаминовой кислот: 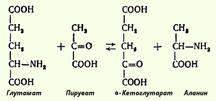 Для клинических целей наибольшее значение имеют две трансаминазы - аспартатаминотрансфераза и аланинаминотрансфераза, катализирующие соответственно следующие обратимые реакции:
Для клинических целей наибольшее значение имеют две трансаминазы - аспартатаминотрансфераза и аланинаминотрансфераза, катализирующие соответственно следующие обратимые реакции:
Аспартат + α-Кетоглутарат <--> ЩУК + Глутамат
Аланин + α-Кетоглутарат <--> ПВ + Глутамат
В сыворотке крови здоровых людей активность этих трансаминаз в среднем составляет 15 и 20 единиц по сравнению с десятками и сотнями тысяч единиц в других органах и тканях. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающихся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. При инфаркте миокарда уровень аспартатаминотрансферазы сыворотки крови уже через 3-5 ч после наступления инфаркта резко повышается, достигая 300-500 единиц.
16.Образование аммиака в организме и пути его обезвреживания. В организме человека подвергается распаду около 70 г аминокислот в сутки; при этом в результате дезаминирования, трансаминирования и окисления биогенных аминов освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. Уровень аммиака в норме в крови не превышает 1-2 мг/л. Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах, является биосинтез глутамина и аспарагина. 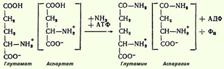 Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи.
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи.
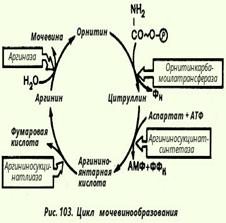
17.Биосинтез мочевины как основнои механизм предотвращения накопления аммиака.Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80-85% всего азота мочи. Кребс полагал, что каталитическую роль орнитина можно было бы объяснить, если бы существовал некий механизм для регенерации аргинина из орнитина, согласно уравнению: Орнитин + СO2 + 2NH3 --> Аргинин + 2H2O
Ниже приведена, кроме того, суммарная реакция синтеза мочевины без учета промежуточных продуктов:
СО2 + NH3 + 3АТФ + 2Н20 + Аспартат --> Мочевина + 2 АДФ + + АМФ + Фумарат + 2 Фн + ФФн
ΔG° = - 40 кДж
18.Синтез креатинина, креатина, креатин-фосфата и их значение ждя организма.Реакция синтеза креатина протекает в две стадии. Первая стадия – биосинтез гуанидинацетата – осуществляется в почках при участии глицин-амидинотранс-феразы: 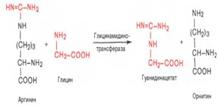
Вторая стадия синтеза креатина протекает в печени при участии гуанидинацетатметилтрансферазы: 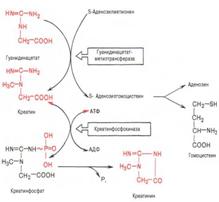
Креатин подвергается фосфорилированию с образованием креатин-фосфата, который после дефосфорилирования(необратимая реакция) превращается в креатинин, выделяющийся с мочой.
Дата добавления: 2018-06-01; просмотров: 617; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
