Определить во сколько раз изменится скорость обратной реакции
2СО (г)+ O2 (г)ó2СO2(г), (9)
если концентрацию СO2 увеличить в 4 раза.
Решение:
Химическая реакция (9) является гомогенной.
Закон действующих масс (кинетическое уравнение) для обратной реакции:
u1 = k × C2(СO2), (10)
где С(СО2)– исходная молярная концентрации углекислого газа СO2.
При увеличении концентрации СO2 в 4 раза:
С2(СО2) = 4×С(СО2),
Скорость обратной реакции станет:
u2 = k × (4)2 × C2(СO2). (11)
Скорости реакции после изменения и до изменения концентрации (сравните уравнения (10) и (11)) отличаются в:
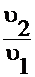 = (4)4 = 16 раз.
= (4)4 = 16 раз.
Ответ: после увеличения концентрации в 4 раза скорость обратной реакции увеличилась в 16 раз.
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
ПРАВИЛО ВАНТ-ГОФФА
Правило Вант–Гоффа: для большинства химических реакций скорость возрастает примерно в 2¸4 раза при повышении температуры на каждые 10 градусов.
u  = u
= u  × γ Dt/10, (12)
× γ Dt/10, (12)
где u  – скорость реакции при начальной температуре;
– скорость реакции при начальной температуре;
u  – скорость реакции при конечной температуре;
– скорость реакции при конечной температуре;
γ = 2¸4 – температурный коэффициент реакции;
t1 и t2 – начальная и конечная температуры реакции, 0С;
Δt = t2 – t1 – изменение температуры системы, 0С.
2.2.2 ПРИМЕР: Влияние температуры на скорость реакции
ЗАДАЧА
Определить во сколько раз изменится скорость реакции при повышении температуры от 250С до 950С. Температурный коэффициент γ = 2,6.
|
|
|
Дано:
t1 = 250С; t2 = 950С
γ = 2,6
Найти: отношение скоростей реакции при разных температурах u  /u
/u  .
.
Решение.
Воспользуемся правилом Вант–Гоффа. Запишем уравнение в следующем виде:
 = γ Dt/10, (13)
= γ Dt/10, (13)
где u  – скорость реакции при начальной температуре t1 = 250С,
– скорость реакции при начальной температуре t1 = 250С,
u  – скорость реакции при конечной температуре t2 = 950С,
– скорость реакции при конечной температуре t2 = 950С,
γ=2,6 – температурный коэффициент реакции;
Δt = t2 – t1 – изменение температуры системы, 0С.
Найдем изменение температуры реакции Δt:
Δt = t2 – t1 = ( 95 – 25 ) 0С = 70 0С . (14)
Подставим найденное значение изменения температуры (14) и заданное значение температурного коэффициента γ в уравнение (13):
 2,6 70/10 = 2,67 = 803,2 раза.
2,6 70/10 = 2,67 = 803,2 раза.
Ответ: при увеличении температуры на 700С скорость данной реакции возросла в 803,2 раза.
2.3 ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ НАЛИЧИЯ КАТАЛИЗАТОРА. КАТАЛИЗ. КЛАССИФИКАЦИЯ КАТАЛИЗАТОРОВ
Химическая реакция, протекающая с участием катализаторов, называется катализом.
Катализаторы – это вещества, активно участвующие в промежуточных стадиях реакции, изменяющие скорость суммарной реакции, но остающиеся после ее протекания в неизменном качестве и количестве.
|
|
|
Ускоряющие катализаторы или катализаторы уменьшают энергию активации реакции, изменяют путь, по которому происходит суммарная реакция, а потому увеличивают скорость всей реакции в целом.
Понятие «ингибиторы» применяют для названия веществ, которые способны замедлять процесс. Ингибиторыувеличивают энергию активации реакции, а потому уменьшают скорость всей реакции в целом.
В случае гомогенного катализа реагирующие вещества и катализатор представляют гомогенную систему (например, реагирующие вещества и катализатор находятся в газообразном состоянии). Каталитическая реакция получения серного ангидрида является гомогенной:
2SO2 (г) + O2 (г) = 2SO3 (г), катализатор – NO(г).
В случае гетерогенного катализа реагирующие вещества и катализатор представляют разные фазы, реакция идет на поверхности катализатора.
Следующие реакции являются примерами гетерогенного каталитического процесса:
2SO2 (г) + O2 (г) = 2SO3 (г), катализатор – V2O5 или Pt;
N2 (г) + 3H2 (г) = 2NH3 (г), катализатор – Fe.
Дата добавления: 2018-06-01; просмотров: 648; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
