Твердые вещества не включаются в запись закона действующих масс.
Сумма показателей степеней при концентрациях в кинетическом уравнении называется порядком реакции.
Таблица 2 Примеры составления кинетических уравнений для гомогенных реакций
| Молекулярность реакции | Реакция | Кинетическое уравнение | Порядок реакции |
| Мономолекулярная | I2 (г.) = 2I(г.) | u = k× C (I2) | 1 |
| Бимолекулярная | H2 (г.)+ I2 (г.)= 2HI(г.) | u = k × C(H2) × C(I2) | 2 |
| Тримолекулярная | О2 (г.)+ 2NO (г.)= =2NO2 (г.) | u =k×C2(NO)×C(О2) | 3 |
Таблица 3 Примеры составления кинетических уравнений для гетерогенных реакций
| Реакция | Кинетическое уравнение | Порядок реакции |
| 2Mg (тв.)+ O2 (г.) = 2MgO(тв.) | u = k× C (O2) | 1 |
| СаСО3 (кр.) = СаО(тв)+СО2(г.) | u = k = const | 0 |
Таблица 3 Примеры составления кинетических уравнений для обратимой реакции N2 (г.)+ 3H2 (г.)ó 2NH3 (г.)
| Реакция | Кинетическое уравнение для прямой реакции | Кинетическое уравнение для обратной реакции |
| Прямая: N2 (г.)+ 3H2 (г.)ó 2NH3 (г.) | u = k×C (N2) × C3(Н2) | |
| Обратная к ней: 2NH3(г.) ó N2 (г.)+ 3H2 (г.) | u = k× C2(NН3) |
1 ПРИМЕРЫ: Влияние концентрации реагентов на скорость реакции
ЗАДАЧА 1
Определить во сколько раз изменится скорость реакции
Mg (тв)+ 1/2СO2 (г) = MgO(тв) + 1/2С(тв), (5)
если концентрацию газа СO2 увеличить в 9 раз.
Решение:
Химическая реакция (5) является гетерогенной.
Закон действующих масс (кинетическое уравнение):
u = k × C1/2(СO2),
где С(СО2)– молярная концентрация углекислого газа;
|
|
|
твердые вещества не включаются.
Очевидно, что при увеличении множителя С(СО2) в 9 раз, скорость реакции увеличится в (9)1/2= 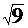 =3 раза.
=3 раза.
Ответ: при увеличении концентрации углекислого газа СО2 скорость реакции увеличится в 3 раза.
Если в задачах такого типа:
- увеличивают объем системы в 3 раза, то это означает, что концентрация каждого из газов уменьшается в три раза;
- увеличивают давление в системе в 3 раза, то это означает, что концентрация каждого из газов увеличивается также в три раза.
ЗАДАЧА 2
Определить во сколько раз изменится скорость прямой реакции
2СО (г)+ O2 (г)ó2СO2(г), (6)
Если объем системы увеличить в 3 раза.
Решение:
Химическая реакция (6) является гомогенной.
Закон действующих масс (кинетическое уравнение) для прямой реакции:
u1 = k × C2(СO) × C(О2), (7)
где С(СО) и С(О2) – исходные молярные концентрации угарного газа и кислорода, соответственно.
При увеличении объема системы в три раза, концентрации каждого из газов уменьшатся в три раза.
Тогда при увеличении объема в 3 раза молярные концентрация угарного газа СО и кислорода О2 станут равными:
|
|
|
С2(СО) = 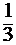 ×С(СО),
×С(СО),
С2(О2) = 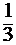 ×С(О2),
×С(О2),
Скорость обратной реакции изменится:
u2 = k × ( 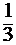 )2 × C2(СO) ×
)2 × C2(СO) × 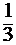 × C(О2). (8)
× C(О2). (8)
Скорости реакции после изменения и до изменения объемов (сравните уравнения (7) и (8)) отличаются в:
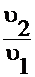 = (
= ( 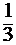 )2×
)2× 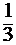 =(
=( 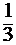 )3 =
)3 = 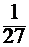 .
.
Ответ: после увеличения объема системы в 3 раза скорость прямой реакции уменьшится в 27 раз.
ЗАДАЧА 3
Дата добавления: 2018-06-01; просмотров: 376; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
