ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИЙ РЕАГИРУЮЩИХ ВЕЩЕСТВ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС
ОСНОВНЫЕ ПОНЯТИЯ КИНЕТИКИ. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Гомогенные и гетерогенные системы или реакции
Система – часть физического мира, ограниченная пространственными рамками.
Фаза– часть системы, отделенная от других ее составляющих поверхностью раздела фаз, при переходе через которую свойства веществ изменяются скачкообразно.
Химические реакции (системы) могут быть гомогенными и гетерогенными.
Таблица 1 Сравнение двух типов реакций или систем: гомогенных и гетерогенных
| Типы реакций или систем/ Параметры сравнения | Гомогенные реакции или системы | Гетерогенные реакции или системы |
| 1 Пример реакций (систем) | Н2О(ж) + С2Н5ОН(ж) HCl(ж)+NaOH(ж)=NaCl(ж)+H2O(ж) N2 (г) + 2О2 (г)= 2NO2 (г) | Fe(тв)+HCl(ж)=FeCl2 (ж)+H2 (г) |
| 2 Реакции или процессы протекают | 1 Во всем объеме системы. 2 В однородной среде (только газы или только жидкости участвуют в реакциях) | 1 На поверхности раздела фаз (на границе раздела фаз). 2 В неоднородной среде (реагирующие вещества могут находиться в разных агрегатных состояниях) |
| 3 Число фаз в системе | Одна фаза | Две и более фазы |
Примечание: в нижнем индексе соединения в скобках указывается агрегатное состояние вещества: (ж) – жидкое; (тв) – твердое; (г) – газообразное.
Скорость химической реакции
Скоростью химической реакцииназывается число элементарных стадий, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций).
|
|
|
Скорость реакции в гомогенной системе определяется изменением количества вещества реагентов реакции в единице объема за единицу времени, тогда:
u = 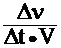 , (1)
, (1)
где u – скорость гомогенной химической реакции, моль×л–1 × с–1;
дельта (D) – изменение соответствующей величины;
Dν – изменение количества вещества, моль;
Dt – промежуток времени, с;
V–объем системы, л.
Известно, что молярная концентрация вещества определяет количество вещества (в моль), содержащегося в 1 л раствора
С =  ,
,
где ν – количество вещества, моль;
V–объем системы, л.
Изменение молярной концентрации вещества DС (в моль/л)
DС = 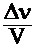 , (2)
, (2)
где D ν – изменение количества вещества реагентов, моль;
V–объем системы, л.
С учетом уравнений (1) и (2) можно записать
u = 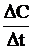 ,
,
где u – скорость гомогенной химической реакции, моль × л–1 × с–1;
DС – изменение молярной концентрации вещества, моль × л –1;
Dt – промежуток времени, с.
Таким образом, скорость гомогенной реакции – изменение молярной концентрации вещества в единицу времени.
В гетерогенной системе реакция протекает на поверхности раздела фаз. Чем больше поверхность, тем больше выход реакции, поэтому скорость процесса относят к единице поверхности:
|
|
|
u = 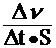 , (3)
, (3)
где u – скорость гетерогенной химической реакции, моль ×м–2×с–1;
S – площадь поверхности раздела фаз, м2.
ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИЙ РЕАГИРУЮЩИХ ВЕЩЕСТВ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС
Математическая зависимость скорости реакции от концентрации реагирующих веществ называется законом действующих масс:
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Рассмотрим уравнение реакции в общем виде:
аА+bB=cC+dD
где А и В – реагенты,
С и D – продукты,
а,b, c, d – стехиометрические коэффициенты.
Закон действующих масс (кинетическое уравнение) для данной реакции:
υ = k CAa CBb , (4)
где а, b – стехиометрические коэффициенты в уравнении реакции;
СА, СB – молярные концентрации реагентов А и B (моль/л);
υ – скорость реакции,
k – константа скорости реакции.
Дата добавления: 2018-06-01; просмотров: 231; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
