Молекулярно-кинетическая теория
Вещество состоит из атомов и молекул, которые находятся в непрерывном хаотическом движении. Молекулы (атомы) взаимодействуют друг с другом с силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Количество молекул в окружающих нас телах очень велико, а размеры частиц малы. Количество вещества ν определяется как отношение числа частиц вещества к постоянной Авогадро NА:

где NA = 6,02·1023 моль–1. Количество вещества измеряется в молях. Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C, а постоянная Авогадро – это количество частиц в одном моле вещества.
Масса одного моля вещества называется молярной массой. Она равна произведению массы одной молекулы вещества m0 на число Авогадро:
M = m0 · NA.
Для молярной массы справедливо соотношение:

Наиболее простой для изучения является модель идеального газа. В ней предполагается, что размеры молекул малы по сравнению с расстояниями между ними. Все соударения молекул между собой и стенками сосуда являются абсолютно упругими, а к движению молекул применимы законы классической механики. Молекулы должны быть распределены по всему объему в среднем равномерно, а их количество должно быть достаточно велико.
Молекулярно-кинетическая теория устанавливает связь между микроскопическими (масса, скорость, кинетическая энергия) и макроскопическими (давление, объем, температура) параметрами.
|
|
|
Основное уравнение молекулярно-кинетической теории:

где n – концентрация вещества,  – среднеквадратичная скорость молекул, Eср – средняя кинетическая энергия поступательного движения молекул, k = 1,38·10–23 Дж/К – постоянная Больцмана. В состоянии равновесия скорости молекул распределены по закону Максвелла.
– среднеквадратичная скорость молекул, Eср – средняя кинетическая энергия поступательного движения молекул, k = 1,38·10–23 Дж/К – постоянная Больцмана. В состоянии равновесия скорости молекул распределены по закону Максвелла.

Рис. 1. Распределение молекул по скоростям
Температура вещества может измеряться по различным температурным шкалам. По температурной шкале Цельсия TC точке плавления льда при нормальном атмосферном давлении приписывается температура 0 °С, а точке кипения воды – +100 °С. Изменение длины столба жидкости в термометре на одну сотую длины между отметками 0 °С и 100 °С принимается равным 1 °С. В ряде стран (например, США) широко используется шкала Фаренгейта (TF), в которой температура замерзающей воды принимается равной 32 °F, а температура кипения воды – равной 212 °F.
В физике общепринятой является абсолютная температура T. Ее точка отсчета смещена относительно шкалы Цельсия на 273,15 єC, а единица шкалы – кельвин – совпадает с градусом Цельсия. Таким образом:
|
|
|
T = TC + 273,15 єС.
Законы идеального газа
Давление p, объем V и температура T идеального газа связаны между собой уравнением Менделеева–Клапейрона:

Здесь ν – количество вещества, R = 8,31 Дж/(моль·К) – универсальная газовая постоянная.
Если температура газа остается постоянной, то выполняется закон Бойля–Мариотта:
pV = const.

Рис. 1. Изотермический процесс
Если постоянным остается давление, то выполняется закон Гей-Люссака:


Рис. 2. Изобарный процесс
Наконец, если постоянен объем, то справедлив закон Шарля:


Рис. 3. Изохорный процесс
Для смеси газов справедлив закон Дальтона. Давление смеси идеальных газов равняется сумме парциальных давлений каждого из газов в отдельности.
Первое начало термодинамики
Молярной теплоемкостью C называется количество теплоты, которое необходимо передать 1 молю вещества, чтобы его температура увеличилась на 1 Кельвин:

В термодинамике широко используются понятия молярной теплоемкости при постоянном объеме CV и молярной теплоемкости при постоянном давлении Cp. В идеальном газе они удовлетворяют уравнению Майера:
Cp – CV = R.
|
|
|
Теплоемкость одного моля одноатомного идеального газа при постоянном объеме равна  , двухатомного –
, двухатомного –  , многоатомного – 3R.
, многоатомного – 3R.
Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре:
U = CVT.
Работа ДA, совершаемая газом, определяется давлением газа и изменением его объема:
ΔA = pΔV.
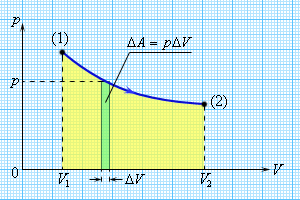
Рис. 1. Если давление газа в процессе совершения работы изменяется, то работа может быть найдена по площади под графиком

Рис. 2. Работа газа зависит от пути, по которому газ переходит из состояния 1 в состояние 2
Первое начало термодинамики. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами:
Q = ΔU + A.
В изохорном процессе газ работы не совершает, и ΔU = Q. В изобарном процессе A = pΔV = p (V2 – V1). В изотермическом процессе ΔU = 0, и A = Q; вся теплота, переданная телу, идет на работу над внешними телами. Графически работа равна площади под кривой процесса на плоскости p, V.

Рис. 3. Первое начало термодинамики для изохорного процесса
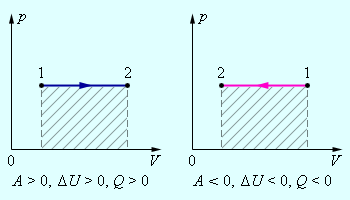
Рис. 4. Первое начало термодинамики для изобарного процесса

Рис. 5. Первое начало термодинамики для изотермического процесса
|
|
|

Рис. 6. Первое начало термодинамики для адиабатного процесса
Адиабатным называется квазистатический процесс, при котором системе не передается тепло из окружающей среды: Q = 0. В адиабатном процессе вся работа совершается за счет внутренней энергии газа.
Тепловые двигатели
Тепловым двигателем называется устройство, способное превращать часть полученного количества теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. Тепловой резервуар с более высокой температурой, передающий теплоту тепловому двигателю, называется нагревателем, а забирающий остатки тепла с целью вернуть рабочее тело в исходное состояние – холодильником. Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т. д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется.

Рис. 1. Энергетическая схема теплового двигателя
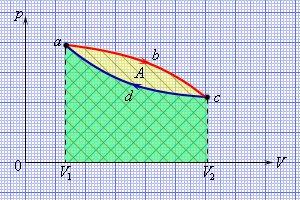
Рис. 2. Полезную работу, совершенную тепловым двигателем за один цикл, можно найти как площадь, ограниченную графиком процесса на плоскости pV.
Коэффициентом полезного действия (КПД) теплового двигателя называется отношение полезной работы, совершенной двигателем, ко всей энергии Q1, полученной при сгорании топлива (то есть от нагревателя):

Наибольшим среди тепловых машин КПД при заданных температурах нагревателя и холодильника обладает тепловая машина, работающая по циклу Карно. Цикл Карно состоит из двух адиабат и двух изотерм. КПД цикла Карно равен

где T1 – температура нагревателя, T2 – холодильника.

Рис. 3. Цикл Карно
Дата добавления: 2018-06-01; просмотров: 367; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
