ЗАКОН ФОРМИРОВАНИЯ СПЕКТРОВ АТОМОВ И ИОНОВ
Введение
Спектры атомов и ионов – самый большой массив экспериментальной информации об обитателях микромира, но человек научился использовать лишь мизерную часть этой научной информации. У историков науки достаточно информации, чтобы убедительно доказать, что закон формирования спектров атомов открыл Канарёв Ф.М. Изложим часть этой информации.
12.2. В чём сущность и главная особенность этого раздела физики и химии? Спектроскопия содержит уже более миллиона спектральных линий атомов, ионов и молекул. Это самый большой массив экспериментальной информации о микромире [1], [2].
12.3. Какая часть этой информации уже расшифрована и приносит пользу? Точный ответ трудно сформулировать, а примерная оценка такая. Около 1% информации, содержащейся в спектрах атомов, ионов и молекул расшифрована. Менее 1% из расшифрованной информации приносит пользу.
12.4. Почему так медленно развивается процесс извлечения пользы из такого большого массива экспериментальных данных? Потому что точный расчёт спектров начинался и заканчивался спектром атома водорода, а спектры всех остальных атомов и ионов рассчитывались по приближённым формулам, не содержащим общей закономерности формирования спектров атомов и ионов.
12.5. Когда были открыты спектры? Спектры были получены давно, но не было теории, позволяющей понимать закон формирования спектров, созданный Природой.
|
|
|
12.6. На чём основывается такое утверждение? Законы Природы, которые мы собираемся познать и представить в виде математических зависимостей, обычно просты и в этом сложность их открытия. Когда закон, реально управляющий процессом или явлением, например формированием спектров, не открыт, то учёные начинают изощряться и разрабатывать математические модели, которые дают лишь приближённые результаты и не раскрывают физику описываемого процесса или явления. Именно такая судьба досталась и спектроскопии. Были разработаны приближённые методы расчёта спектров, из которых не следовали никакие физические законы, созданные Природой для управления процессами формирования спектров.
12.7. Когда же был открыт закон формирования спектров атомов и ионов? Он был открыт в середине девяностых годов прошлого века и тогда же был опубликован. А потом его публикации были многократно повторены в журналах, брошюрах, книгах и в Интернете [2].
12.8. Почему же этот закон до сих пор не признан и студенты не изучают его? Не хотелось бы отвечать на этот вопрос. Но можно спрогнозировать то, что напишут об этом историки науки. Этот закон был открыт вдали от научных центров, и у его автора не было покровителей, которые бы влияли на средства научной информации, чтобы надуть ему научный авторитет и таким образом привлечь внимание научной общественности к этому закону.
|
|
|
12.9. Как автор закона формирования спектров и новой теории микромира относится к этому? Как к историческому счастью, позволившему ему безмятежно искать научные истины без оглядки на «научные авторитеты».
12.10. Какое главное следствие следует из закона формирования спектров атомов и ионов? Отсутствие орбитального движения электронов в атомах.
12.11. Как это влияет на научный интеллект молодёжи – нашего будущего? Нет никакого сомнения в том, что будущие поколения отнесут процесс преподавания ошибочных взглядов на строение атомов к разряду интеллектуального насилия над ними, начало которому положили поклонники Эйнштейна путём блокирования доступа такой информации к научно-образовательной власти России.
12.12. Есть ли факты, доказывающие вышеприведённое утверждение? Конечно, есть и их немало, но нам уже надоело оглашать их из-за того, что все уровни научной власти игнорируют их. Молчит и комитет по борьбе с лженаукой, демонстрируя предельно низкий научный интеллект своих «научных экспертов» (рис. 83).
12.13. Но ведь, нужен же какой-то орган для противодействия распространению ошибочных научных знаний, публикуемых в Интернете? Безусловно, нужен. Он должен дополнять естественное стремление самой научной общественности искать не ошибочные, а достоверные результаты научных исследований. И называть этот комитет надо, как комитет научных экспертов, а не борцов с лжеучёными. Главная задача учёных этого комитета - выявление достоверных научных знаний, публикуемых в Интернете.
|
|
|
12.14. Почему же не реализуется столь очевидная необходимость в комитете по выявлению новых достоверных научных знаний? Ответ элементарен. Потому что нет научных экспертов, способных делать такую работу.
12.15. Почему нет научных экспертов по выявлению новых достоверных научных результатов? Ответ тоже элементарен. Потому что наука уже так усложнилась и развивается так быстро, что лишает учёного со старым запасом знаний возможности понимать новое.

Рис. 83: а) спектр атома водорода; b) молекулярный спектр
12.16. Почему лишает? Потому что устаревшие знания в его голове базируются на устаревших критериях оценки достоверности новых знаний.
12.17. Разве могут установленные однажды критерии научной достоверности результатов научных исследований быть ошибочными? История формирования критериев научной достоверности ещё не изучалась и не обобщалась. Однако, она сама формируется в голове исследователя, работающего в режиме самообразования.
|
|
|
12.18. Что понимается под режимом самообразования? В режиме самообразования работают те учёные, которые, встретив фундаментальное научное противоречие, начинают искать его причину. И ищут её до тех пор, пока она не будет выявлена, проверена и исправлена.
12.19. К чему же приводит такой подход к научному поиску? Как правило, – к установлению ошибочности старого критерия научной достоверности и выявлению нового, неошибочного критерия научной достоверности.
12.20. Признают ли учёные новые критерии научной достоверности, в головах которых – старые, ошибочные критерии такой достоверности? Нет, конечно, не признают, так как этот процесс управляется законом Природы, а не разумом тех, кто обязан разбираться в достоверности нового научного результата.
12.21. Кто же открыл этот закон и как он сформулирован? Его открыл крупный учёный XX века, Макс Планк и сформулировал его следующим образом: «Обычно новые научные истины побеждают не так, что их противников убеждают и те признают свою неправоту, а большей частью так, что противники эти постепенно вымирают, а подрастающее поколение усваивает новую научную истину сразу» [2]
12.22. Что следует из этого закона? История российской науки уже убедительно доказала неотвратимость реализации этого закона в реальной жизни.
Конечно, эта неотвратимость уже принесла государству ущерб, который потомки не смогут вложить ни в какие триллионы. Судите сами, школьники и студенты изучают полностью ошибочную динамику Ньютона, более 80% глубоко ошибочных физических и более половины глубоко ошибочных химических знаний. В их головы закладываются ошибочные критерии оценки достоверности изучаемого. Это значит, что всем выпускникам инженерных профилей выдаются дипломы инженеров с фактически «дебильными» знаниями и некому спасти их от этой участи, так как всё идёт по планковскому закону признания научных истин: только после ухода из жизни их главных противников.
12.23. Что же надо сделать немедленно, чтобы желать здравия всем академикам и блокировать работу планковского закона о признании новых научных знаний? Пока сохраняется возможность заблокировать работу планковского закона признания научных истин, но она очень зыбкая, так как базируется на знаниях лишь одного человека, способного прочесть полный курс лекций о новых критериях научной достоверности для совершенно новых специалистов – научных экспертов. Конечно, их надо готовить по специальной министерской программе, но в головах всех министерских работников - старые критерии научной достоверности и нет силы, способной убедить их в необходимости иметь специалистов с новыми критериями научной достоверности. В результате круг замыкается и остаётся один выход – ждать полной реализации планковского закона признания новых научных результатов. Те, кто не желает такой участи, могут последовать за нами. Несмотря на глубокий пенсионный возраст, я имею ещё возможность освободить от дебилизации тех, кто читает мои ответы на научные вопросы.
12.24 Это - удивительная информация. Она убедительно доказывает абсолютную безответственность исполнительной государственной Власти, формирующей государственную научно-образовательную политику путём блокирования элементарного здравомыслия всех государственных научно-образовательных чиновников. Почему так происходит? Это вопрос историкам науки, но ответ на него будет оглашён официально не при нашей жизни.
12.25. Почему? Потому что некому. Блокирует этот процесс низость научно-образовательного интеллекта у тех, кто формирует научно-образовательную политику и воплощает её в жизнь.
12.26. В чём суть причины такого состояния научно-образовательной политики? Она в допуске к Властным функциям только тех, кто умеет льстить Президенту страны.
12.27. Почему сформировалась такая ситуация? Потому что все предшествующие годы средства массовой информации убеждали всех, что главный критерий научной достоверности результата научных исследований - авторитет автора научного результата.
12.28. В чём суть этой ошибки? В том, что в Природе существуют естественные критерии оценки достоверности научного результата. Их открыл Евклид в III-м веке до нашей эры. Но они были проигнорированы. Так велико было желание иметь национальных героев в научных достижениях. Главные из них уже известны, как творцы ошибочных научных идей.
12.29. Какой же выход из этой кошмарной ситуации? У нас выход один: скорбим о продолжающейся дебилизации молодёжи и продолжаем анализ спектроскопии для тех, кто уже понимает причины своей научной отсталости и тех, кто уже понял, что при нынешней Власти самообразование - единственный путь формирования достоверности личного научного интеллекта.
12.30. Можно ли представить последовательно рождение закона формирования спектров? Представляем.
12.31. Что явилось началом формирования представлений об орбитальном движении электронов в атомах? Известно, что идея орбитального движения электронов в атомах родилась из постулата Бора [2].
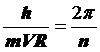 . (62)
. (62)
12.32. Есть ли вывод математической модели этого постулата? Есть, он следует из постулата Луи – де - Бройля, согласно которому на каждой орбите укладывается целое число 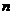 волн электрона.
волн электрона.
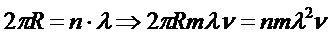 . (63)
. (63)
12.33. Как приводится соотношение (63) к постулату Бора (62)? Учитывая, что 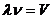 и
и 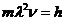 , и подставляя эти данные в формулу (63), получаем постулированное соотношение Нильса Бора (62).
, и подставляя эти данные в формулу (63), получаем постулированное соотношение Нильса Бора (62).
12.34. Есть ли противоречия в математической модели постулата Бора (62)? Есть, и немало. Главное из них - равенство длины волны электрона длине его первой орбите. На первой орбите n=1 и из формулы (62) следует 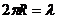 , то есть, когда электрон находится на первой орбите, то длина его волны равна длине окружности орбиты.
, то есть, когда электрон находится на первой орбите, то длина его волны равна длине окружности орбиты.
12.35. Как ученые отнеслись к этому противоречию? Проигнорировали его.
12.36. По какому закону, следующему из орбитального движения электрона, изменяются энергии поглощаемых и излучаемых фотонов при переходе электронов между орбитами? Из постулата Бора (62) следует формула для расчета спектра атома водорода при переходе электрона с орбиты n2 на орбиту n1.
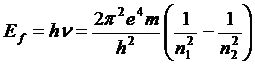 . (64)
. (64)
12.37. Что означает выражение перед скобками в формуле (64)? Это постоянная Бальмера-Ридберга. Она равна энергии ионизации атома водорода 13,60eV.
12.38. Можно ли использовать формулу (64) для расчёта спектров других атомов? Нет, нельзя. Так как выражение перед скобками - численная величина равная энергии ионизации одного единственного атома – атома водорода.
12.39. Как же вышли из этого затруднения теоретики-спектроскописты? Очень просто. Вместо того чтобы искать причины возникшей трудности они начали плодить обилие предельно сложных и запутанных методов приближённого расчёта спектров атомов и ионов, из которых невозможно было понять физическую суть процесса формирования спектров и принцип взаимодействия электронов с протонами ядер атомов.
12.40. Можно ли привести литературный источник с бесплодными теоретическими результатами по расчёту спектров? Классической в этом отношении является книга Никитин А.А. Рудзикас З.Б. Основы теории спектров атомов и ионов. М.: Наука. 1983. В ней нет ни единого достойного примера расчёта спектра. Все страницы заполнены математическими крючками ни малейшим образом не отражающими реальность – любимейшее творение большей части математиков-теоретиков.
12.41. Каким понятием надо заменить старое понятие орбита, чтобы не путаться в новых представлениях о структуре атомов, которые должны следовать из их спектров? Чтобы легче формировались новые представления о взаимодействии электронов с протонами ядер, надо понятие орбита заменить понятием энергетический уровень и представлять эти уровни, как дискретные расстояния между протонами ядер атомов и их электронами.
12.42. Известно, что энергия ионизации атома водорода равна 13,60eV. Это означает, что, когда электрон находится на первом энергетическом уровне, то энергия связи его с протоном равна 13,60eV. Чему равна энергия фотона, который должен поглотить электрон, чтобы перейти с первого энергетического уровня на второй? Эта энергия стоит первой в экспериментальном ряду энергий, соответствующих, как сказано в справочниках, стационарным энергетическим уровням. Она равна 10,20eV.
12.43. Известно, что при переходе электрона атома водорода на второй энергетический уровень его энергия связи с протоном уменьшается и становится равной 3,40 eV. Это значит, что при сложении энергий 13,60eV и 10,20eV должен получаться результат 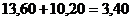 но, он абсурден. Как учёные выкрутились из этого положения? Они поступили очень просто. Произвольно переписали указанную формулу так
но, он абсурден. Как учёные выкрутились из этого положения? Они поступили очень просто. Произвольно переписали указанную формулу так
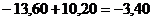 (65)
(65)
и объяснили свои действия тем, что появившиеся минусы – результат отрицательности заряда электрона. Ловко, не правда ли?
12.44. Какой запрет существует для такого объяснения? Дело в том, что, как мы уже знаем, полная энергия электрона состоит из двух составляющих: потенциальной и кинетической. Потенциальную часть можно представить отрицательной, а вот кинетическую нет, так как она представляет произведение массы электрона на квадрат скорости света и в силу этого всегда является величиной положительной. В результате отрицательность заряда электрона не может служить основанием для введения в формулу (65) минусов.
12.45. А в чём же истинная причина появления минусов в формуле (65)? Истинная причина заключается в том, что все энергии, представленные в формуле (65), – лишь части общей энергии электрона, которые надо было вычесть из его полной энергии 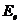 и формула (65) становится такой
и формула (65) становится такой
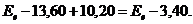 (66)
(66)
12.46. Как из формулы (66) получить формулу (65)? Сокращая слева, и справа полную энергию 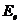 электрона, получим формулу (65) с законным присутствием в ней минусов, которые теперь проясняют их физический смысл, отсутствующий во всех приближённых формулах для расчёта спектров.
электрона, получим формулу (65) с законным присутствием в ней минусов, которые теперь проясняют их физический смысл, отсутствующий во всех приближённых формулах для расчёта спектров.
12.47. В чём сущность этого физического смысла? В том, что начальным энергетическим уровнем любого электрона в любом атоме является первый энергетический уровень. Оказавшись на нём, в результате излучения серии фотонов, электрон начинает поглощать другие фотоны и переходить на более высокие энергетические уровни, номера которых увеличиваются.
12.48. Значит ли это, что у каждого электрона в каждом атоме существует максимально возможный энергетический уровень, начиная с которого при встрече с протоном, он ступенчато приближается к протону, излучая фотоны и формируя спектры? Конечно, значит.
12.49.С какого энергетического уровня электрон атома водорода, устанавливает контакт с протоном и начинает приближаться к нему? Электрон атома водорода устанавливает связь с протоном, начиная со 108 энергетического уровня (n=108).
12.50. Из каких экспериментальных данных это следует? Из спектра излучения Вселенной. Во Вселенной водород – самый распространённый химический элемент. Его там 73%. Синтез атома водорода формирует максимум излучения Вселенной.
12.51. Как записывается энергетический баланс электрона при переходе его с первого на третий и четвёртый энергетические уровни? Он представлен в формулах:
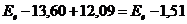 , (67)
, (67)
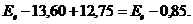 (68)
(68)
12.52. Какой же закон формирования спектра атома водорода следует из рассмотренной последовательности (65…68) изменения энергий электрона и фотонов, поглощаемых им при энергетических переходах, в момент удаления от протона? Он представлен в формуле [2].
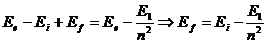 , (69)
, (69)
где: 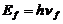 - энергия поглощенного или излученного фотона;
- энергия поглощенного или излученного фотона; 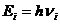 - энергия ионизации, равная энергии такого фотона, после поглощения которого, электрон теряет связь с ядром и становится свободным;
- энергия ионизации, равная энергии такого фотона, после поглощения которого, электрон теряет связь с ядром и становится свободным; 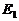 - энергия связи электрона с ядром атома, соответствующая первому энергетическому уровню, также равна энергии фотона.
- энергия связи электрона с ядром атома, соответствующая первому энергетическому уровню, также равна энергии фотона.
12.53. Позволяет ли формула (69) рассчитать спектр атома водорода? Позволяет. Спектр атома водорода представлен в табл. 5. Спектр межуровневых переходов электрона в атоме водорода представлен в табл. 6.
12.54. Можно ли считать математическую модель (69) законом формирования спектров атомов и ионов? Дальше мы увидим, как эта математическая модель позволит нам рассчитать спектр первого электрона атома гелия, на котором споткнулись теоретики около 100 лет назад и начали плодить приближённые методы расчёта спектров. Потом мы рассчитаем с помощью этой же формулы спектры других атомов и ионов, и опишем методику её использования. В результате и появятся основания считать математическую модель (65) законом формирования спектров атомов и ионов.
Таблица 4. Спектр атома водорода
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп) (эксп)
| eV | 10,20 | 12,09 | 12,75 | 13,05 | 13,22 |
 (теор) (теор)
| eV | 10,198 | 12,087 | 12,748 | 13,054 | 13,220 |
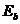 (теор) (теор)
| eV | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 |
Таблица 7. Энергии межуровневых переходов электрона атома водорода
| Уровни | 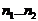
| 2...3 | 3...4 | 4...5 | 5...6 | 6...7 | 7...8 |
 (экп.) (экп.)
| eV | 1,89 | 0,66 | 0,30 | 0,17 | 0,10 | 0,07 |
 (теор) (теор)
| eV | 1,888 | 0,661 | 0,306 | 0,166 | 0,100 | 0,065 |
12.55. Из какой математической модели следует отсутствие орбитального движения электрона? Закон формирования спектров атомов и ионов (69) легко приводится к виду
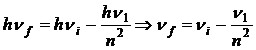 . (70)
. (70)
В этой математической модели нет составляющей, представляющей орбитальную энергию электрона. Это автоматически означает, что электрон не совершает такого движения в атоме.
12.56. Какое следствие вытекает из этого для химиков? Немедленно прекратить преподавание аналитической химии и немедленно написать новый учебник по аналитической химии для школ и вузов [2].
12.57. Сколько лет длится указанная необходимость немедленности действий химиков? Более 30 лет.
12.58. Информировал ли автор Президента и Премьера об указанной необходимости? Тяжёлый вопрос. Информировал многократно, но разве не видно по телевидению и по публикациям в Интрнете беднейший научный интеллект советников президента по науке? [9].
12.59. Какое взаимодействие между электроном и протоном атома водорода следует из формулы (70)? В конечном выражении этой формулы представлены лишь частоты излучаемых и поглощаемых фотонов и нет орбитальной энергии электрона. Это значит, что атомарный электрон взаимодействует с протоном не орбитально, а линейно.
12.60. Могут ли разноименные электрические заряды электрона и протона сближать их при формировании атома водорода, а одноимённые магнитные полюса - ограничивать это сближение? Это - наиболее работоспособная и, даже можно сказать, единственная гипотеза.
12.61. По какому закону изменяются энергии связи электрона с протоном? Ответ следует из формулы (71) [2]
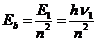 . (71)
. (71)
При этом в атоме водорода энергия связи 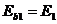 электрона с ядром атома, соответствующая первому энергетическому уровню, равна энергии его ионизации
электрона с ядром атома, соответствующая первому энергетическому уровню, равна энергии его ионизации 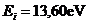 .
.
12.62. Если рассматривать процесс излучения фотонов электроном при его сближении с протоном, то изменится ли закон формирования спектров? Нет, конечно. Его математическая модель
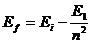 , (72)
, (72)
полностью совпадает с видом конечной части модели (69), описывающей процесс поглощения фотонов электроном.
12.63. Можно ли из закона формирования спектров получить формулу (72) Нильса Бора для расчёта спектра при межуровневых переходах электрона? Она автоматически получается из законов (69 или 72) формирования спектров [2].
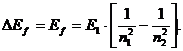 (73)
(73)
12.64. Чем формула (73) принципиально отличается от аналогичной боровской формулы (64)? Тем, что в новой формуле (73) перед скобками стоит энергия связи любого электрона с протоном ядра в момент пребывания его на первом энергетическом уровне, а в формуле Бора (64) перед скобками – постоянная Бальмера - Ридберга.
12.65. Являются ли энергии единичных фотонов и единичных электронов величинами векторными? Последние исследования показали, что линейная частота 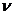 , при которой передается и принимается электронная информация - величина скалярная. С учетом этого предполагалось, что энергия единичного фотона, равная произведению векторной величины
, при которой передается и принимается электронная информация - величина скалярная. С учетом этого предполагалось, что энергия единичного фотона, равная произведению векторной величины 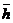 на скалярную
на скалярную 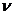 - величина векторная. Однако новый анализ показал, что линейная частота
- величина векторная. Однако новый анализ показал, что линейная частота 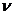 колебаний единичных фотонов – величина векторная. Тогда в формуле
колебаний единичных фотонов – величина векторная. Тогда в формуле 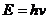 величины h и v - обе векторные (рис. 84). Так как они направлены вдоль одной оси в одну и ту же сторону, то их векторное произведение равно нулю, что исключает векторные свойства энергий единичных фотонов и электронов.
величины h и v - обе векторные (рис. 84). Так как они направлены вдоль одной оси в одну и ту же сторону, то их векторное произведение равно нулю, что исключает векторные свойства энергий единичных фотонов и электронов.
12.66. Почему у электрона направления векторов спина и магнитного момента совпадают, а у протона - противоположны? Главное условие формирования связей между частицами – совпадение направлений вращений соединяющихся частиц. Поскольку процесс соединения формируется электронами и протонами, то совпадение направлений вращений этих частиц (эквивалентно совпадению направлений их спинов 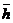 ) возможно лишь при условии, если векторы спина
) возможно лишь при условии, если векторы спина  и магнитного момента
и магнитного момента  у электрона будут совпадать, а у протона их направления будут противоположны. Дальше мы увидим, как ярко это условие проявляется при формировании молекул.
у электрона будут совпадать, а у протона их направления будут противоположны. Дальше мы увидим, как ярко это условие проявляется при формировании молекул.
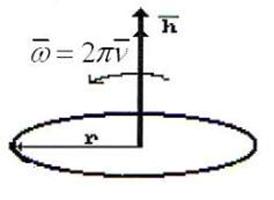
Рис. 84. Схемы к определению векторных свойств энергий фотонов
12.67. Сколько энергетических уровней имеет электрон атома водорода и электроны других атомов? Электрон атома водорода имеет, примерно, 108 рабочих энергетических уровня. Электроны всех других атомов имеют, примерно, такое же количество энергетических уровней.
12.68. Какой эксперимент доказывает, что у атома водорода 108 энергетических уровней и у электронов других атомов, примерно, столько же? Во Вселенной 73% водорода, 24% гелия и 3% всех остальных химических элементов. Процессы синтеза атомов водорода и гелия идут в звёздах Вселенной непрерывно. Поскольку процессы синтеза сопровождаются излучением фотонов, то это значит, что максимум излучения Вселенной формируют фотоны, излучаемые при синтезе атомов водорода и гелия. Длина волны этого максимума давно измерена и составляет около 0,001м (рис. 85) [2].
12.69. Можно ли рассчитать энергетический уровень, с которого начинается формирование атома водорода при встрече электрона с протоном? Можно. Приводим расчёт. Длина волны фотонов, формирующих максимум излучения Вселенной, равна  . Энергии фотонов, формирующих этот максимум, равны [2]
. Энергии фотонов, формирующих этот максимум, равны [2]
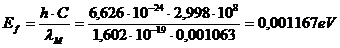 . (74)
. (74)
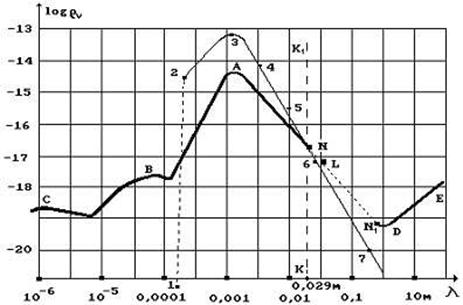
Рис. 85. Спектр излучения Вселенной
Энергия связи электрона с протоном на последнем энергетическом уровне равна энергии фотона, поглотив, который он станет свободным. Поскольку энергии поглощаемых и излучаемых фотонов на одноимённых энергетических уровнях одинаковые, то, используя закон формирования энергий связи электронов с протонами ядер (74), имеем по закону
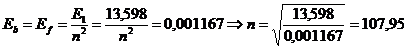 . (75)
. (75)
12.70. Почему нет экспериментальной спектральной линии (рис. 83), соответствующей первому энергетическому уровню атома водорода и равной энергии его ионизации 13,598eV? Этой спектральной линии нет не только в спектре атома водорода, но и в спектрах других атомов. Точная причина ещё неизвестна. У атома водорода эта линия находится в глубокой ультрафиолетовой области. Если её не удалось зафиксировать до сих пор, то одной из причин её отсутствия может служить достаточно большой градиент температуры в зоне формирования плазмы атомарного водорода. По этой причине электрон не может перейти сразу со 108 энергетического уровня на первый и излучить фотон, энергия которого равна энергии ионизации атома водорода 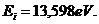
12.71. Когда номер (n) энергетического уровня увеличивается, то из формулы (75) следует, что энергия связи электрона с протоном ядра приближается к нулю. Означает ли это, что все электроны всех атомов отделяются от их ядер с одной и той же массой и одним и тем же зарядом? Это явное, однозначное следствие новой теории спектров.
12.72. По какому закону изменяются энергии фотонов  , поглощаемых электронами при их последовательном переходе с нижних на верхние энергетические уровни? Ответ следует из формулы (75).
, поглощаемых электронами при их последовательном переходе с нижних на верхние энергетические уровни? Ответ следует из формулы (75).
12.73. По какому закону изменяются энергии фотонов  , излучаемых электронами при их последовательном переходе с верхних на нижние энергетические уровни? Если не учитывать знак энергии, то ответ следует из формулы (72).
, излучаемых электронами при их последовательном переходе с верхних на нижние энергетические уровни? Если не учитывать знак энергии, то ответ следует из формулы (72).
12.74. Существует ли математическая модель для расчета спектра любого электрона, любого атома и можно ли считать эту модель законом формирования спектров атомов и ионов? Мы уже ответили, что это формула (73). Она позволяет рассчитывать спектр любого атома при условии правильного экспериментального определения энергии связи 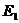 любого электрона в момент пребывания его на первом энергетическом уровне. Например, в рамках приемлемой погрешности энергии связи обоих электронов атома гелия (табл. 10), соответствующие первому энергетическому уровню (
любого электрона в момент пребывания его на первом энергетическом уровне. Например, в рамках приемлемой погрешности энергии связи обоих электронов атома гелия (табл. 10), соответствующие первому энергетическому уровню ( 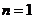 ), рассчитываются по формуле
), рассчитываются по формуле 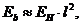 в которой:
в которой:  - энергия ионизации атома водорода;
- энергия ионизации атома водорода; 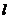 - номер электрона в атоме, соответствующий номеру потенциала его ионизации. С учётом этого формула для расчета энергии связи любого электрона атома гелия, соответствующая любому энергетическому уровню, будет такой
- номер электрона в атоме, соответствующий номеру потенциала его ионизации. С учётом этого формула для расчета энергии связи любого электрона атома гелия, соответствующая любому энергетическому уровню, будет такой
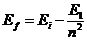 ;
; 
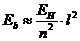 . (76)
. (76)
Совпадение результатов расчетов по формуле (76) с экспериментальными результатами, представленными в табл. 7, доказывает правильность гипотезы о том, что первый электрон атома гелия имеет такие же энергии связи с протоном ядра, какие есть у электрона атома водорода.
Обратим внимание на необходимость запомнить этот момент. Он является главным во всей во всей методологии расчёта спектров атомов и ионов.
12.75. Был ли контакт у автора закона формирования спектров со специалистами из Всероссийского научно-исследовательского института спектроскопии? Да, был. Причём непосредственно с его директором Виноградовым. Это было ещё в прошлом веке. Он пригласил меня принять участие в конференции по спектроскопии. Я отослал доклад и получил ответ, в котором меня информировали, что конференция посвящена традиционным методам расчёта спектров, а я предлагаю нетрадиционный, поэтому мой доклад не может быть включён в программу конференции.
Таблица 8. Энергии связи 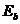 электрона атома водорода
электрона атома водорода 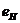 , первого
, первого 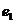 и второго
и второго 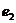 электронов атома гелия
электронов атома гелия 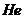 с ядрами
с ядрами
| N | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
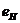
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 |
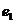
| - | 3,37 | 1,50 | 0,85 | 0,55 | 0,38 | 0,28 | 0,22 | 0,17 |
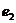
| 54,4 | 13,6 | 6,04 | 3,40 | 2,18 | 1,51 | 1,10 | 0,85 | 0,67 |
12.76. Энергия ионизации атома гелия, то есть энергия удаления первого электрона из атома равна 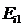 =24,587eV, а из атома водорода -
=24,587eV, а из атома водорода - 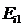 =13,598eV. Разве можно рассчитать спектр первого электрона атома гелия по математической модели закона (76) формирования спектров при такой большой разнице в энергиях ионизации атома водорода и атома гелия? Да, эта разница была главной преградой на пути теоретиков-спектроскопистов в поиске закона формирования спектров атомов и ионов. Это и повело их по пути разработки приближённых методов расчёта спектров. Но нас эта разница не испугала, и мы искали её причину более года и нашли. В результате оказалось, что энергия связи первого электрона атома гелия с протоном ядра в условиях, когда оба электрона находятся в атоме, равна 13,47eV и сразу заработал закон формирования спектров (формула 72).
=13,598eV. Разве можно рассчитать спектр первого электрона атома гелия по математической модели закона (76) формирования спектров при такой большой разнице в энергиях ионизации атома водорода и атома гелия? Да, эта разница была главной преградой на пути теоретиков-спектроскопистов в поиске закона формирования спектров атомов и ионов. Это и повело их по пути разработки приближённых методов расчёта спектров. Но нас эта разница не испугала, и мы искали её причину более года и нашли. В результате оказалось, что энергия связи первого электрона атома гелия с протоном ядра в условиях, когда оба электрона находятся в атоме, равна 13,47eV и сразу заработал закон формирования спектров (формула 72).
12.77. Можно ли кратко описать, как это было? Для этого был составлен ряд экспериментальных энергий возбуждения 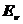 первого электрона атома гелия и ряд в виде разности между энергией ионизации первого электрона
первого электрона атома гелия и ряд в виде разности между энергией ионизации первого электрона 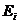 =24,587eV и энергиями возбуждения
=24,587eV и энергиями возбуждения 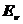 , взятыми из справочника (табл. 8, а) [3].
, взятыми из справочника (табл. 8, а) [3].
12.78. Какой следующий шаг был сделан? Начался анализ каждой экспериментальной величины энергии возбуждения атома путём сравнения её значений в разных справочниках.
12.79. Что было установлено в результате этого анализа? Прежде всего, было установлено некорректное правило заполнения экспериментальных таблиц, которое составители справочников обосновали так: «Наряду с экспериментально измеренными длинами волн в предлагаемых таблицах есть такие линии, длины волн которых рассчитаны по энергетическим уровням с учетом правил отбора. Это - или до сих пор необнаруженные линии тонкой структуры, или слабые, грубо измеренные спектральные линии. Законность такого расчета не вызывает сомнений, так как энергетические уровни устанавливаются по надёжно измеренным линиям с использованием вторичных стандартов».
Таблица 9, а. Энергетические показатели стационарных энергетических уровней первого электрона атома гелия.
| Номер уровня, n | Энергии возбуждения 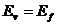 , eV , eV
| Энергия связи
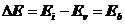 , eV , eV
|
| 1 | ? | ? |
| 2 | 20,96 | 3,627 |
| 3 | 21,22 | 3,367 |
| 4 | 23,01 | 1,597 |
| 5 | 23,09 | 1,497 |
| 6 | 23,74 | 0,847 |
| 7 | 24,04 | 0,547 |
| 8 | 24,21 | 0,377 |
| 9 | 24,31 | 0,277 |
| 10 | 24,37 | 0,217 |
| 11 | 24,42 | 0,167 |
| 12 | 24,45 | 0,137 |
| 13 | 24,47 | 0,117 |
| 14 | 24,49 | 0,097 |
| 15 | 24,51 | 0,077 |
| 16 | 24,52 | 0,067 |
12.80. Что же скрывалось в использовании вторичных стандартов? Произвол в заполнении энергетических уровней данными, которых не было в эксперименте.
12.81. Как можно прокомментировать этот произвол? Как вынужденную меру при несовершенстве приближённого метода расчёта спектров.
12.82. Почему же теоретики мирились с этим произволом? Причина одна – стереотип мышления, сформированный совокупностью всей предыдущей информации о спектрах атомов и ионов.
12.83. Как была доказана ошибочность действий теоретиков-спектроскопистов? Вот ответ на этот вопрос. Он взят из нашей монографии [2]. «Нам трудно согласиться с таким методом экспериментаторов. Взять, например, энергию возбуждения 23,01eV (таблица 8, вторая колонка), соответствующую четвертому стационарному энергетическому уровню. В справочнике [3] её вообще нет, а в справочнике [4] она приводится без указания яркости линии, то есть как очень слабая или ненаблюдаемая».
12.84. Какое решение было принято в связи с этим? Было решено исключить сомнительную величину энергии 23,01eV из рассмотрения при поиске закономерности формирования энергий возбуждения, соответствующих стационарным энергетическим уровням (табл. 8). В табл. 9 этой энергии нет.
12.85. Был ли это единственный случай? Нет, конечно. В аналогичном положении находилась и энергия возбуждения, равная 20,96eV (табл. 8, n=2). Поэтому и она была исключена из рассмотрения.
12.86. Что же получилось в результате такой чистки произвола спектроскопистов экспериментаторов? Результат – в таблице 9.
Таблица 10. Энергии связи 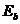 первого электрона атома гелия с его ядром
первого электрона атома гелия с его ядром
| Номер энергетического уровня, n | Энергии возбуждения,
| Энергии связи, eV | |
| эксперимент | теория 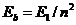
| ||
| 1 | 24,586 | ? | 13,47 |
| 2 | 21,22 | 3,37 | 3,37 |
| 3 | 23,09 | 1,50 | 1,50 |
| 4 | 23,74 | 0,85 | 0,85 |
| 5 | 24,04 | 0,55 | 0,55 |
| 6 | 24,21 | 0,38 | 0,38 |
| 7 | 24,31 | 0,28 | 0,28 |
| 8 | 24,37 | 0,22 | 0,22 |
| 9 | 24,42 | 0,17 | 0,17 |
| 10 | 24,45 | 0,14 | 0,14 |
| 11 | 24,47 | 0,10 | 0,10 |
| 12 | 24,49 | 0,09 | 0,09 |
| 13 | 24,51 | 0,08 | 0,08 |
| 14 | 24,52 | 0,07 | 0,07 |
12.87. Как понимать результаты, представленные в очищенной экспериментальной таблице 9? Третья колонка (табл. 9) – энергии связи первого электрона атома гелия с протоном ядра, взятые из справочника. Последняя колонка - результат расчёта энергий, связей первого электрона атома гелия с протоном его ядра по формуле (72).
12.88. Как была получена первая энергия в последней колонке в таблице 9? Первая энергия в этой колонке была получена следующим образом. Известна экспериментальная величина энергии связи первого электрона атома гелия с протоном ядра, соответствующая второму энергетическому уровню (таблица 9, 4-я колонка), при n=2 в четвёртой колонке - 3,37eV. Эта величина была умножена на квадрат квантового числа n=2 и в результате была получена энергия связи первого электрона атома гелия с протоном ядра, в момент пребывания его на первом (n=1) энергетическом уровне 13,47eV (таблица 9, четвёртая колонка). Полное совпадение всех данных четвёртой теоретической колонки и третьей - экспериментальной – убедительное доказательство правильности удаления двух энергий возбуждения, которые были введены в таблицу спектров экспериментаторов произвольно.
12.89. Какие ещё доказательства правильности корректировки экспериментальной таблицы спектров? Если формула (72) действительно является законом формирования спектров атомов и ионов, то с её помощью мы должны были получить экспериментальные значения энергий возбуждения. Подставляя в формулу (72) 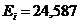 и
и 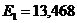 , получим (табл. 10). Как видно, в табл. 10 – полное совпадение теоретически рассчитанных энергий фотонов (
, получим (табл. 10). Как видно, в табл. 10 – полное совпадение теоретически рассчитанных энергий фотонов (  теор.), поглощаемых первым электроном атома гелия с экспериментальными значениями
теор.), поглощаемых первым электроном атома гелия с экспериментальными значениями  (эксп.).
(эксп.).
Таблица 11. Спектр первого электрона атома гелия
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | 21,22 | 23,09 | 23,74 | 24,04 | 24,21 |
 теор.) теор.)
| eV | 21,22 | 23,09 | 23,74 | 24,05 | 24,21 |
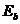 (теор.) (теор.)
| eV | 3,37 | 1,50 | 0,84 | 0,54 | 0,37 |
12.90. Значит ли это, что возникнет необходимость повторить эксперименты по фиксированию спектральных линий атомов и ионов? Да, такая необходимость уже прояснилась.
12.91. В чём её суть? Анализ уже полученных спектров атомов и ионов показывает достаточно большие расхождения в величинах энергий, соответствующих спектральным линиям и полученных различными авторами экспериментов. Эти расхождения надо уменьшать. Далее, не имея чёткого представления о законе Природы, формирующем спектры, экспериментаторы стремились только к фиксированию энергий спектральных линий, не уделяя особого внимания некоторым из них.
12.92. Каким же спектральным линиям надо было уделить особое внимание? Дело в том, что в математической модели закона формирования спектров атомов и ионов (72) есть математический символ, соответствующий энергии связи 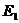 любого электрона с протоном ядра, соответствующей первому энергетическому уровню
любого электрона с протоном ядра, соответствующей первому энергетическому уровню 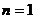 . Но некоторые электроны лишены возможности оказываться на первых энергетических уровнях из - за сложности структуры атома. В результате в спектре появляются лишь те самые нижние спектральные линии, которые соответствуют доступному переходу электрона с верхних на нижние энергетические уровни. Номер этого перехода в существующих спектрах остаётся неизвестным и приходится эмпирически перебирать нижние энергии, чтобы найти среди них те, которые принадлежат пребыванию электрона на дозволенном энергетическом уровне в данном атоме. Теперь, при известной модели атома, можно прогнозировать номер нижнего дозволенного энергетического уровня и точнее фиксировать его спектральную линию.
. Но некоторые электроны лишены возможности оказываться на первых энергетических уровнях из - за сложности структуры атома. В результате в спектре появляются лишь те самые нижние спектральные линии, которые соответствуют доступному переходу электрона с верхних на нижние энергетические уровни. Номер этого перехода в существующих спектрах остаётся неизвестным и приходится эмпирически перебирать нижние энергии, чтобы найти среди них те, которые принадлежат пребыванию электрона на дозволенном энергетическом уровне в данном атоме. Теперь, при известной модели атома, можно прогнозировать номер нижнего дозволенного энергетического уровня и точнее фиксировать его спектральную линию.
12.93. Как же согласовать экспериментальную величину энергии ионизации первого электрона атома гелия 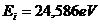 , с энергией связи первого электрона атома гелия с протоном
, с энергией связи первого электрона атома гелия с протоном 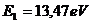 ? Это очень интересный вопрос и мы дадим детальный ответ на него при анализе структуры атома гелия.
? Это очень интересный вопрос и мы дадим детальный ответ на него при анализе структуры атома гелия.
12.94. В чём особенность расчёта спектра атома лития? Закон расчёта спектров (72) един и методика его применения тоже едина.
12.95. Можно ли увидеть результаты использования закона формирования спектров для расчёта спектров всех трёх электронов атома лития и сравнения их с экспериментальными данными? Конечно, - результаты в таблицах 11, 12 и 13.
Таблица 12. Спектр первого электрона атома лития
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | - | 3,83 | 4,52 | 4,84 | 5,01 |
 (теор.) (теор.)
| eV | 1,18 | 3,83 | 4,51 | 4,83 | 5,00 |
 (теор.) (теор.)
| eV | 3,51 | 1,56 | 0,88 | 0,56 | 0,39 |
Таблица 13. Спектр второго электрона атома лития
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | 62,41 | 69,65 | 72,26 | 73,48 | - |
 (теор.) (теор.)
| eV | 62,41 | 69,62 | 72,25 | 73,47 | 74,13 |
 (теор.) (теор.)
| eV | 13,54 | 6,02 | 3,38 | 2,17 | 1,50 |
Таблица 14. Спектры третьего электрона водородоподобного атома лития и энергии связи 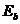 его с ядром атома на стационарных энергетических уровнях
его с ядром атома на стационарных энергетических уровнях
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | 91,84 | 108,84 | 114,80 | 117,55 | 119,05 |
 (теор.) (теор.)
| eV | 91,84 | 108,85 | 114,80 | 117,55 | 119,05 |
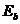 (теор.) (теор.)
| eV | 30,61 | 13,60 | 7,65 | 4,80 | 3,40 |
12.96. Почему теоретическая величина энергии возбуждения первого электрона атома лития, в момент пребывания его на втором энергетическом уровне имеется в таблице 11, а экспериментальной нет? Очень интересный вопрос. Это не единственный случай. Объясняется он тем, что теория даёт весь ряд энергий, соответствующий любому энергетическому уровню любого электрона, а некоторые электроны не дают соответствующих экспериментальных данных. Это относится в основном ко второму и третьему энергетическим уровням. Объясняется такое поведение электрона тем, что теория предсказывает наличие энергий, а у электрона их нет, так как он лишён возможности переходить на соответствующий энергетический уровень. Это обусловлено структурой атома. При анализе структуры атома лития мы увидим причину, которая не позволяет первому электрону этого атома опускаться на второй энергетический уровень.
12.97. Какие ещё особенности спектров раскроются при анализе их совместно со структурами атомов? Можно сказать удивительные особенности. Дальше мы увидим, что энергии связи у всех электронов любого атома не равны, но близки к энергиям связи электрона атома водорода на соответствующих энергетических уровнях.
12.98. Если электроны взаимодействуют с протонами ядер линейно, то структура многоэлектронного невозбуждённого атома будет подобна одуванчику (рис. 86, а). Так это или нет? Такое сравнение близко к реальности и мы познакомимся с этим детально.
12.99. А как же тогда появляются валентные электроны, связывающие атомы в молекулы? Ну, если речь пошла об одуванчике, то валентные электроны при возбуждении атома, поглощая фотоны, переходят на энергетические уровни (рис. 86, b) выше тех, на которых находятся все остальные электроны, то есть за пределы сферической поверхности одуванчика и таким образом вступают в контакт с электронами соседних атомов, соединяя атомы в молекуле.
12.100. Есть ли дополнительные доказательства примерного равенства энергий связи всех электронов атомов, с протонами ядер? Конечно, есть. Самое мощное из них – независимость экспериментальной зависимости закона излучения чёрного тела от материала этого тела, то есть от химического элемента, из которого он изготовлен (рис. 86, с). Это возможно только при условии, если энергии связи всех электронов с протонами ядер на однономерных энергетических уровнях (табл. 14, n>12), примерно, одинаковые у всех химических элементов.

Рис. 86. Одуванчик, имитирующий расположение электронов на поверхности сложного невозбуждённого атома; b) четыре возбуждённых атома с валентными электронами e.
12.101. Есть ли математические модели для расчёта энергии связи с протоном любого электрона любого химического элемента? Есть, конечно, и мы познакомимся с такими моделями и результатами использования их для расчётов, когда будем анализировать структуры атомов.
12.102. У атома бериллия четыре электрона. Позволяет ли закон формирования спектров атомов и ионов рассчитать спектры, формируемые всеми электронами этого атома? Ответ в таблицах 14, 15, 16.
Таблица 15. Спектр первого электрона атома бериллия
| Значения | n | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
 (эксп.) (эксп.)
| eV | 5,28 | 7,46 | 8,31 | 8,69 | 8,86 | 8,98 | 9,07 |
 (теор.) (теор.)
| eV | 5,28 | 7,53 | 8,31 | 8,67 | 8,87 | 8,99 | 9,07 |
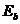 (теор.) (теор.)
| eV | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 |
Таблица 16. Спектр второго электрона атома бериллия
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | - | 11,96 | 14,72 | 15,99 | 16,67 |
 (теор.) (теор.)
| eV | 4,15 | 11,96 | 14,70 | 15,96 | 16,65 |
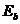 (теор.) (теор.)
| eV | 14,81 | 6,25 | 3,52 | 2,25 | 1,56 |
Таблица 17. Спектр третьего электрона атома бериллия
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | 123,7 | 140,4 | 146,3 | 149,0 | 150,5 |
 (теор.) (теор.)
| eV | 123,7 | 140,5 | 146,3 | 149,0 | 150,5 |
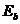 (теор.) (теор.)
| eV | 30,22 | 13,43 | 7,56 | 4,84 | 3,36 |
12.103. Почему энергии связи 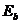 первых трёх электронов атома бериллия с протонами ядер на одноимённых энергетических уровнях увеличиваются по мере увеличения номера электрона в атоме (таблицы 14, 15 и 16)? Потому что спектры снимаются при последовательном увеличении потенциалов возбуждения. В результате электроны покидают атом в такой же последовательности. После ухода из атома первого электрона, один протон в ядре остаётся свободным и следующий электрон начинает взаимодействовать и со своим протоном и с тем, что освободился и его энергия связи увеличивается.
первых трёх электронов атома бериллия с протонами ядер на одноимённых энергетических уровнях увеличиваются по мере увеличения номера электрона в атоме (таблицы 14, 15 и 16)? Потому что спектры снимаются при последовательном увеличении потенциалов возбуждения. В результате электроны покидают атом в такой же последовательности. После ухода из атома первого электрона, один протон в ядре остаётся свободным и следующий электрон начинает взаимодействовать и со своим протоном и с тем, что освободился и его энергия связи увеличивается.
Когда в атоме остаётся один электрон, то он начинает взаимодействовать с четырьмя протонами ядра и его энергия связи, соответствующая первому энергетическому уровню, увеличивается в 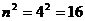 раз. Спектр четвёртого электрона атома бериллия является спектром водородоподобного атома бериллия, поэтому не представляет особого интереса.
раз. Спектр четвёртого электрона атома бериллия является спектром водородоподобного атома бериллия, поэтому не представляет особого интереса.
12.104. Почему не приведена таблица результатов расчёта, спектра четвёртого электрона атома бериллия? Четвёртый электрон атома бериллия остаётся в атоме последним при повышении потенциала возбуждения. Поэтому его теоретическая энергия ионизации равна произведению энергии ионизации атома водорода 13,598eV на квадрат главного квантового числа 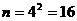 , то есть
, то есть 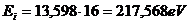 . В результате, атом бериллия с одним электроном, называется водородоподобным атомом. И спектр его четвёртого электрона рассчитается и по нашей математической модели закона формирования спектров атомов и ионов (72) и по формуле Бора (72). Поэтому, мы не приводим таблицу с результатами расчёта, спектра четвёртого электрона атома бериллия.
. В результате, атом бериллия с одним электроном, называется водородоподобным атомом. И спектр его четвёртого электрона рассчитается и по нашей математической модели закона формирования спектров атомов и ионов (72) и по формуле Бора (72). Поэтому, мы не приводим таблицу с результатами расчёта, спектра четвёртого электрона атома бериллия.
12.105. Если электроны взаимодействуют с протонами ядра не орбитально, а линейно, то есть основания полагать, что когда все четыре электрона атома бериллия находятся в атоме, то их энергии связи с протонами ядра должны иметь одинаковые значения на одноимённых энергетических уровнях. Есть ли доказательства достоверности такого предположения? Они в таблице 17.
Таблица 18. Энергии связи 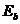 электрона атома водорода
электрона атома водорода 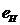 и всех электронов (1, 2, 3, 4) атома бериллия
и всех электронов (1, 2, 3, 4) атома бериллия 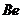 с ядром в момент, когда все они находятся в атоме
с ядром в момент, когда все они находятся в атоме
| N | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
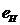
| 13,6 | 3,40 | 1,51 | 0,85 | 0,54 | 0,38 | 0,28 | 0,21 | 0,17 |
| 1 | 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 |
| 2 | 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 |
| 3 | 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 |
| 4 | 16,17 | 4,04 | 1,80 | 1,01 | 0,65 | 0,45 | 0,33 | 0,25 | 0,20 |
| N | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
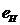
| 0,14 | 0,11 | 0,09 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 1 | 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 2 | 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 3 | 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
| 4 | 0,16 | 0,12 | 0,10 | 0,08 | 0,07 | 0,06 | 0,05 | 0,05 | 0,04 |
12.106. Как интерпретировать результаты таблицы 17? В первой строке – энергии связи электрона атома водорода со своим протоном (рис. 87), а в остальных – энергии связи всех четырёх электронов атома бериллия на соответствующих энергетических уровнях в условиях, когда все четыре электрона находятся в атоме (рис. 86).
12.107. Почему энергии связи всех четырёх электронов атома бериллия оказываются равными энергиям связи электрона атома водорода, начиная лишь с 13-го энергетического уровня (табл. 17)? Дальше, при анализе структуры атома бериллия, мы увидим причину этого, а сейчас лишь поясним. Когда все четыре электрона, находятся в атоме и линейно взаимодействуют с протонами его ядра, то на нижних энергетических уровнях они взаимодействуют друг с другом. Поэтому они могут оставаться в атоме (рис. 87) лишь при условии большей энергии связи со своими протонами, чем энергия связи электрона атома водорода со своим одним протоном (рис. 88).
По мере перехода на более высокие энергетические уровни электроны атома бериллия удаляются друг от друга и, начиная с 13-го энергетического уровня, их влияние друг на друга исчезает и их энергии связи с протонами ядра оказываются такими же, как и у электрона атома водорода (таблица 17).
12.108. Откуда взяты цифры, представленные в таблице 17? Это результат обработки экспериментальных спектров, всех четырёх электронов атома бериллия [2].
12.109. Есть ли математические модели для такой обработки? Конечно, есть, они приведены в монографии, и мы приведём их при анализе структуры атома бериллия.
12.110. Какое решение было принято после установления закона формирования спектров атомов и ионов? Было принято решение не стремиться к расчёту спектров всех атомов и ионов, а рассчитывать только те из них, которые использовались в наших экспериментах.
12.111. Можно ли привести результаты расчётов некоторых из них? Они - в табл. 18 – 25.
Таблица 19. Спектр первого электрона атома бора
| Знач. | N | 2 | 3 | 4 | 5 | 6 | 7 |
 (эксп.) (эксп.)
| eV | 4,96 | 6,82 | 7,46 | 7,75 | 7,92 | 8,02 |
 (теор.) (теор.)
| eV | 4,96 | 6,81 | 7,46 | 7,76 | 7,93 | 8,02 |
| Знач. | N | 8 | 9 | 10 | 11 | 12 | 13 |
 (эксп.) (эксп.)
| eV | 8,09 | 8,13 | 8,16 | 8,18 | 8,20 | 8,22 |
 (теор.) (теор.)
| eV | 8,09 | 8,13 | 8,16 | 8,18 | 8,20 | 8,22 |
| Знач. | N | 14 | 15 | 16 | 17 | 18 | 19 |
 (эксп.) (эксп.)
| eV | 8,23 | 8,24 | 8,25 | 8,25 | 8,26 | ... |
 (теор.) (теор.)
| eV | 8,23 | 8,24 | 8,25 | 8,25 | 8,26 | ... |
Таблица 20. Спектр 1-го электрона атома углерода
| Значения | N | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | 7,68 | 9,67 | 10,37 | 10,69 | 10,86 |
 (теор.) (теор.)
| eV | 7,70 | 9,68 | 10,38 | 10,71 | 10,88 |
 (теор.) (теор.)
| eV | 3,58 | 1,58 | 0,89 | 0,57 | 0,39 |
Таблица 21. Спектр первого электрона атома кислорода
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | 10,18 | 12,09 | 12,76 | 13,07 | 13,24 |
 (теор.) (теор.)
| eV | 10,16 | 12,09 | 12,76 | 13,07 | 13,24 |
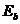 (теор.) (теор.)
| eV | 3,44 | 1,53 | 0,86 | 0,55 | 0,38 |
Таблица 22. Спектр второго электрона атома кислорода
| Значения | n | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | 14,12 | 25,83 | 29,81 | 31,73 | 32,88 |
 (теор.) (теор.)
| eV | 14,12 | 25,79 | 29,87 | 31,76 | 32,78 |
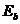 (теор.) (теор.)
| eV | 21,00 | 9,33 | 5,25 | 3,36 | 2,33 |
Таблица 23. Спектр 1-го электрона атома хлора
| Значения | N | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | 9,08 | 11,25 | 12,02 | 12,34 | 12,53 |
 (теор.) (теор.)
| eV | 9,08 | 11,24 | 11,99 | 12,34 | 12,54 |
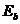 (теор.) (теор.)
| eV | 3,89 | 1,72 | 0,97 | 0,62 | 0,43 |
Таблица 24. Спектр 1-го электрона атома меди
| Значения | N | 5 | 6 | 7 | 8 | 9 |
 эксп.) эксп.)
| eV | 3,77 | 4,97 | 5,72 | 6,19 | 6,55 |
 (теор.) (теор.)
| eV | 3,77 | 4,98 | 5,71 | 6,18 | 6,50 |
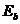 (теор.) (теор.)
| eV | 3,96 | 2,75 | 2,02 | 1,54 | 1,22 |
Таблица 25. Спектр 1-го электрона атома галлия
| Значения | N | 4 | 5 | 6 | 7 | 8 |
 эксп.) эксп.)
| eV | 4,11 | 4,71 | 5,06 | 5,23 | 5,40 |
 теор.) теор.)
| eV | 4,12 | 4,70 | 5,04 | 5,27 | 5,42 |
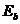 (теор.) (теор.)
| eV | 2,93 | 1,87 | 1,30 | 0,96 | 0,73 |
Таблица 26. Спектр 1-го электрона атома натрия
| Значения | N | 2 | 3 | 4 | 5 | 6 |
 (эксп.) (эксп.)
| eV | - | 3,68 | 4,31 | 4,62 | 4,78 |
 (теор.) (теор.)
| eV | - | 3,68 | 4,32 | 4,62 | 4,77 |
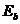 (теор.) (теор.)
| eV | 3,27 | 1,45 | 0,82 | 0,52 | 0,36 |
12.112. Какие сложности ожидают тех, кто будет пытаться рассчитывать спектры других атомов и ионов? Завершая изложение теории формирования спектров атомов и ионов, отметим важные моменты для тех, кто будет продолжать эти исследования. Прежде всего, это лишь начало. Оно базируется на результатах экспериментов. Если результаты эксперимента отличаются от реального спектра того или иного электрона, то резко усложняется процедура поиска энергии 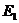 . Поскольку величина этой энергии базируется на значении энергии возбуждения, которая стоит первой в ряду всех энергий возбуждения, соответствующих стационарным энергетическим уровням, то точное определение первой энергии возбуждения играет решающую роль. Но существующие справочники по спектроскопии не отвечают этому требованию. Возьмем, например, энергии возбуждения, соответствующие стационарным энергетическим уровням второго электрона атома углерода.
. Поскольку величина этой энергии базируется на значении энергии возбуждения, которая стоит первой в ряду всех энергий возбуждения, соответствующих стационарным энергетическим уровням, то точное определение первой энергии возбуждения играет решающую роль. Но существующие справочники по спектроскопии не отвечают этому требованию. Возьмем, например, энергии возбуждения, соответствующие стационарным энергетическим уровням второго электрона атома углерода.
В справочнике Стриганова содержится следующий ряд этих энергий [3]: 5,33; 9,29; 11,96; 13,71; 13,72; 14,45; 18,04; 19,49; 20,84; 21,49; 22,13; 22,47; 22,57; 22,82; 23,38; 26,58 eV. В справочнике Зайделя этот ряд имеет такие значения [4]: 9,30; 11,96; 13,72; 14,46; 16,32; 17,62; 18,04; 18,06; 18,66; 19,49; 20,14; 20,84; 20,91; 20,95;22,13; 22,54; 22,56; 22,90; 23,11; 24,27; 24,37; 24,59; 24,64; 25,98; 27,41; 27,47; 27,48 eV.
Подчеркнутые значения энергий совпадают в обоих справочниках, а не подчеркнутые - не совпадают. Как видно, не так легко найти энергию, которая соответствует первому уровню возбуждения. Задача эта, видимо, должна решаться путем увеличения количества справочников, привлекаемых для анализа, и в разработке специальной компьютерной программы, которая обеспечивала бы решение поставленной задачи. Если встретятся такие ряды энергий, которые не подчиняются законам (72, 75), то это будет означать, что ячейка такого электрона занимает нестандартное положение в атоме. Не исключено, что в ряде случаев, придется повторить эксперименты для более точного определения первого потенциала возбуждения.
12.113. Существуют ли экспериментальные данные, кроме спектров атомов и ионов указывающие на отсутствие орбитальных движений электронов в атомах и на линейное взаимодействие их с протонами ядер? Такие экспериментальные результаты уже существуют (рис. 89, d). Их получили европейские экспериментаторы [5], [6]. Они создали новое поколение электронных микроскопов, которые имеют разрешающую способность фотографировать кластеры молекул. Им удалось сфотографировать кластер бензола (рис. 89, d). Сканирующий электронный микроскоп воспроизвел структуру кластера бензола, в которой чётко видна молекула бензола. Её структура полностью соответствует структуре теоретической молекулы бензола, построенной нами из атомов углерода и водорода несколько лет назад. Теоретическая модель молекулы бензола на рис. 89, c, а её фотография в составе бензольного кластера, показана на рис. 89, d. Мы не будем уточнять его точное название. Главное – структура [7], [8].
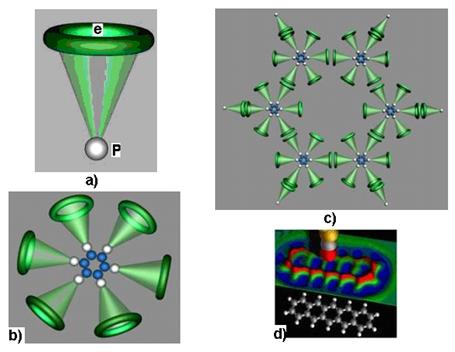
Рис. 89: а) атом водорода; b) атом углерода; с) молекула бензола;
d) фото кластера бензола
12.114. Что показано на фото (рис. 89, c)? На рис. 89, c показана теоретическая модель молекулы бензола С6Н6, а на рис. 89, d - фото бензольного кластера и результат компьютерной обработки этой фотографии.
12.115. Как правильно интерпретировать компьютерную фотографию бензольного кластера (рис. 89, d)? Теоретическая молекула бензола С6Н6 на рис. 89, c. Это значит, что в её структуре 6 атомов углерода С и шесть атомов водорода Н. На рис. 89, d представлено фото кластера из последовательно соединённых друг с другом колец из атомов углерода.
12.116. На чём основывается такая интерпретация? На теоретической модели атома углерода, представленной на рис. 89, b. В ней 6 электронов  , линейно связанных с ядром, которое расположено в центре атома.
, линейно связанных с ядром, которое расположено в центре атома.
12.117. А как устроено ядро атома углерода? Структура ядра атома углерода показана на рис. 89, b. Внутренние тёмные шары – нейтроны, а наружные (светлые) – протоны.
12.118. Из рис. 89, b и с следует, что электроны взаимодействуют с протонами ядра не орбитально, а линейно. В чём сущность этого взаимодействия? Она следует из структуры атома водорода, представленного на рис. 89, а. Как видно, электрон  взаимодействует с протоном Р линейно, а не орбитально.
взаимодействует с протоном Р линейно, а не орбитально.
12.119. Какие силы сближают электрон атома водорода с протоном, и какие ограничивают их сближение? Электрон и протон имеют разноименные электрические заряды и магнитные моменты, а значит и магнитные полюса: северный и южный. Следовательно, их могут сближать разноимённые электрические заряды, а ограничивать сближение - одноимённые магнитные полюса, силовые магнитные линии которых наиболее интенсивно взаимодействуют друг с другом, когда их магнитные полюса располагаются на одной линии. В результате и формируется линейное взаимодействие электрона с протоном ядра (рис. 89, а).
12.120. Как интерпретировать светлые внешние шарики на рис. 89, d, внизу? Это протоны атомов водорода. На реальном фото (рис. 89, d, вверху) их нет, так как размер протона на 3 порядка меньше размера электрона (рис. 89, а) и микроскоп не видит протоны, но он видит острые контуры атомов водорода на периферии контура кластера бензола (рис. 89, d, выше компьютерной иммитации кластера бензола). В вершинах заострения по внешнему контуру фото кластера бензола - протон атома водорода, размер которого в 1000 раз меньше размера электрона.
12.121. Из изложенного выше, следует - формирование структур атомов и молекул начинается с формирования ядер атомов. Так это или нет? Представленная визуальная экспериментальная и теоретическая информации дают однозначно положительный ответ на поставленный вопрос.
12.122. Значит ли это, что изучение атомов и молекул надо начинать с изучения структур ядер атомов? Ответ однозначно положительный.
12.123. Значит ли это, что лиц, препятствующих этому изучению уже можно относить к научным инквизиторам? История науки уже представила их такими.
12.124. Неужели нашлись и модераторы, которые препятствуют публикации этой информации в Интернете? К сожалению, нашлись и немало.
12.125. Обращался ли автор с соответствующими предложениями и просьбами к высшему руководству страны? Ответ краткий. Обращался многократно, начиная с 2006 года и кончая декабрём 2015г. Все результаты нулевые. Власть молчит, повышая мой рейтинг «вопиющего в пустыне» для продолжателей моих научных результатов……Конечно, было бы неплохо, если бы нашлись специалисты, способные детально проверить корректность математических моделей и расчёты, выполненные по ним. Многочасовая работа на компьютере утомляет научное мышление и порождает ошибки, которые автору трудно заметить.
ЗАКЛЮЧЕНИЕ
Спектры атомов, ионов и молекул – самый большой массив научной экспериментальной информации об обитателях микромира, но человек научился извлекать из этих спектров мизерную часть пользы, которую они содержат.
Причина такого состояния – барьер приближённых методов расчёта спектров атомов ионов. Он был удалён 25 лет назад, но научно-образовательная Власть России до сих пор игнорирует это удаление. [1], [2], [3], [4], [5].
Дата добавления: 2018-06-27; просмотров: 351; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 eV
eV