Отбор спортсменов для тестирования 5 страница
Усиление мочеобразования вызывает также и гормон щитовидной железы – тироксин, между тем как адреналин – гормон надпочечников – вызывает уменьшение мочеобразования.
Больным часто с лечебной целью дают мочегонные средства - мочевину, кофеин, азотнокислый натрий и некоторые другие вещества. Под воздействием этих веществ усиливается образование мочи.
Физико-химические свойства мочи
Количество мочи (диурез). В среднем за сутки человек выделяет около 1,5 л мочи. Однако эта цифра непостоянна и колеблется в довольно широких пределах. Так, например, объем выделяемой мочи возрастает после питья большого количества жидкости, употребления значительных количеств белка, продукты распада которого усиливают деятельность почек. И наоборот, мочеобразование уменьшается, когда человек потребляет мало жидкости, когда в еде содержится мало белка или когда происходит усиленное потение и значительное количество воды теряется с потом.
Интенсивность мочеобразования меняется в течение суток. Днем моча образуется интенсивней, чем ночью, даже если ночью человек выпьет столько же воды, сколько днем.
Наименьшее количество мочи образуется в промежуток от 2 до 4 часов ночи. Уменьшение мочеобразования ночью связано со снижением деятельности органов во время сна и с некоторым падением давления крови, в связи с чем понижается также давление в почках и уменьшается фильтрация.
|
|
|
На образование мочи влияет также физическая работа. При длительной физической работе количество выделяемой мочи уменьшается, во-первых, потому, что капиллярная сеть мышц раскрывается и кровь приливает к мышцам, а тем самым уменьшается снабжение кровью почек, а во-вторых, потому, что физическая работа обычно сопровождается потоотделением, что также ведет к уменьшению мочеобразования.
Диурез также возрастает при приеме большого количества жидкости и пищи, повышающей мочеотделение, и уменьшается при потоотделении, поносе и рвоте.
Полиурия – повышенное выделение мочи (свыше 2000 мл в сутки) – отмечается при таких заболеваниях почек, как хронические нефриты и пиелонефриты, при сахарном диабете, алиментарной дистрофии и т. д.
Олигурия – пониженное мочеотделение (не ниже 800 мл в сутки) наблюдается при таких заболеваниях почек, как острые диффузные нефриты, недостаточность кровообращения, повышенная гидрофильность тканей, задержка натрия в тканях и т. д.
Анурия – суточное выделение мочи от 200 мл и ниже является, как правило, следствием тяжелого поражения почек (паренхимы). Длительная анурия ведет к уремии, отравлению организма мочой.
Цвет мочи. Моча представляет собой прозрачную жидкость светло-желтого цвета. При стоянии выпадает в осадок. Образовавшаяся муть состоит из солей и слизи.
|
|
|
Цвет мочи может колебаться от светло-желтого до насыщенно-желтого. Это в норме зависит от содержания пигментов, и прежде всего урохрома, уроэретрина, уророзеина, уробелина и др. Степень окраски меняется в зависимости от удельного веса и количества выделенной мочи. Интенсивный желтый цвет – высокий удельный вес. Бледная моча чаще имеет низкий удельный вес. В патологии цвет мочи может меняться.
Реакция мочи (рН мочи). При обычной смешанной пище моча здорового человека имеет слабокислую реакцию (рН в пределах 5,0-7,0). Реакция мочи меняется в зависимости от питания.
При употреблении преимущественно мясной пищи и других богатых белками веществ реакция мочи становится кислой; растительная же пища вызывает некоторое защелачивание, и реакция мочи делается нейтральной или даже щелочной.
Резко кислая реакция отмечается при лихорадочных состояниях, диабете, голодании, недостаточности почек и т. д. Щелочная реакция мочи наблюдается при циститах, пиелитах, гематурии, после рвоты и поноса, при рассасывании экссудатов, при приеме соды, минеральной воды. Реакцию следует определять только у нативной, т. е. свежей мочи.
|
|
|
Удельный вес мочи. Удельный вес мочи колеблется в зависимости от количества принятой жидкости. Большое количество потребленной воды вызывает падение удельного веса; наоборот, при ограничении поступления в организм воды удельный вес мочи повышается. В среднем, удельный вес равен 1015-1020 г/см3.
Для нормальных почек отмечается широкое колебание удельного веса в течение суток, что определено приемом пищи, воды, потоотделением, дыханием. Низкие цифры удельного веса (1,005-1,012), гипоизостенурия - указывают на нарушение концентрационных функций почек, например хронический нефрит, сморщенная почка. Как временное явление низкий удельный вес отмечается при алиментарной дистрофии, после обильного питья, при уменьшении отеков. Высокий удельный вес мочи (более 120) наблюдается при остром нефрите, образовании внутриполостных экссудатов. Интересно, что в случае сахарного диабета отмечается высокий удельный вес мочи, даже при наличии полиурии.
Химический состав мочи
В состав мочи входят вода, продукты распада белка: азотсодержащие вещества, соли и некоторые другие вещества. В среднем за сутки с мочой выделяется около 60 г солей.
Азот выделяется преимущественно в составе мочевины, на долю которой приходится примерно 90% азота, образующегося в результате распада белка.
|
|
|
В нормальной моче белок не содержится, так как, будучи коллоидом, он не может проходить через стенки капилляров. Появление белка в моче говорит о заболевании почек. Белок может появиться в моче либо в результате патологического изменения проницаемости стенок капилляров, когда они начинают пропускать белок в мочу, либо при воспалительных процессах в почках.
Однако при большом физическим напряжении белок на короткое время может появиться в моче и у здорового человека. Это особенно характерно для бегунов. Появление белка в моче в этом случае является результатом изменения проницаемости сосудистой системы почек, что связано с их усиленной работой. Вскоре после снятия тяжелой физической нагрузки белок в моче у этих людей исчезает, и нормальная работа почек восстанавливается.
Появление белка в моче называется альбуминурией.
Сахар в моче может появиться как у больных, так и у здоровых людей.
У больных людей выделение сахара с мочой наблюдается при заболевании диабетом. У здоровых же людей сахар появляется в моче после употребления большого количества сахара или других веществ со значительным содержанием сахара (варенье, шоколад и т. д.). А также наблюдается у спортсменов после тяжелых тренировок. Выведение сахара с мочой называется глюкозурией.
Нормальной составной частью мочи являются пигменты – уробилин и урохром, придающие моче характерный цвет. Пигменты мочи образуются в кишечнике и почках из пигментов желчи, которые в свою очередь образуются из продуктов распада гемоглобина.
Появление крови в моче, или гематурия, наблюдается при кровоизлияниях в область почек или мочевыводящих органов.
Обнаруженные в моче эритроциты могут быть неизмененные (то есть содержащие гемоглобин) и измененные, свободные от гемоглобина, имеющие вид одноконтурных или двухконтурных колес. Если же моча красная, то это состояние определяется как макрогематурия. При микрогематурии эритроциты обнаруживаются только микроскопически. Почечные гематурии связаны с органическим поражением почек – это острые и хронические нефриты, геморагический диатез, злокачественные новообразования. Почечная гематурия может быть при тяжелых физических нагрузках. Внепочечная гематурия развивается при заболеваниях мочевого пузыря, лоханок, мочеточников и трав мах.
Увеличение количества лейкоцитов в моче свидетельствует о воспалительных процессах в почках или мочевыводящих путях (туберкулез почки, пиелиты, циститы, пиелонефриты и т. д.).
Клетки почечного эпителия в нормальной моче не обнаруживаются, они появляются при нефритах, нефрозах, интоксикациях, лихорадочных состояниях и инфекционных заболеваниях.
Цилиндры, которые обнаруживают в моче, представляют собой белковые клеточные образования канальцевого происхождения, имеющие форму цилиндров. Различают гиалиновые, зернистые, восковидные, эпителиальные, эритроцитарные, пигментные, лейкоцитарные цилиндры. Появление большого количества различных цилиндров (цилиндрурия) наблюдается при органических поражениях почек (нефриты, нефрозы), при инфекционных болезнях, застойной почке, при ацидозе.
Вопросы для самоконтроля:
1. По каким причинам исследование мочи предпочтительнее исследованию крови?
2. Назовите главные этапы образования мочи.
3. Как происходит регуляция процесса образования мочи?
4. Что обозначает термин «олигурия»?
5. Что может служить причиной анурии?
6. От чего зависит плотность мочи?
7. Присутствием какого соединения обеспечивается желтый цвет мочи?
8. Конечным продуктом распада каких соединений является мочевина?
9. Какие компоненты мочи относятся к патологическим?
БИОХИМИЯ МЫШЦ, МЫШЕЧНОГО СОКРАЩЕНИЯ И РАССЛАБЛЕНИЯ
Общая характеристика мышц
У животных и человека имеются два основных типа мышц:
- поперечно-полосатые (прикрепляются к костям, т. е. к скелету, и поэтому еще называются скелетными, выделяют также сердечную мышцу, имеющую свои особенности);
- гладкие (мускулатура стенок полых органов и кожи).
Строение мышечных клеток
Поперечно-полосатая мышца состоит из многочисленных удлиненных мышечных клеток. Двигательные нервы входят в различных точках в мышечное волокно и передают ему электрический импульс, вызывающий сокращение. Мышечное волокно обычно рассматривают как многоядерную клетку гигантских размеров, покрытую эластичной оболочкой – сарколеммой. Диаметр функционально зрелого поперечно-полосатого мышечного волокна обычно составляет от 10 до 100 мкм, а длина волокна часто соответствует длине мышцы.
В саркоплазме мышечных волокон обнаруживается ряд структур: митохондрии, микросомы, рибосомы, трубочки и цистерны сарко-плазматической сети, различные вакуоли, глыбки гликогена и включения липидов, играющие роль запасных энергетических материалов, и т.д.
В каждом мышечном волокне в полужидкой саркоплазме по длине волокна расположено, нередко в форме пучков, множество нитевидных образований – миофибрилл (толщина их обычно менее 1 мкм), обладающих, как и все волокно в целом, поперечной исчерченностью. Поперечная исчерченность волокна, зависящая от оптической неоднородности белковых веществ, локализованных во всех миофибриллах на одном уровне, легко выявляется при исследовании волокон скелетных мышц в поляризационном или фазово-контрастном микроскопе (рисунок 2).
Повторяющимся элементом поперечно-полосатой миофибриллы является саркомер – участок миофибриллы, границами которого служат узкие Z-линии. Каждая миофибрилла состоит из нескольких сот саркомеров. Средняя длина саркомера 2,5–3,0 мкм. В середине саркомера находится зона протяженностью 1,5–1,6 мкм, темная в фазово-контрастном микроскопе. В поляризованном свете она дает сильное двойное лучепреломление. Эту зону принято называть диском А (анизотропный диск). В центре диска А расположена линия М, которую можно наблюдать только в электронном микроскопе. Среднюю часть диска А занимает зона Н более слабого двойного лучепреломления. Наконец, существуют изотропные диски, или диски I, с очень слабым двойным лучепреломлением. В фазово-контрастном микроскопе они кажутся более светлыми, чем диски А. Длина дисков I около 1 мкм. Каждый из них разделен на две равные половины Z-мембраной, или Z-линией. Согласно современным представлениям, в дисках А расположены толстые нити, состоящие главным образом из белка миозина, и тонкие нити, состоящие, как правило, из второго компонента актомиозиновой системы – белка актина. Тонкие (актиновые) нити начинаются в пределах каждого саркомера у Z-линии, тянутся через диск I, проникают в диск А и прерываются в области зоны Н.

| Рисунок 2 – фотография микропрепарата поперечно-полосатой мышечной ткани |
При исследовании тонких срезов мышц под электронным микроскопом было обнаружено, что белковые нити расположены строго упорядоченно. Толстые нити диаметром 12–16 нм и длиной примерно 1,5 мкм уложены в форме шестиугольника диаметром 40–50 нм и проходят через весь диск А. Между этими толстыми нитями расположены тонкие нити диаметром 8 нм, простираясь от Z-линии на расстояние около 1 мкм (рисунок 3). Изучение мышцы в состоянии сокращения показало, что диски I в ней почти исчезают, а область перекрывания толстых и тонких нитей увеличивается (в скелетной мышце в состоянии сокращения саркомер укорачивается до 1,7–1,8 мкм).
Согласно модели, предложенной Э. Хаксли и Р. Нидергерке, а также X. Хаксли и Дж. Хенсон, при сокращении миофибрилл одна система нитей проникает в другую, т.е. нити начинают как бы скользить друг по другу, что и является причиной мышечного сокращения.
Механизм мышечного сокращения
Передача возбуждения с двигательного мотонейрона на мышечное волокно происходит с помощью медиатора ацетилхолина (АХ). Взаимодействие АХ с холинорецептором концевой пластинки приводит к активации АХ-чувствительных каналов и появлению потенциала концевой пластинки, который может достигать 60 мВ. При этом область концевой пластинки становится источником раздражающего тока для мембраны мышечного волокна и на участках клеточной мембраны, прилегающих к концевой пластинке, возникает ПД, который распространяется в обе стороны со скоростью примерно 3 – 5 м/с при температуре 36 oС.
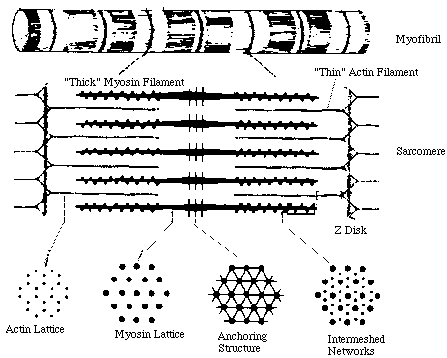
| Рисунок 3 – схема строения саркомера |
Вторым этапом является распространение ПД внутрь мышечного волокна по поперечной системе трубочек, которая служит связующим звеном между поверхностной мембраной и сократительным аппаратом мышечного волокна. Т-система тесно контактирует с терминальными цистернами саркоплазматической сети двух соседних саркомеров. Электрическая стимуляция места контакта приводит к активации ферментов, расположенных в месте контакта и образованию инозитолтрифосфата. Инозитолтрифосфат активирует кальциевые каналы мембран терминальных цистерн, что приводит к выходу ионов Са2+ из цистерн и повышению внутриклеточной концентрации Са2+ с 107до 105 M. Совокупность процессов, приводящих к повышению внутриклеточной концентрации Са2+ составляет сущность третьего этапа мышечного сокращения. Таким образом, на первых этапах происходит преобразование электрического сигнала ПД в химический — повышение внутриклеточной концентрации Са2+, т. е. электрохимическое преобразование.
При повышении внутриклеточной концентрации ионов Са2+ тропомиозин смещается в желобок между нитями актина, при этом на актиновых нитях открываются участки, с которыми могут взаимодействовать поперечные мостики миозина. Это смещение тропомиозина обусловлено изменением конформации молекулы белка тропонина при связывании Са2+ . Следовательно, участие ионов Са2+ в механизме взаимодействия актина и миозина опосредовано через тропонин и тропомиозин.
Следующим этапом электромеханического сопряжения является присоединение головки поперечного мостика к актиновому филаменту к первому из нескольких последовательно расположенных стабильных центров. При этом миозиновая головка поворачивается вокруг своей оси, поскольку имеет несколько активных центров, которые последовательно взаимодействуют с соответствующими центрами на актиновом филаменте. Вращение головки приводит к увеличению упругой эластической тяги шейки поперечного мостика и увеличению напряжения. В каждый конкретный момент в процессе развития сокращения одна часть головок поперечных мостиков находится в соединении с актиновым филаментом, другая свободна, т. е. существует последовательность их взаимодействия с актиновым филаментом. Это обеспечивает плавность процесса сокращения. На четвертом и пятом этапах происходит хемомеханическое преобразование.
Последовательная реакция соединения и разъединения головок поперечных мостиков с актиновым филаментом приводит к скольжению тонких и толстых нитей относительно друг друга и уменьшению размеров саркомера и общей длины мышцы, что является шестым этапом. Совокупность описанных процессов составляет сущность теории скольжения нитей.
Механизм мышечного расслабления
Описанные механизмы укорочения мышечного волокна позволяют предположить, что для расслабления в первую очередь необходимо понижение концентрации ионов Са2+. Экспериментально было доказано, что саркоплазматическая сеть имеет специальный механизм – кальциевый насос, который активно возвращает кальций в цистерны. Активация кальциевого насоса осуществляется неорганическим фосфатом, который образуется при гидролизе АТФ, а энергообеспечение работы кальциевого насоса также за счет энергии, образующейся при гидролизе АТФ. Таким образом, АТФ является вторым важнейшим фактором, абсолютно необходимым для процесса расслабления.
Кроме того, после мышечных сокращений тонкие протофибриллы стремятся вернуться в свое прежнее положение за счет упругих свойств.
Некоторое время после смерти мышцы остаются мягкими вследствие прекращения тонического влияния мотонейронов. Затем концентрация АТФ снижается ниже критического уровня и возможность разъединения головки миозина с актиновым филаментом исчезает. Возникает явление трупного окоченения с выраженной ригидностью скелетных мышц.
Особенности строения гладких мышц
Гладкие мышцы внутренних органов по характеру иннервации, возбуждения и сокращения существенно отличаются от скелетных. Волны возбуждения и сокращения протекают в гладких мышцах в очень замедленном темпе. Развитие состояния «неутомляемого» тонуса гладких мышц связано, как и в тонических скелетных волокнах, с замедленностью сократительных волн, сливающихся друг с другом даже при редких ритмических раздражениях. Для гладких мышц характерна также способность к автоматизму, т. е. к деятельности, не связанной с поступлением в мышцы нервных импульсов из центральной нервной системы. Установлено, что способностью к ритмическому самопроизвольному возбуждению и сокращению обладают не только нервные клетки, имеющиеся в гладких мышцах, но и сами гладкомышечные клетки.
Своеобразие сократительной функции гладких мышц позвоночных животных определяется не только особенностями их иннервации и гистологического строения, но и спецификой их химического состава: более низким содержанием контрактильных белков (актомиозина), макроэргических соединений, в частности АТФ, низкой АТФ-азной активностью миозина, наличием в них водорастворимой модификации актомиозина - тоноактомиозина и т. д.
Существенное значение для организма имеет способность гладких мышц изменять длину без повышения напряжения (наполнение полых органов, например мочевого пузыря, желудка и др.).
Энергетика мышечной деятельности
Как уже указывалось, обе фазы мышечной деятельности – сокращение и расслабление – протекают при обязательном использовании энергии, которая выделяется при гидролизе АТФ.
Однако запасы АТФ в мышечных клетках незначительны (в покое концентрация АТФ в мышцах около 5 ммоль/л) и их достаточно для мышечной работы в течение 1-2 с. Поэтому для обеспечения более продолжительной мышечной деятельности в мышцах должно происходить пополнение запасов АТФ. Образование АТФ в мышечных клетках непосредственно во время физической работы называется ресинтезом АТФ и идет с потреблением энергии.
Таким образом, при функционировании мышц в них одновременно протекают два процесса: гидролиз АТФ, дающий необходимую энергию для сокращения и расслабления, и ресинтез АТФ, восполняющий потери этого вещества. Если для обеспечения мышечного сокращения и расслабления используется только химическая энергия АТФ, то для ресинтеза АТФ пригодна химическая энергия самых разнообразных соединений: углеводов, жиров, аминокислот и креатинфосфата.
Дата добавления: 2018-06-27; просмотров: 188; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
