Методы расчета основных параметров процесса сгорания
Процесс сгорания сопровождается чрезвычайно сложными физико-химическими явлениями, которые развиваются в зависимости от большого числа трудно учитываемых факторов. Это обстоятельство очень усложняет математическое описание процесса, поэтому в настоящее время нет практически приемлемого метода точного расчета не только текущих, но и конечных его параметров. Необходимые при расчете рабочего цикла параметры конца сгорания обычно получают в результате простого термодинамического расчета, выполняемого по идеализированной схеме и дающего только общее приближение к действительным условиям. Основной недостаток этого метода состоит в том, что он не учитывает действительного закона тепловыделения, подменяя его подводом теплоты при простых термодинамических процессах (изохорном и изобарном) с введением эмпирических поправочных коэффициентов.
Расчет процесса сгорания состоит из двух разделов - термохимического и термодинамического.
Термохимические соотношения при сгорании
Количество воздуха, необходимое для сгорания топлива, можно установить из стехиометрических уравнений химических реакций.
В итоге, сгорание углеводородного топлива описывается следующими уравнениями:
С + О2 = СО2 , (2.2.1)
2С + О2 = 2СО , (2.2.2)
2Н2 + О2 = 2Н2О. (2.2.3)
|
|
|
Принимая во внимание атомные и молекулярные веса элементов и выражая газообразные компоненты в молях, можно получить соответственно
12 кг С + 1 моль О2 = 1 моль СО2; (2.2.4)
24 кг С+ 1 моль О2 = 2 моль СО, (2.2.5)
4 кг Н2+ 1 моль О2 = 2 моля Н2О. (2.2.6)
Из уравнений (2.2.4…2.2.6) определяется количество молей воздуха Мо, теоретически необходимое для полного сгорания 1 кг топлива:
 , моль/кг топлива (2.2.7)
, моль/кг топлива (2.2.7)
где 0,21 — объемное содержание кислорода в воздухе;
С, Н, О — весовая доля углерода, водорода и кислорода в элементарном составе топлива.
Элементарный состав топлива можно принять для бензина – С = 0,855 и Н = 0,145.
Действительное количество воздуха М, участвующее в сгорании, обычно не равно теоретическому Мо и составляет
M = αMo, (моль/кг топлива) (2,2,8)
где α – коэффициент избытка воздуха при сгорании.
Для карбюраторных двигателей α = 0,8-1,15 в зависимости от режима работы. При расчете рабочего процесса обычно принимается α = 0,85…0,9.
Число молей свежего заряда, поступившего в цилиндр за время впуска в двигателях с внешним смесеобразованием
|
|
|
 ,(моль/кг топлива) (2,2,9)
,(моль/кг топлива) (2,2,9)
где μТ – молекулярный вес паров топлива (μТ = 114 кг/моль);
в двигателях с внутренним смесеобразованием
М3 = М = α М0 (моль/кг топлива)………………..(2.2.10)
Число молей продуктов сгорания, образующихся при сгорании 1 кг топлива, также определяется из уравнений (2.2.4…2.2.6).
Если сгорание происходит при α > 1, то число молей продуктов сгорания равно
МГ = МСОг + МНг0 + МN2 + МОг (моль/кг топлива). (2.2.11)
Из уравнений (2.2.4) и (2.2.6) следует, что

Число молей азота при сгорании не изменяется, поэтому
MN2=0,79M = 0,79α M0 .
Число молей избыточного кислорода равно
МОг=0,21 (M - Мo) = O,21 Мо (a- 1).
Подставляя найденные количества компонентов продуктов сгорания в уравнение (2.2.11), получим
Мг =  (2.2.12)
(2.2.12)
или, учитывая уравнение (2.2.7), получим окончательно число молей продуктов сгорания при α > 1
Мг =  (моль/кг топлива). (2.2.13)
(моль/кг топлива). (2.2.13)
В случае сгорания с недостатком воздуха (α < 1) часть углерода и водорода окисляется не полностью и в продуктах сгорания присутствуют окись углерода и свободный водород:
МГ = МСО2 + МCO + МН20 + МН2+ МN2 (моль/кг топлива). (2.2.14)
Предполагая, что неполному окислению подвергаются доли углерода и водорода, оцениваемые коэффициентами φ и φ1 можно записать
|
|
|
 и
и  .
.
Тогда число молей продуктов полного окисления будет равно
 и
и 
Число молей азота остается равным
MN2 = 0,79αM0.
Общее количество продуктов сгорания в этом случае будет равно
 (2.2.15)
(2.2.15)
или после преобразования
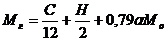 (моль/кг топлива) (2.2.16)
(моль/кг топлива) (2.2.16)
Как видно из уравнений (2.2.2) и (2.2.3), в реакциях неполного окисления углерода и частичного сгорания водорода происходит удвоение числа молей газов. Поэтому число молей продуктов сгорания в этом случае оказывается больше числа молей свежего заряда. Это увеличение тем больше, чем больше продуктов неполного окисления углерода, т.е. чем меньше коэффициент избытка воздуха α.
Отношение числа молей МГ к М3 называется коэффициентом молекулярного изменения горючей смеси
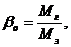 (2.2.17)
(2.2.17)
Действительное изменение числа молей будет несколько меньшим из-за наличия в цилиндре остаточных газов, определяемых величиной γг.
Поэтому коэффициент молекулярного изменения рабочей смеси равен
 (2.2.18)
(2.2.18)
Учитывая, что  получим
получим
|
|
|

 (2.2.19)
(2.2.19)
Увеличение числа молей, а следовательно, и объема продуктов сгорания способствует дополнительному повышению давления при выделении теплоты и увеличивает работу расширения газов.
Обычно для двигателей с принудительным воспламенением β = 1,07 – 1,1.
Дата добавления: 2018-05-13; просмотров: 391; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
