Параметры состояния. Уравнения состояния
Предмет термодинамики, ее методы, задачи место и роль в системе подготовки инженеров
Термодинамика изучает зако-
ны превращения энергии в различных
процессах, происходящих в макроскопи-
ческих системах и сопровождающихся
тепловыми эффектами. Макроскопиче-
ской системой называется любой матери-
альный объект, состоящий из большого
числа частиц. Размеры макроскопиче-
ских систем несоизмеримо больше разме-
ров молекул и атомов.
В зависимости от задач исследования
рассматривают техническую или химиче-
скую термодинамику, термодинамику
биологических систем и т. д. Т е х н и ч е-
ская термодинамика изучает
закономерности взаимного превращения
тепловой и механической энергии и свой-
ства тел, участвующих в этих превраще-
ниях. Вместе с теорией теплообмена она
является теоретическим фундаментом
теплотехники. На ее основе осуществля-
ют расчет и проектирование всех тепло-
вых двигателей, а также всевозможного
технологического оборудования.
Рассматривая только макроскопиче-
ские системы, термодинамика изучает
закономерности тепловой формы движе-
ния материи, обусловленные наличием
огромного числа непрерывно движущих-
ся и взаимодействующих между собой
микроструктурных частиц (молекул, ато-
мов, ионов).
Физические свойства макроскопиче-
ских систем изучаются статистическим
и термодинамическим методами. Стати-
стический метод основан на использова-
нии теории вероятностей и определенных
моделей строения этих систем и пред-
ставляет собой содержание статистиче-
ской физики. Термодинамический метод
не требует привлечения модельных пред-
ставлений о структуре вещества и явля-
ется феноменологическим
(т. е. рассматривает «феномены» — яв-
ления в целом). При этом все основные
выводы термодинамики можно получить
методом дедукции, используя только два
основных эмпирических закона (начала)
термодинамики.
В дальнейшем исходя из термодина-
мического метода мы будем для нагляд-
ности использовать молекулярно-кинети-
ческие представления о структуре ве-
щества.
Термодинамическая система
Термодинамическая
система представляет собой совокуп-
ность материальных тел, находящихся
в механическом и тепловом взаимодей-
ствиях друг с другом и с окружающими
систему внешними телами («внешней
средой»).
Выбор системы произволен и дикту-
ется условиями решаемой задачи. Тела,
не входящие в систему, называют окру-
жающей средой. Систему отделя-
ют от окружающей среды контроль-
ной поверхностью (оболочкой).
Так, например, для простейшей систе-
мы — газа, заключенного в цилиндре под
поршнем, внешней средой является окру-
жающий воздух, а контрольными повер-
хностями служат стенки цилиндра и по-
ршень.
Механическое и тепловое взаимодей-
ствия термодинамической системы осу-
ществляются через контрольные повер-
хности. При механическом взаимодейст-
вии самой системой или над системой
совершается работа. (В общем случае на
систему могут действовать также элек-
трические, магнитные и другие силы, под
воздействием которых система будет со-
вершать работу. Эти виды работ также
могут быть учтены в рамках термодина-
мики, но нами в дальнейшем рассматри-
ваться не будут). В нашем примере ме-
ханическая работа производится при пе-
ремещении поршня и сопровождается
изменением объема. Тепловое взаимо-
действие заключается в переходе тепло-
ты между отдельными телами системы
и между системой и окружающей средой.
В рассматриваемом примере теплота мо-
жет подводиться к газу через стенки ци-
линдра.
В самом общем случае система мо-
жет обмениваться со средой и веществом
(массообменное взаимодействие). Такая
система называется открытой. Пото-
ки газа или пара в турбинах и трубопро-
водах — примеры открытых систем. Если
вещество не проходит через границы
системы, то она называется закры-
той. В дальнейшем, если это специально
не оговаривается, мы будем рассматри-
вать закрытые системы.
Термодинамическую систему, кото-
рая не может обмениваться теплотой
с окружающей средой, называют т е п-
ло изолированной или адиа-
батной. Примером адиабатной систе-
мы является газ, находящийся в сосуде,
стенки которого покрыты идеальной теп-
ловой изоляцией, исключающей теплооб-
мен между заключенным в сосуде газом
и окружающими телами. Такую изоляци-
онную оболочку называют адиабатной.
Система, не обменивающаяся
с внешней средой ни энергией, ни ве-
ществом, называется изолирован-
ной (или замкнутой).
Простейшей термодинамической
системой является рабочее тело,
осуществляющее взаимное превращение
теплоты и работы. В двигателе внутрен-
него сгорания, например, рабочим телом
является приготовленная в карбюраторе
горючая смесь, состоящая из воздуха
и паров бензина.
параметры состояния. Уравнения состояния
Свойства каждой системы характе-
ризуются рядом величин, которые при-
нято называть термодинамиче-
скими параметрами. Рассмот-
рим некоторые из них, используя при
этом известные из курса физики молеку-
лярно-кинетические представления об
идеальном газе как о совокупности моле-
кул, которые имеют исчезающе малые
размеры, находятся в беспорядочном
тепловом движении и взаимодействуют
друг с другом лишь при соударениях.
Давление обусловлено взаимо-
действием молекул рабочего тела с по-
верхностью и численно равно силе, дей-
ствующей на единицу площади повер-
хности тела по нормали к последней.
В соответствии с молекулярно-кинетиче-
ской теорией давление газа определяется

где п — число молекул в единице
объема; m — масса молекулы; с— сред-
няя квадратическая скорость поступа-
тельного движения молекул.
В Международной системе единиц
(СИ) давление выражается в Паскалях
1 Па=1 Н/м2). 1 кПа =
= 1000 Па и 1 МПа = 106 Па.
Давление измеряется при помощи
манометров, барометров и вакуумметров.
Жидкостные и пружинные манометры
измеряют избыточное давление, пред-
ставляющее собой разность между пол-
ным или абсолютным давлением р изме-
ряемой среды и атмосферным давлением
Приборы для измерения давлений
ниже атмосферного называются вакуум-
метрами; их показания дают значение
разрежения (или вакуума): рв = ратм—р,
т. е. избыток атмосферного давления над
абсолютным.
Следует отметить, что параметром
состояния является абсолютное давле-
ние. Именно оно входит в термодинами-
ческие уравнения.
Температурой называется фи-
зическая величина, характеризующая
степень нагретости тела. Понятие о тем-
пературе вытекает из следующего утвер-
ждения: если две системы находятся
в тепловом контакте, то в случае нера-
венства их температур они будут обмени-
ваться теплотой друг с другом, если же
их температуры равны, то теплообмена
не будет.
С точки зрения молекулярно-кинети-
ческих представлений температура есть
мера интенсивности теплового движения
молекул. Ее численное значение связано
с величиной средней кинетической энер-
гии молекул вещества:
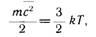
где k — постоянная Больцмана, равная
1,380662- 1СГ23 Дж/К- Температура 7",
определенная таким образом, называет-
ся абсолютной.
В системе СИ единицей температуры
является кельвин (К); на практике широ-
ко применяется градус Цельсия (°С). Со-
отношение между абсолютной Т и стогра-
дусной t температурами имеет вид
В промышленных и лабораторных ус-
ловиях температуру измеряют с по-
мощью жидкостных термометров, пиро-
метров, термопар и других приборов.
Удельный объем v — это
объем единицы массы вещества. Если
однородное тело массой М занимает
объем V, то по определению v = V/M.
В системе СИ единица удельного
объема 1 м'ч/кг. Между удельным
объемом вещества и его плотностью
существует очевидное соотношение:
v=[/p.
Для сравнения величин, характери-
зующих системы в одинаковых состояни-
ях, вводится понятие «нормальные физи-
ческие условия»: р = 760 ммрт. ст.=
= 101,325 кПа; 7" = 273,15 К.
В разных отраслях техники и разных
странах вводят свои, несколько отличные
от приведенных «нормальные условия»,
например, «технические» (р =
= 735,6 ммрт.ст. = 98 кПа, /=15°С)
или нормальные условия для оценки про-
изводительности компрессоров (р =
= 101,325 кПа, / = 20 °С) и т. д. В дан-
ной книге, если это не оговорено особо,
будут использоваться нормальные физи-
ческие условия.
Если все термодинамические пара-
метры постоянны во времени и одинако-
вы во всех точках системы, то такое
состояние системы называется равно-
весным.
Если между различными точками
в системе существуют разности темпера-
тур, давлений и других параметров, то
она является неравновесной.
В такой системе под действием гради-
ентов параметров возникают потоки теп-
лоты, вещества и другие, стремящиеся
вернуть ее в состояние равновесия. Опыт
показывает, что изолированная система
с течением времени всегда приходит в со-
стояние равновесия и никогда самопро-
извольно выйти из него не может.
В классической термодинамике рассмат-
риваются только равновесные системы.
УРАВНЕНИЕ СОСТОЯНИЯ
Для равновесной термодинамической
системы существует функциональная
связь между параметрами состояния, ко-
торая называется уравнением со-
стояния. Опыт показывает, что удель-
ный объем, температура и давление про-
стейших систем, которыми являются
газы, пары или жидкости, связаны тер-
мическим уравнением состо-
яния вида f (p, v, T) = 0.
Уравнению состояния можно придать
другую форму: p = f1(v,T); v = f2(p,T);
T = f3(p,v).
Эти уравнения показывают, что из
трех основных параметров, определяю-
щих состояние системы, независимыми
являются два любых.
Для решения задач методами термо-
динамики совершенно необходимо знать
уравнение состояния. Однако оно не мо-
жет быть получено в рамках термодина-
мики и должно быть найдено либо экспе-
риментально, либо методами статистиче-
ской физики. Конкретный вид уравнения
состояния зависит от индивидуальных
свойств вещества.
Уравнение состояния идеальных га-
зов. Из уравнений A.1) и A.2) следует,
что p = nkT.
Рассмотрим 1 кг газа. Учитывая, что
в нем содержится N молекул и, следова-
тельно, n = N/v, получим: pv/T = Nk =
= const.
Постоянную величину Nk, отнесен-
ную к I кг газа, обозначают буквой
R и называют газовой постоян-
ной. Поэтому
pv/T = R, или pv = RT.
Полученное соотношение представляет
собой уравнение Клапейрона 1834 г.).
получим уравнение состояния для
произвольной массы газа М:
PV = MRT.
Уравнению Клапейрона можно при-
дать универсальную форму, если отнести
газовую постоянную к 1 кмолю газа,
т. е. к количеству газа, масса которого
в килограммах численно равна молеку-
лярной массе \х.. Положив в A.4) М = мю
и V=Vмю, получим для одного моля урав-
нение Клапейрона — Менделеева:

Газовая постоянная I кг газа составляет
R= 8314/мю
5 термодинамический процесс. Равновесные и неравновесные, обратимые и необратимые процессы, изображение обратимых процессов в Т\Д диагр
Изменение состояния термодинами-
ческой системы во времени называется
термодинамическим процес-
сом. Так, при перемещении поршня
в цилиндре объем, а с ним давление
и температура находящегося внутри газа
будут изменяться, будет совершаться
процесс расширения или сжатия газа.
Как уже отмечалось, система, выве-
денная из состояния равновесия, и пре-
доставленная при постоянных парамет-
рах окружающей среды самой себе, че-
рез некоторое время вновь придет в рав-
новесное состояние, соответствующее
этим параметрам. Такое самопроизволь-
ное (без внешнего воздействия) возвра-
щение системы в состояние равновесия
называется релаксацией, а проме-
жуток времени, в течение которого систе-
ма возвращается в состояние равнове-
сия, называется временем релак-
сации. Для разных процессов оно
различно: если для установления равно-
весного давления в газе требуется всего
10~ "' с, то для выравнивания температу-
ры в объеме того же газа нужны десятки
минут, а в объеме нагреваемого твердого
тела — иногда несколько часов.
Термодинамический процесс называ-
ется равновесным, если все пара-
метры системы при его протекании меня-
ются достаточно медленно по сравнению
с соответствующим процессом релакса-
ции. В этом случае система фактически
все время находится в состоянии равно-
весия с окружающей средой, чем и опре-
деляется название процесса.
Чтобы процесс был равновесным,
скорость изменения параметров систе-
мы dA/dтау должна удовлетворять соотно-
шению

где А — параметр, наиболее быстро из-
меняющийся в рассматриваемом процес-
се; Срел — скорость изменения этого па-
раметра в релаксационном процессе;
тау — время релаксации.
Рассмотрим, например, процесс сжа-
тия газа в цилиндре. Если время смеще-
ния поршня от одного положения до дру-
гого существенно превышает время ре-
лаксации, то в процессе перемещения
поршня давление и температура успеют
выравняться по всему объему цилиндра.
Это выравнивание обеспечивается непре-
рывным столкновением молекул, в ре-
зультате чего подводимая от поршня
к газу энергия достаточно быстро и рав-
номерно распределяется между ними.
Если последующие смещения поршня бу-
дут происходить аналогичным образом,
то состояние системы в каждый момент
времени будет практически равновесным.
Таким образом, равновесный процесс
состоит из непрерывного ряда последо-
вательных состояний равновесия, поэто-
му в каждой его точке состояние термо-
динамической системы можно описать
уравнением состояния данного рабочего
тела. Именно поэтому классическая
термодинамика в своих исследованиях
оперирует только равновесными процес-
сами. Они являются удобной идеализа-
цией реальных процессов, позволяющей
во многих случаях существенно уп-
ростить решение задачи. Такая идеали-
зация вполне обоснована, так как усло-
вие A.8) выполняется на практике до-
статочно часто. Поскольку механические
возмущения распространяются в газах
со скоростью звука, процесс сжатия газа
в цилиндре будет равновесным, если ско-
рость перемещения поршня много мень-
ше скорости звука.
Процессы, не удовлетворяющие усло-
вию dA/dтау <<Cpeл протекают с нарушени-
ем равновесия, т. е. являются нерав-
новесными. Если, например, быстро
увеличить температуру окружающей сре-
ды, то газ в цилиндре будет постепенно
прогреваться через его стенки, релакси-
руя к состоянию равновесия, соответ-
ствующему новым параметрам окружаю-
щей среды. В процессе релаксации газ
не находится в равновесии с окружаю-
щей средой и его нельзя характеризовать
уравнением состояния хотя бы потому,
что в разных точках объема газа темпе-
ратура имеет различные значения.
Круговой процесс(цикл)
Круговой процесс (цикл) в термодинамике, процесс, при котором физическая система (например, пар), претерпев ряд изменений, возвращается в исходное состояние. Термодинамические параметры и характеристические функции состояния системы (температура Т, давление р, объём V, внутренняя энергия U, энтропия S и др.) в конце Круговой процесс вновь принимают первоначальное значение и, следовательно, их изменения при Круговой процесс равны нулю (DU = 0 и т. д.). Все изменения, возникающие в результате Круговой процесс, происходят только в среде, окружающей систему. Система (рабочее тело) на одних участках Круговой процесс производит положительную работу за счёт своей внутренней энергии и количеств теплоты Qn, полученных от внешних источников, а на др. участках Круговой процесс работу над системой совершают внешние силы (часть её идёт на восстановление внутренней энергии системы). Согласно первому началу термодинамики (закону сохранения энергии), произведённая в Круговой процесс системой или над системой работа (А) равна алгебраической сумме количеств теплоты (Q), полученных или отданных на каждом участке Круговой процесс (DU = Q — А = 0,А = Q). Отношение А/Qn (совершённой системой работы к количеству полученной ею теплоты) называется коэффициентом полезного действия (кпд) Круговой процесс.Различают равновесные (точнее, квазиравновесные) Круговой процесс, в которых последовательно проходимые системой состояния близки к равновесным, и неравновесные Круговой процесс, у которых хотя бы один из участков является неравновесным процессом. У равновесных Круговой процесс кпд максимален. На рисунке дано графическое изображение равновесного (обратимого) Карно цикла, имеющего максимальное кпд. Круговой процесс называется прямым, если его результатом является совершение работы над внешними телами и переход определённого количества теплоты от более нагретого тела (нагревателя) к менее нагретому (холодильнику). Круговой процесс, результатом которого является перевод определённого количества теплоты от холодильника к нагревателю за счёт работы внешних сил, называется обратным Круговой процесс или холодильным циклом.
Дата добавления: 2018-05-13; просмотров: 353; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
