Малорастворимые электролиты. Произведение растворимости
Цель работы: ознакомление с общими свойствами малорастворимых электролитов и методикой расчетов, связанных с произведением растворимости.
Оборудование и реактивы: конические пробирки, фарфоровые чашки, бюретка, металлические щипцы, асбестовая сетка, аналитические весы, электроплитка, эксикатор с осушителем, 0,5 М растворы NaCl, KI; 0,25 М растворы FeSO4, Pb(NO3)2, (NH4)2S; сероводородная вода; насыщенный раствор CaSO4.
8.1 Теоретические пояснения
Существует большая группа малорастворимых солей, гидроксидов, кислот, которые не могут, строго говоря, быть отнесены ни к сильным, ни к слабым электролитам. Их нельзя считать слабыми электролитами, так как водные растворы из-за малой растворимости веществ очень разбавлены, и вещества в них подвергаются полному распаду на ионы. Но и к сильным электролитам указанные соединения также нельзя отнести, поскольку их растворы содержат ничтожно малое количество ионов. Такие вещества принято называть малорастворимыми электролитами.
В насыщенном растворе малорастворимого электролита устанавливается гетерогенное равновесие между осадком и находящимися в растворе ионами:
АmBn  mAn++nBm-.
mAn++nBm-.
осадок  насыщенный раствор
насыщенный раствор
В насыщенном растворе скорости процессов растворения и кристаллизации одинаковы, а концентрации ионов над твердой фазой являются равновесными при данной температуре.
|
|
|
Константа равновесия данного гетерогенного процесса определяется только произведением активностей ионов в растворе и не зависит от активности твердого компонента. Она получила название произведения растворимости ПР.

 (8.1)
(8.1)
Таким образом, произведение активностей ионов в насыщенном растворе малорастворимого электролита при заданной температуре есть величина постоянная.
Если электролит имеет очень низкую растворимость, то в его растворе концентрации ионов ничтожны. В этом случае межионным взаимодействием можно пренебречь и считать концентрации ионов равными их активностям. Тогда произведение растворимости можно выразить через равновесные молярные концентрации ионов электролита:
 . (8.2)
. (8.2)
Произведение растворимости, как любая константа равновесия, зависит от природы электролита и от температуры, но не зависит от концентрации ионов в растворе.
При увеличении концентрации одного из ионов в насыщенном растворе малорастворимого электролита, например, в результате введения другого электролита, содержащего тот же ион, произведение концентраций ионов становится больше величины произведения растворимости. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Осадок будет образовываться до тех пор, пока не установится новое равновесие, при котором снова выполняется условие (8.2), но уже при других соотношениях концентраций ионов. При увеличении концентрации одного из ионов в насыщенном растворе над твердой фазой концентрация другого иона уменьшается так, чтобы произведение растворимости осталось величиной постоянной при неизменных условиях.
|
|
|
Итак, условием выпадения осадка является:
 . (8.3)
. (8.3)
Если в насыщенном растворе малорастворимого электролита уменьшить концентрацию какого-либо его иона, то ПР станет больше произведения концентраций ионов. Равновесие сместится в сторону растворения осадка. Растворение будет продолжаться до тех пор, пока снова не станет выполняться условие (8.2).
Итак, условием растворения осадка является:
 . (8.4)
. (8.4)
8.2 Методика проведения опытов
8.2.1 Опыт №1 Определение произведения растворимости сульфата кальция
На аналитических весах взвесьте фарфоровую чашку объемом 20-30 мл, прилейте в нее из бюретки 10 мл насыщенного раствора сульфата кальция и поставьте чашку с раствором на разогретую электрическую плитку. Когда вся вода испарится и на стенках чашки появится белый налет сульфата кальция, с помощью металлических щипцов перенесите чашку в эксикатор, заполненный осушителем. Спустя 20-30 минут взвесьте чашку и вычитанием из результата взвешивания массы пустой чашки определите массу выделившейся соли.
|
|
|
Определите произведение растворимости сульфата кальция, считая, что осадок соответствует формуле CaSO4 × 0,5Н2О. Для этого:
1) зная массу выделившегося кристаллогидрата, рассчитайте массу безводной соли CaSO4;
2) зная массу CaSO4 и объем раствора, рассчитайте молярную концентрацию CaSO4, которая численно равна молярной концентрации каждого из ионов малорастворимого электролита CaSO4;
3) Рассчитайте величину произведения растворимости для CaSO4.
Пользуясь табличными данными для произведения растворимости CaSO4, определите относительную ошибку опыта в процентах. Ошибка порядка 20% считается приемлемой.
8.2.2 Опыт №2. Полнота осаждения иона
В коническую пробирку прилейте 2 мл раствора нитрата свинца
(С= 0,25 моль/л) и добавьте к нему 3 мл раствора хлорида натрия (С=0,5 моль/л). Дайте осадку отстояться. Слейте с осадка жидкую фазу и распределите ее по двум пробиркам. В одну из пробирок добавьте 1 мл раствора хлорида натрия
(С= 0,5 моль/л), а в другую — 1 мл иодида калия (С = 0,5 моль/л). Опишите свои наблюдения. При оформлении результатов опыта ответьте на вопросы.
|
|
|
1) Какая реакция идет в пробирке с нитратом свинца при добавлении хлорида натрия? Составьте молекулярное и ионное уравнения реакции. Укажите признак реакции.
2) В каком из двух случаев после декантации вновь образуется осадок? Составьте ионное уравнение реакции образования осадка. Укажите признак реакции.
3) На основании опыта сделайте вывод о сравнительной величине произведений растворимости хлорида и иодида свинца. Приведите справочные данные для произведения растворимости этих двух солей и проверьте по ним свое заключение.
8.2.3 Опыт №3 Условие образования осадков малорастворимых электролитов
В две конические пробирки внесите по 1 мл раствора сульфата железа (II);
С = 0,25 моль/л. В первую пробирку добавьте такой же объем сероводородной воды, а во вторую — раствора сульфида аммония (сделайте это при включенной тяге). Опишите свои наблюдения. При оформлении результатов опыта ответьте на вопросы.
1) В каком случае образовался осадок малорастворимого электролита? Запишите уравнение реакции в молекулярной и ионной форме.
2) При каком условии (а или б) образуется осадок FeS: а)  ; б)
; б)  ?
?
3) Зная ПРFeS и  , найдите
, найдите  , необходимую для осаждения сульфида железа.
, необходимую для осаждения сульфида железа.
8.3 Требования к уровню подготовки студентов
˗ Знать понятия: малорастворимый электролит, насыщенный раствор, произведение растворимости.
˗ Иметь представление о гетерогенном равновесии между осадком малорастворимого электролита и его насыщенным раствором, о константе этого равновесия, ее зависимости от различных факторов.
˗ Уметь записывать выражения для произведения растворимости малорастворимых электролитов.
˗ Уметь по справочным значениям ПР рассчитывать растворимость малорастворимого электролита, активности (концентрации) его ионов в насыщенном растворе.
˗ Уметь использовать математические выражения для условий образования и растворения осадков малорастворимых электролитов.
8.4 Примеры решения задач
Пример 1
Образуется ли осадок гидроксида железа (III), если к 1 л 0,006 М раствора хлорида железа (III) прибавить 0,125л 0,0001 М раствора гидроксида калия? Произведение растворимости гидроксида железа (III) равно 3,8×10-38. Степень электролитической диссоциации исходных веществ принять равной единице.
Решение
В насыщенном растворе гидроксида железа (III) устанавливается равновесие
Fe(OH)3DFe3++3OH-,
для которого произведение растворимости, в силу малой концентрации растворов, может быть выражено через равновесные молярные концентрации:
ПР=[Fe3+][OH-]3.
Молярная концентрация катионов железа равна молярной концентрации хлорида железа (III), а концентрация ионов ОН- равна концентрации гидроксида калия. Рассчитаем концентрации ионов, принимая во внимание, что после сливания растворов гидроксида железа (III) и гидроксида калия объем раствора стал 1л + 0,125л = 1,125л.
 ,
,

[Fe3+][OH-]3= 0,0053×(1,11×10-5)3 = 7,2×10-18.
Так как ПР<[Fe3+][OH-]3, то можно сделать вывод, что в заданных условия будет выпадать осадок гидроксида железа(III).
Пример 2
Определить растворимость в воде карбоната серебра, если его произведение растворимости равно 6,15×10-12.
Решение
В насыщенном растворе карбоната серебра устанавливается равновесие
Ag2CO3D2Ag++CO32-
Для него произведение растворимости может быть выражено через равновесные молярные концентрации:
ПР=[Ag+]2[CO32-].
Пусть растворимость карбоната серебра равна х моль/л, тогда
[CO32-]=х моль/л, [Ag+]=2х моль/л.
Учитывая величину произведения растворимости для карбоната серебра, составим уравнение:
6,15×10-12=(2х)2×х
х=1,15×10-4.
Итак, растворимость карбоната серебра равна 1,15×10-4 моль/л.
8.5 Задания для самоконтроля
8.5.1 Какую минимальную концентрацию CaCl2 нужно превысить в растворе, содержащем 0,01 моль/л Na2CO3, чтобы началось выпадение осадка CaCO3? Произведение растворимости CaCO3 равно 4,8∙10-9. Диссоциацию электролитов считать полной, коэффициентами активности ионов пренебречь.
8.5.2 Какова растворимость Bi(OH)3, выраженная в г/л, если величина произведения растворимости для этого гидроксида составляет 4,27∙10-31?
8.5.3 Какой станет концентрация SrSO4 в насыщенном растворе после прибавления к нему Na2SO4 до концентрации Na2SO4 0,3 моль/л? Произведение растворимости SrSO4 равно 3,2∙10-7. Диссоциацию Na2SO4 считать полной, изменением ионной силы раствора пренебречь.
8.5.4 Какова величина произведения растворимости для BaF2, если в 5 л воды можно растворить максимально 5,7 г этой соли?
8.5.5 Какую минимальную концентрацию Cd(NO3)2 нужно превысить в растворе, содержащем 0,002 моль/л Na2S, чтобы началось выпадение осадка CdS? Произведение растворимости CdS равно 7,1∙10-28. Диссоциацию электролитов считать полной, коэффициентами активности ионов пренебречь.
8.5.6 Какова растворимость Pb3(PO4)2, выраженная в г/л, если величина произведения растворимости для этой соли составляет 7,94∙10-43?
8.5.7 Какой станет концентрация Ag2CO3 в насыщенном растворе после прибавления к нему AgNO3 до концентрации AgNO3 0,01 моль/л? Произведение растворимости Ag2CO3 равно 6,15∙10-12. Диссоциацию AgNO3 считать полной, изменением ионной силы раствора пренебречь.
8.5.8 В каком объеме насыщенного раствора содержится 2 г CaSO4? Произведение растворимости CaSO4 составляет 9,12∙10-6.
8.5.9 Какую минимальную концентрацию NaCl нужно превысить в растворе, содержащем 0,01 моль/л Pb(NO3)2, чтобы началось выпадение осадка PbCl2? Произведение растворимости PbCl2 равно 2∙10-5. Диссоциацию электролитов считать полной, коэффициентами активности ионов пренебречь.
8.5.10 Какова растворимость Ag2CrO4, выраженная в г/л, если величина произведения растворимости для этой соли составляет 1,3∙10-12?
8.5.11 Запишите уравнение реакции образования какого-либо малорастворимого электролита (молекулярное и ионное) и выражение для произведения растворимости этого электролита.
8.5.12 По справочным значениям ПPZnS и ПРCuS рассчитайте активность ионов S2- в насыщенном растворе: a) ZnS; б) CuS.
8.5.13 Рассчитайте активность иона железа (Ш) в насыщенном растворе гидроксида железа. Во сколько раз  в этом растворе меньше
в этом растворе меньше 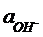 ?
?
8.5.14 По справочной величине произведения растворимости гидроксида магния вычислите растворимость этого гидроксида в моль/л при заданной температуре. Считайте, что коэффициенты активности  .
.
8.5.15 Используя табличную величину  , рассчитайте активность иона СО32 – в растворе, где
, рассчитайте активность иона СО32 – в растворе, где  = 10 – 3 моль/л.
= 10 – 3 моль/л.
8.6 Список рекомендуемой литературы
8.6.1 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
8.6.2 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс,
2008. – 240 с.
9 Лабораторная работа №10
Гидролиз солей
Цель работы: изучить свойства водных растворов солей, связанные с реакцией гидролиза.
Оборудование и реактивы: штативы с пробирками, универсальная индикаторная бумага с цветной шкалой значений рН, 0,1М растворы NaCl, Na2CO3, CH3COONa, NH4Cl, AlCl3; 1М растворы Na2CO3, AlСl3, NaHCO3, NaH2PO4, дистиллированная вода; мерная колба на 100 мл; рН-метр.
9.1 Теоретические пояснения
Гидролиз (разложение водой (лат.)) – в широком смысле слова – это процесс обменного взаимодействия между водой и веществом. Гидролизу подвергаются соединения различных классов, в том числе и соли.
Гидролиз соли – это химическое взаимодействие ионов соли с молекулами воды, приводящее к образованию слабого электролита. В результате гидролиза происходит смещение равновесия диссоциации воды вследствие образования малодиссоциирующих соединений, малорастворимых или летучих веществ. В соответствии с этим гидролизуются только катионы слабых оснований и анионы слабых кислот, то есть гидролизу подвергаются три типа солей:
¾ соли, образованные слабыми основаниями и сильными кислотами (гидролиз по катиону), например, NН4CI, Cu(N03)2, FeС13;
¾ соли, образованные сильными основаниями и слабыми кислотами (гидролиз по аниону), например, СН3СООNa, Na2CO3, NaHCO3;
¾ соли, образованные слабыми основаниями и слабыми кислотами (гидролиз по катиону и аниону), например, CH3COONН4, АI2S3, (NH4)2S.
Соли, образованные сильными основаниями и сильными кислотами (NaCI, KNO3, NaCIO4 и другие), гидролизу не подвергаются, так как при растворении их в воде не происходит связывания ни катионов Н+, ни анионов ОН–.
Рассмотрим написание ионно-молекулярных уравнений гидролиза на примере соли FеС13. Эта соль образована слабым основанием Fе(ОН)3 и сильной кислотой HС1, следовательно, гидролизу подвергается только катион соли Fe3+.
В соответствии с ионным уравнением
Fe3++HOHDFeOH2++H+ (9.1)
при гидролизе происходит разрыв связи Н—ОН в молекуле воды, и образуется слабый электролит FeOH2+, его константа диссоциации K(FeOH2+)=1,4·10–12. Ионы Н+ создают кислотную среду.
В молекулярной форме уравнение гидролиза имеет вид
FeCl3+HOHDFeOHCl2+HCl. (9.2)
Уравнения (9.1) и (9.2) отражают первую ступень гидролиза соли FeCl3. Гидролиз солей, образованных слабыми многокислотными основаниями и сильными кислотами (Cu(NО3)2, А1С13 и другие), или солей, образованных слабыми многоосновными кислотами и сильными основаниями (Na2S, К3РО4 и другие), протекает ступенчато, но при обычных условиях практически ограничивается первой ступенью.
При нагревании и разбавлении раствора гидролиз усиливается, и становятся заметными последующие ступени гидролиза.
Вторая ступень:
[FeOH]2++НОНDFe(ОН)2++Н+
FeOHCl2+HOHDFe(OH)2Cl+HCl (9.3)
Третья ступень:
[Fе(ОН)2]++НОНDFе(ОН)3+Н+
Fе(ОН)2С1+НОНDFе(ОН)3+НС1. (9.4)
Преимущественное протекание гидролиза по первой ступени объясняется тем, что, чем слабее образующийся электролит, тем сильнее гидролизуется соль. Для слабых электролитов, диссоциирующих ступенчато, всегда справедливо следующее соотношение констант диссоциации по ступеням: К1> К2> К3 (данные по константам диссоциации приведены в таблице 9.1). Поэтому в приведенном примере частица FeOН2+, диссоциация которой характеризуется константой К3, является наиболее слабым электролитом из образующихся при гидролизе, что и обусловливает преимущественное протекание гидролиза по первой ступени, на которой образуется эта частица.
Следует подчеркнуть, что ступенчатый гидролиз солей нельзя изображать суммарным уравнением, например, Fe3++ЗН2О=Fe(ОH)3+3H+, получаемым путем сложения уравнений отдельных ступеней гидролиза (при сложении сокращается главный продукт гидролиза – ион FeОН2+).
Если соль образована сильным основанием и слабой кислотой (Na2S, Na2СО3, Na2SО3, NaСN, NaNO2, CH3COONa и другие), гидролиз происходит по аниону, то есть по остатку слабой кислоты.
Рассмотрим ступенчатый гидролиз Na2S.
Первая ступень:
S2–+НОНDНS–+ОН– (9.5)
Константа диссоциации иона НS– очень мала, К2(НS–)=4·10–14, поэтому равновесие реакции (9.5) смещено вправо. В результате в растворе повышается концентрация ОН–, то есть реакция среды щелочная (рН>7).
Реакция (9.5) в молекулярной форме имеет следующий вид:
Na2S+HOHDNaHS+NaOH.
Вторая ступень:
НS–+НОНDН2S+NaOH (9.6)
NaНS+НОНDН2S+NaOH.
Константа диссоциации К1(Н2S)=10-7, поэтому можно заключить, что реакция (9.6) менее смещена вправо, чем реакция (9.5), то есть гидролиз в основном протекает по первой ступени, и в растворе Na2S преобладают ионы НS–, ОН– и Na+ в составе соединений NaHS и NaOH.
Таблица 9.1 – Константы электролитической диссоциации некоторых слабых электролитов в водных растворах при 25° С
| Название электролита | Формула | Константа диссоциации |
| Азотистая кислота | HNО2 | 4,6·10– 4 |
| Синильная кислота | HCN | 7,9·10–10 |
| Сернистая кислота | H2SO3 | K1=1,6·10–2 К2=6,2·10–8 |
| Сероводородная кислота | H2S | K1=1·10–7 K2=4·10–14 |
| Угольная кислота | Н2СО3 | K1= 4,5·10–7 K2=4,7·10–11 |
| Уксусная кислота | СН3СООН | 1,75·10–5 |
| Фосфорная кислота | Н3РО4 | К1=7,1·10–3 К2=6,3·10–8 К3=5·10–13 |
| Хлорноватистая кислота | HCIO | 5·10–8 |
| Гидроксид аммония | NH4ОH или NН3·Н2О | 1,75·10–5 |
| Гидроксид алюминия | А1(ОН)з | К3=10–9 |
| Гидроксид железа (III) | Fе(ОН)3 | K1=4·10–9 К2=6·10–11 К3=4·10–12 |
| Гидроксид магния | Мg(ОН)2 | K2=1,5·10–3 |
| Гидроксид меди (II) | Сu(ОН)2 | K2=10–7 |
| Гидроксид кальция | Са(ОН)2 | K2=2·10–1 |
| Гидроксид цинка | Zn(OH)2 | К1=10–5 К2=5·10–7 |
Если соль образована слабым основанием и слабой кислотой (CН3СООNH4 и другие), то гидролизу подвергаются катион и анион соли:
СН3СОО–+NH4++НОНDСН3СООH+NН3·Н2О. (9.7)
В подобном случае реакция среды близка к нейтральной и зависит от сравнительной силы образующихся кислоты и основания (соотношения констант диссоциации кислоты и основания). Если ККИС.>КОС., то реакция среды слабокислая, если КОС.>ККИС., то среда слабощелочная, если КОС.=ККИС., то среда нейтральная.
Формулы для расчета количественных характеристик гидролиза различных типов солей приводятся в таблице 9.2.
Таблица 9.2 – Характеристики растворов гидролизующихся солей
| Тип соли | Реакция среды в растворе | Продукты гидролиза | Константа гидролиза КГ | Степень гидролиза h | Концентрации [H+] или [OН–] |
| Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону) | кислая pН< 7 | слабые основания или основные соли |

|

|
[H+]= 
|
| Cоль, образованная слабой кислотой и сильным основанием (гидролиз по аниону) | щелочная pН>7 | Слабые кислоты или кислые соли |

|

|
[ОН–]=
=  [H+]=
=
[H+]=
= 
|
| Соль, образованная слабым основанием и слабой кислотой (гидролиз по аниону и по катиону). | слабокислая, слабощелочная или нейтральная в зависимости от соотношения констант диссоциации продуктов гидролиза | Слабые кислоты и слабые основания |

|
»  ,
более точно: ,
более точно:
 
|
[H+]=
= 
|
| Кислая соль, образованная слабой двухосновной кислотой и сильным основанием | pН>7, если (KГ>Kкисл II); рН <7, если (KГ<Kкисл II) | Слабая кислота |

|

|
 [H+]=
= [H+]=
= 
|
Так как гидролиз большинства солей является обратимым процессом, то степень гидролиза можно изменять, смещая равновесие реакций гидролиза и нейтрализации. Важнейшими факторами, влияющими на степень гидролиза, являются следующие:
¾ величина константы диссоциации слабой кислоты или слабого основания, образующих соль;
¾ общая концентрация соли;
¾ температура;
¾ рН раствора.
Влияние первого фактора видно из формулы (9.8):
 (9.8)
(9.8)
Константа гидролиза тем больше, чем меньше КДИС. слабой кислоты, или слабого основания, образующих соль. Иными словами, чем слабее образующийся при гидролизе электролит, тем сильнее гидролизуется соль.
Формулы расчета степени гидролиза h (смотрите таблицу 9.2) показывают, что разбавление раствора усиливает гидролиз, а повышение концентрации соли подавляет его.
Влияние температуры на степень гидролиза можно вывести из принципа Ле-Шателье. Реакция нейтрализации экзотермична, следовательно, гидролиз, (обратный ей процесс) является эндотермическим процессом, также как и диссоциация воды. Поэтому при повышении температуры гидролиз усиливается, напротив, охлаждение раствора подавляет гидролиз.
За счет гидролиза в растворах солей устанавливается определенное значение рН, поэтому, изменяя рН раствора, можно усиливать или подавлять гидролиз в соответствии с принципом смещения химического равновесия Ле-Шателье.
Так, введение кислоты в раствор FеС13 (кислая реакция среды раствора соли) вызовет смещение равновесия влево, то есть степень гидролиза уменьшится. Наоборот, связывание ионов Н+ путем добавления в раствор анионов ОН– усилит гидролиз за счет смещения равновесия вправо.
При сливании растворов солей, одна из которых гидролизуется по катиону, а другая – по аниону, происходит взаимное усиление гидролиза обеих солей, и гидролиз может протекать необратимо.
Например, в растворах FеС13 и Na2S, взятых в отдельности, гидролиз протекает практически только по первой ступени и устанавливаются равновесия (9.1) и (9.5) соответственно.
При сливании этих растворов происходит реакция нейтрализации:
Н+ + ОН- = Н2О,
При этом равновесия реакций (9.1) и (9.5) смещаются вправо, вплоть до образования конечных продуктов гидролиза обеих солей. Иными словами, протекает необратимый совместный гидролиз этих двух солей:
FeCl3 + 3Na2S + 6H2О = 2Fe(OH)3¯ + 3H2S + 6NaCl
Fe3+ + 3S2-+ 6H2О = 2Fe(OH)3¯ + 3H2S
По аналогичной схеме взаимного усиления гидролиза, приводящего к образованию осадка и газа, взаимодействуют соли, образованные катионами Аl3+, Cr3+, Fe3+, с карбонатами и сульфидами щелочных металлов. Поэтому карбонаты и сульфиды Аl3+, Cr3+, Fe3+ невозможно получить реакциями обмена из водных растворов.
9.2 Методика проведения опытов
9.2.1 Опыт №1. Определение рН дистиллированной воды и раствора NaCl
Каплю дистиллированной воды нанесите на полоску универсального индикатора и сравните полученную окраску с цветной шкалой рН. Объясните полученный результат, принимая во внимание, что при растворении диоксида углерода из воздуха в дистиллированной воде устанавливается равновесие:
СО2 + Н2О D Н2СО3 D Н++ НСО3–
Для свежеперегнанной воды значение рН равно 7. Для удаления растворенного СО2 дистиллированную воду следует прокипятить и хранить в сосуде с пробкой, снабженной трубкой с поглотителем СО2.
С помощью универсального индикатора определите рН раствора NаС1 и сравните полученный результат с рН дистиллированной воды. Протекает ли в растворе NaCl гидролиз?
9.2.2 Опыт №2. Гидролиз солей, образованных сильными основаниями и слабыми кислотами. Влияние величины константы диссоциации кислоты, образующей соль, на степень гидролиза
С помощью универсального индикатора определите рН в 0,1 М растворах СН3СООNa и Nа2СО3. Сравните полученные значения рН, установите, в каком из растворов степень гидролиза соли больше? Ответ подтвердите расчетами констант гидролиза, степени гидролиза и значений рН растворов указанных солей. Для Nа2СО3 учесть только первую ступень гидролиза.
Составьте ионные и молекулярные уравнения гидролиза обеих солей. Результаты опыта и расчетов занесите в таблицу 9.3.
Сделайте вывод о влиянии величины константы диссоциации кислоты, образующей соль, на степень гидролиза.
Таблица 9.3 – Результаты опытов
| Формула соли | Уравнения гидролиза | Опытное значение рН | Расчетные данные | ||
| КГ | h | pH | |||
9.2.3 Опыт №3. Гидролиз солей, образованных слабыми основаниями и сильными кислотами. Влияние величины константы диссоциации основания, образующего соль, на степень гидролиза
С помощью универсального индикатора определите рН в 0,1 М растворах NH4Cl и А1С13. Исходя из значений рН, сделайте вывод о том, какая соль подвергается более глубокому гидролизу. Ответ подтвердите расчетами констант гидролиза, степени гидролиза и значений рН растворов указанных солей. Для раствора А1С13 следует учесть только первую ступень гидролиза. Составьте ионные и молекулярные уравнения гидролиза обеих солей. Результаты опыта и расчетов занесите в таблицу 9.3.
Сделайте вывод о влиянии величины константы диссоциации основания, образующего соль, на степень гидролиза.
9.2.4 Опыт №4. Равновесия в растворах кислых солей
Измерьте рН 1 М растворов NаНСОз и NаН2РО4 с помощью универсального индикатора. Исходя из значений рН, сделайте вывод о том, какой процесс: диссоциация кислотного остатка или гидролиз, преобладает в растворе каждой из солей. Ответ подтвердите сравнением величин константы гидролиза соли и константы диссоциации кислоты по соответствующей ступени, а также расчетом рН. Запишите ионные и молекулярные уравнения гидролиза. Результаты опыта и расчетов занесите в таблицу 9.3
9.2.5 Опыт №5. Влияние концентрации соли на степень гидролиза
Из 0,1 М раствора NH4Cl приготовьте 0,001 М раствор. Для этого 1 мл 0,1 М раствора с помощью пипетки перенесите в мерную колбу на 100 мл и добавьте дистиллированную воду до метки. Полученный раствор тщательно перемешайте. Измерьте рН 0,1 М и 0,001 М растворов при помощи рН-метра. Исходя из значений рН, рассчитайте концентрацию ионов Н+ и степень гидролиза для обоих растворов по формуле
h= [H+]/Cсоли
Полученные данные сравните с расчетными величинами для константы гидролиза, степени гидролиза и рН растворов NН4С1 указанных концентраций. Результаты опыта и расчетов занесите в таблицу 9.3.
Сделайте вывод о влиянии концентрации соли на степень гидролиза.
9.2.6 Опыт 6. Взаимное усиление гидролиза двух солей
В пробирку внесите 1 – 2 мл раствора хлорида алюминия и добавьте такой же объем карбоната натрия. Какой газ выделяется и какое соединение выпадает в осадок? Почему при взаимодействии растворов этих солей гидролиз протекает практически необратимо? Составьте ионные и молекулярные уравнения совместного гидролиза двух солей.
9.3 Примеры решения задач
Пример 1
Написать молекулярные и ионно-молекулярные уравнения гидролиза сульфита калия K2SO3.
Решение
Соль образована катионом сильного основания и анионом слабой двухосновной кислоты. Гидролиз идет по аниону. В растворе щелочная реакция среды.
1 ступень: К2SО3 + H2O D KHSO3 + КОН
SO32-– + Н2О D HSO3–+OH—
2 ступень: KHSO3 + Н2O D Н2SО3 + КОН
HSO3–+ Н2O D Н2SО3 + ОН–
Пример 2
Написать молекулярные и ионно-молекулярные уравнения гидролиза нитрата свинца (II)
Решение
Соль образована катионом слабого двухкислотного основания и анионом сильной кислоты. Гидролиз идет по катиону. Раствор имеет кислую реакцию среды.
1 ступень: Pb(NO3)2 + Н2О D (PbOH)NO3 + HNO3
РЬ2+ + Н2О D РЬОН– + Н+
2 ступень: (РЬОН)NО3 + Н2О D Pb(OH)2 + НNО3
РbОН– + Н2О D Pb(OH)2 + Н+
Пример 3
Написать уравнение гидролиза цианида аммония NH4CN. Какова реакция среды в водном растворе этой соли?
Решение
Соль образована катионом слабого основания и анионом слабой кислоты, поэтому гидролиз идет как по катиону, так и по аниону:
NH4CN + Н2О D NH4OH + HCN
NH4+ + CN– + Н2О D NH4OH + HCN
Для оценки реакции среды необходимо сравнить константы диссоциации NH4OH и HCN (таблица 9.1). Так как константа диссоциации гидроксида аммония больше, чем константа диссоциации синильной кислоты, то гидроксид аммония является более сильным электролитом. В растворе будут преобладать ионы ОН–, следовательно, реакция среды щелочная.
Пример 4
Учитывая только первую ступень гидролиза 0,5М раствора Na2S, рассчитайте константу гидролиза, степень гидролиза и рН среды.
Решение
Гидролизу по первой ступени соответствует следующее ионно-молекулярное уравнение:
S2- + Н2О D НS– + OH–
Константа гидролиза Na2S пo первой ступени есть отношение ионного произведения воды к константе диссоциации слабой кислоты HS–.
Константа диссоциации гидросульфид-иона представляет собой константу диссоциации H2S по второй ступени, ее значение можно взять из таблицы 9.1.
КГ = 
Степень гидролиза:
h = 
Для нахождения рН среды рассчитаем концентрацию водородных ионов:
[H+]= 
pH = - lg[H+] = - lg (2.83·10 –14) = 13,55 
9.4 Требования к уровню подготовки студентов
˗ Знать понятия: гидролиз солей, константа гидролиза, степень гидролиза.
˗ Уметь связывать склонность соли к гидролизу с силой кислот и оснований, образующих данную соль.
˗ Иметь представление о факторах, влияющих на степень гидролиза.
˗ Уметь выражать процесс гидролиза с помощью молекулярных и ионно-молекулярных уравнений, оценивать рН среды в водном растворе соли, рассчитывать величины константы и степени гидролиза.
9.5 Задания для самоконтроля
9.5.1 При хранении растворов солей гидролиз не желателен. Что нужно сделать, чтобы ослабить гидролиз сульфата кобальта (II)?
9.5.2 Какие из перечисленных солей будут подвергаться гидролизу: K2SO4; NaClO4; Na2S; CuSO4; КNО3; РЬ(NО3)2; (NН4)2СО3; КNO3? Написать соответствующие молекулярные и ионно-молекулярные уравнения. Рассчитать для 0,2М растворов константу гидролиза, степень гидролиза и рН среды, учитывая только первую ступень гидролиза.
9.5.3 При сливании растворов Al2(SO4)3 и Na2S выпадает белый осадок и ощущается неприятный запах. Объясните причину этого, приведя соответствующие уравнения реакций.
9.5.4 Почему раствор NаН2РО4, имеет слабокислую, а раствор Nа3РО4 щелочную реакцию среды? Ответ обоснуйте соответствующими уравнениями реакций и расчетами. Воспользоваться данными таблиц 9.1 и 9.2.
9.5.5 Какие из приведенных солей гидролизуются: NH4NO3, ВеСl2, К2SО4, NаNО2, Nа2СО3, ВаС12, Al2(SO4)3, Nа3РО4, FеSО4, (NH4)2S, Са(СН3СОО)2? Для гидролизующихся солей написать ионные и молекулярные уравнения гидролиза и указать реакцию среды раствора.
9.5.6 Напишите ионные и молекулярные уравнения гидролиза солей и укажите качественно значение рН растворов: K2SО3, СrС13, СuSО4, K2S, К3РО4, Fе(NO3)3.
9.5.7 Вычислите константу гидролиза, степень гидролиза и рН растворов солей: а) 0,5М NH4NО3, б) 0,1М KNO2, в) 0,1М Nа2S, г) 0,3М FеС13, д) 0,5М СНзСООNН4.
9.5.8 Рассчитайте КГ и рН 1М растворов NаН2РО4, Nа2НРО4 и Nа3РО4. Какая из солей гидролизуется в наибольшей степени и почему? Сравнивая величины КГ и соответствующие константы диссоциации Кк-ты, объясните, почему в растворе NаН2PО4 среда кислая, а в растворе Nа2НРО4 - щелочная.
9.5.9 Напишите ионные и молекулярные уравнения реакций, происходящих при сливании растворов: а) А1(NО3)3 и (NH4)2S, б) Fe2(SО4)3 и Nа2СО3, г) СrС13 и К2SО3. Объясните смещение равновесия гидролиза и практически необратимое его протекание.
9.5.10 Вычислить степень гидролиза Na3PO4 по первой ступени в 0,1М растворе. Каково значение рН этого раствора?
9.5.11 Вычислить константу, степень гидролиза и рН 0,1 М раствора сульфита натрия.
9.5.12 Почему раствор NaHCO3 имеет слабощелочную, а раствор NaHSO3 слабокислую реакцию среды?
9.5.14 Вычислить степень гидролиза 0,1 М раствора NaHS. Какое значение рН имеет этот раствор?
9.6 Список рекомендуемой литературы
9.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с.
9.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
9.6.3 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс,
2008. – 240 с.
Лабораторная работа №10
Дата добавления: 2018-05-13; просмотров: 1496; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
