Основные классы неорганических соединений (часть II: кислоты, соли)
Цель работы: усвоение классификации и взаимосвязи между основными классами неорганических соединений; получение неорганических соединений и изучение их свойств.
Оборудование и реактивы: спиртовка, штатив с бюреткой, держатель для пробирок, пинцет, шпатели, фильтровальная бумага, пробирки, колбочка на 50 мл, пипетки, стеклянная трубочка, фарфоровая чашка, индикаторы: фенолфталеин и метиловый оранжевый, дистиллированная вода, кристаллический ацетат натрия, металлический цинк, 0,5н. растворы CuSO4,, CoCl2, FeCl3, Na2SO4, NaCl, Pb(NO3)2 или Pb(CH3COO)2, 2н. растворы NaOH, H2SO4, HCl, 30% раствор NaOH, 10% раствор NH4OH, известковая вода.
4.1 Теоретические пояснения
Кислотные гидроксиды – это кислородсодержащие кислоты, в состав которых входят гидроксильные группы:
H2SO4 HNO3 H2CO3
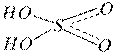
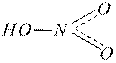
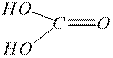
Кислотные гидроксиды диссоциируют в воде с образованием в качестве катионов только ионов водорода Н+, взаимодействуют с основаниями и основными оксидами с образованием солей.
Следует отметить, что понятие кислоты шире, чем понятие кислотного гидроксида, так как существуют и бескислородные кислоты, например, HCl, HF, H2S, HCN и другие.
В номенклатуре кислотных гидроксидов (кислот) используются как тривиальные, так и систематические названия. Последние полностью отражают состав соединения и даются по правилам составления названий комплексных соединений. Систематические названия рекомендуется давать лишь малораспространенным кислотам, образованным элементами с переменной степенью окисления. Например, H6TeO6 – гексаоксотеллурат (VI) водорода. Однако серную кислоту вовсе не требуется называть тетраоксосульфат (VI) водорода, за ней сохраняется традиционное название.
|
|
|
При взаимодействии между собой гидроксидов и оксидов, с различными кислотно-основными свойствами, образуются соли. Соли по составу подразделяются на простые, двойные, смешанные и комплексные.
Двойные соли образованы двумя различными катионами и одним анионом. Например, KAl(SO4)2 – сульфат алюминия-калия.
Смешанные соли образованы несколькими различными анионами (кислотными остатками) и одним катионом. Например, Ca(ClO)Cl – хлорид-гипохлорит кальция или хлорная известь.
Комплексные соли содержат в своем составе сложные комплексные ионы, которые в химических реакциях, процессах растворения, в структуре кристалла ведут себя как самостоятельные единицы. Например, K4[Fe(CN)6] гексацианоферрат (II) калия диссоциирует в воде на ионы в соответствии с уравнением
|
|
|
K4[Fe(CN)6]  4K+ + [Fe(CN)6] 4-.
4K+ + [Fe(CN)6] 4-.
Комплексный анион практически не диссоциирует в водном растворе, поэтому Fe2+ не обнаруживается качественными реакциями.
Простые соли по характеру замещения подразделяются на средние (нормальные), кислые и основные.
Средние соли, например, CuSO4, Na2CO3 и другие, являются продуктами полного замещения ионов водорода в кислоте на другие катионы или продуктами полного замещения гидроксильных групп в основании на кислотные остатки.
Перечислим некоторые основные способы образования средних солей:
˗ взаимодействие металлов с кислотами
Zn + 2HCl = ZnCl2 + H2;
˗ взаимодействие металлов, оксиды которых амфотерны, со щелочами
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2;
˗ взаимодействие основания с кислотой
NaOH + HCl = NaCl + H2O;
˗ взаимодействие основания с кислотным оксидом
Ca(OH)2 + CO2 = CaCO3¯ + H2O;
˗ взаимодействие кислоты с основным оксидом
CaO + 2HCl = CaCl2 + H2O;
˗ взаимодействие кислоты с солью (более сильная кислота вытесняет более слабую, летучую, разлагающуюся или выпадающую в осадок кислоту из ее соли)
2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4;
˗ взаимодействие растворимого основания с солью
FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl;
˗ взаимодействие между солями
NaCl + AgNO3 = AgCl¯ + NaNO3;
˗ взаимодействие солей с металлами
|
|
|
CuSO4 + Zn = Cu¯ + ZnSO4;
˗ взаимодействие основных и кислотных оксидов
SO3 + CaO = CaSO4;
˗ взаимодействие металлов с неметаллами
2Fe + 3Cl2 = 2FeCl3.
Кислые соли можно рассматривать как продукты неполного замещения ионов водорода в двух- или более основной кислоте на другие катионы. Кислые соли получаются при взаимодействии кислоты или кислотного оксида с недостатком основания, либо взаимодействием средней соли с кислотой или кислотным оксидом.
H2SO4 + NaOH = NaHSO4 + H2O; CO2 + KOH = KHCO3;
Ca3(PO4)2 + H3PO4 = 3CaHPO4; CaCO3 + CO2 + H2O = Ca(HCO3)2.
Так как в анионе кислой соли содержится подвижный водород, то она частично сохраняет свойства кислоты и может вступать в реакцию нейтрализации с основаниями.
NaHSO4 + NaOH = Na2SO4 + H2O.
Основные соли можно рассматривать как продукты неполного замещения ОН – групп в многокислотных основаниях на кислотные остатки. Эти соли получаются при взаимодействии основания с недостатком кислоты или средней соли с основанием.
Mg(OH)2 + HCl = MgOHCl + H2O;
CoCl2 + NaOH = CoOHCl¯ + NaCl.
Так как в состав основных солей входят гидроксильные группы, то эти соли могут взаимодействовать с кислотами с образованием средних солей. Таким образом, основные соли частично сохраняют свойства оснований.
|
|
|
MgOHCl + HCl = MgCl2 + H2O
Систематические названия солей связаны с систематическими названиями соответствующих кислот. Традиционные названия солей кислородсодержащих кислот составляются из названия аниона в именительном падеже и катиона в родительном падеже. Название аниона включает корень русского или латинского названия кислотообразующего элемента с добавлением суффикса, соответствующего степени окисления элемента. При этом возможны следующие случаи:
˗ если кислотообразующий элемент имеет только одну степень окисления, то добавляется суффикс –ат ( Na2CO3 – карбонат натрия);
˗ если кислотообразующий элемент имеет две степени окисления, то при высшей из них к корню добавляется суффикс –ат, а при низшей степени окисления добавляется суффикс –ит (CaSO4 – сульфат кальция, Na2SO3 – cульфит натрия);
˗ если имеются анионы, отвечающие четырем степеням окисления кислотообразующего элемента, то для высшей степени окисления используется приставка пер- и суффикс -ат (КCl+7O4 – перхлорат калия), затем суффикс –ат (KCl+5O3 – хлорат калия), суффикс –ит (KCl+3O2 – хлорит калия) и для наименьшей степени окисления – приставка гипо- и суффикс –ит (KCl+1O – гипохлорит калия);
˗ в названиях анионов солей бескислородных кислот используется суффикс –ид (K2S – сульфид калия);
˗ при построении традиционных названий кислых солей к названию аниона средней соли добавляется приставка гидро- и числовая греческая приставка, если число атомов водорода в анионе больше одного (Ca(H2PO4)2 – дигидрофосфат кальция, Ca(HCO3)2 – гидрокарбонат кальция);
˗ традиционные названия основных солей формируются при помощи приставки гидроксо- и при необходимости соответствующей числительной приставки ((CuOH)2CO3 – карбонат гидроксомеди (II)).
Методика проведения опытов
4.2.1 Кислоты
4.2.1.1 Опыт №1. Получение кислоты при взаимодействии соли с кислотой
Поместить в пробирку небольшое количество ацетата натрия и прибавить к нему 3 – 4 капли раствора серной кислоты. Отметить характерный запах. Какая кислота образуется? Написать уравнение реакции.
4.2.1.2 Опыт №2. Взаимодействие кислот с металлами
В пробирку поместить небольшой кусочек цинка. Добавить 1 – 2 мл соляной кислоты. Объяснить наблюдения, записать уравнения реакции.
4.2.2 Соли, их получение и свойства
4.2.2.1 Опыт №3. Получение средней соли реакцией нейтрализации
Налить в колбочку на 50 мл 3 мл 0,5 н раствора гидроксида натрия и прибавить одну каплю индикатора метилового оранжевого. Затем добавлять по каплям при перемешивании 0,5 н раствор соляной кислоты. Кислоту приливать до изменения цвета индикатора из желтого в оранжевый. Объясните изменение окраски индикатора. Какую реакцию среды будет иметь раствор в момент изменения окраски? Написать уравнение реакции.
4.2.2.2 Опыт №4. Получение основных солей
Налить в пробирку 2 мл раствора сульфата меди (II), добавить несколько капель раствора гидроксида аммония. Выпадает зеленовато-голубой осадок основной соли (CuOH)2SO4. Написать уравнение реакции.
Налить в пробирку 2 мл раствора хлорида кобальта (II), прибавить несколько капель 2 н раствора щелочи. В пробирке образуется синий осадок основной соли. При добавлении избытка щелочи образуется розовый осадок гидроксида кобальта (II). Написать уравнения реакций.
4.2.2.3 Опыт №5. Получение солей взаимодействием нерастворимого основания с кислотой
К 2 мл раствора хлорида железа (III) прибавить раствор гидроксида натрия до образования осадка. К осадку прибавить по каплям раствор соляной кислоты. Объяснить наблюдаемые явления, написать уравнения реакций.
4.2.2.4 Опыт №6. Получение солей взаимодействием солей с металлами
В две пробирки с растворами сульфата меди (II) и сульфата натрия поместить по небольшому кусочку цинка. Что наблюдается? Объяснить различное отношение растворов солей к цинку. Написать уравнение реакции.
4.2.2.5 Опыт №7. Получение солей взаимодействием двух солей
В пробирку, содержащую 1 мл раствора нитрата или ацетата свинца добавить раствор хлорида натрия до образования осадка. Написать уравнение реакции.
4.2.2.6 Опыт №8. Получение кислых солей
Через раствор гидроксида кальция (известковая вода) пропустить углекислый газ из аппарата Киппа. Наблюдать образование осадка средней соли, а затем его растворение вследствие образования кислой соли. Написать уравнения реакций. К прозрачному раствору добавить известковой воды до образования осадка. Написать уравнение реакции.
4.3 Требования к уровню подготовки студентов
˗ Знать номенклатуру основных классов неорганических соединений.
˗ Знать классификацию и взаимосвязь между основными классами неорганических соединений, способы их получения и свойства.
˗ Уметь составлять химические формулы по названию вещества и давать название веществу по его химической формуле.
˗ Уметь писать уравнения реакций, отражающих химические свойства кислот и солей. Знать условия, при которых реакции ионного обмена протекают до конца.
4.4 Задания для самоконтроля
4.4.1 Какие из ниже перечисленных веществ будут попарно взаимодействовать друг с другом? Написать уравнения реакций.
а) Na[Al(OH)4]; HCl; CuO; KOH
б) MgOHCl; NaOH; HCl; AgNO3
в) CO2; NaHCO3; H2SO4; NaOH
г) Al; HCl; KOH; CuSO4
4.4.2 Осуществить превращения:
а) P ® P2O5® H3PO4 ® Ca3(PO4)2 ® Ca(H2PO4)2
б) Ca(HCO3)2 ® CaCO3 ® CaO ® CaCl2 ® CaCO3
в) Fe ® FeCl2 ® Fe(OH)2 ® Fe(OH)3 ® [Fe(OH)2]2SO4
4.4.3 Получить всеми известными вам способами следующие соли:
Al2(SO4)3; KHCO3; CuOHNO3.
4.4.4 Друг с другом в водном растворе будут взаимодействовать:
а) Fe и Pb(NO3)2; б) Ca(HCO3)2 и NaOH;
в) Ca(HCO3)2 и CO2; г) Na2SO4 и H3PO4.
А) а, г; B) б, г; C) а, г; D) а,б
4.4.5 Выберите вариант с правильными названиями соединений, соответствующих формулам Ca(HCO3)2 и Na2S2O3:
а) дигидрокарбонат кальция, дисульфат натрия;
б) гидрокарбонат кальция, дисульфит натрия;
в) дигидрокарбонат кальция тиосульфат натрия;
г) гидрокарбонат кальция, тиосульфат натрия.
4.4.6 Какие из перечисленных кислот могут образовывать кислые соли:
a)H2SO4; б) H2S; в) HClO4; г) H2CO3; д) HNO3; е) HCl?
4.4.7 Сколько формул основных солей представлено в списке: K[Al(OH)4]; Fe(OH)3; [Al(OH)2]2SO4; (CuOH)2CO3; Ca(HCO3)2; K3[Fe(CN)6]; CaSO4?
4.4.8 Выберите вариант с правильными названиями соединений, соответствующих формулам (Fe(OH)2)2SO4 и NaClO.
а) сульфат дигидроксожелеза (II), гипохлорит натрия;
б) сульфат гидроксожелеза (III), хлорит натрия;
в) сульфат дигидроксожелеза (III), гипохлорит натрия;
г) сульфат дигидроксожелеза (II), хлорат натрия.
4.5 Список рекомендуемой литературы
4.5.1 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс,
2008. – 240 с.
Лабораторная работа №5
Кинетика химических реакций
Цель работы: изучение скорости химической реакции и ее зависимости от природы реагирующих веществ, их концентрации, температуры, величины поверхности раздела веществ, катализатора.
Оборудование и реактивы: пробирки, в том числе с наклеенной внизу полоской изоленты, 4 бюретки, секундомер, термометр, электроплитка, 4 стакана на 100 мл, пробирка с газоотводной трубкой, кристаллизатор, штатив c лапкой, фарфоровый пестик, шпатель, фильтровальная бумага, 0,25 М растворы Na2S2O3, H2SO4, CuSO4, находящиеся в бюретках, 0,1М растворы соляной и уксусной кислот, концентрированная соляная кислота, два кусочка мела, одинаковые по размеру (0,2 – 0,3 г), две гранулы металлического цинка, 3% раствор перекиси водорода, порошок MnO2, дистиллированная вода.
Лабораторная работа выполняется в звеньях. Первое звено выполняет опыты 5.2.1 и 5.2.2, второе звено выполняет опыт 5.2.4, третье звено – опыты 5.2.3 и 5.2.5. Каждое звено предоставляет полученные экспериментальные данные другим звеньям. Обработка экспериментальных данных, их анализ и выводы делаются каждым студентом индивидуально.
5.1 Теоретические пояснения
Скорость химической реакции – это изменение количества вещества Dn вступающего в реакцию или образующегося в результате реакции в единицу времени в единице реакционного пространства.
Для гомогенной реакции, протекающей во всем объеме V системы, единицей реакционного пространства является единица объема. Тогда средняя скорость реакции по данному веществу за промежуток времени Dt выразиться формулой
vср.= 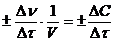 , (5.1)
, (5.1)
где DС – изменение молярной концентрации вещества за промежуток времени, моль/л.
Знак «+» используется, если за скоростью реакции следят по увеличению концентрации продуктов реакции, а знак «-» – если о скорости судят по убыли концентрации исходных веществ.
Только при линейной зависимости концентрации вещества от времени истинная скорость реакции (скорость в данный момент времени) постоянна и равна средней скорости. При нелинейной зависимости истинная скорость реакции изменяется со временем. Поэтому средняя скорость за некоторый промежуток времени является грубым приближением истинной.
Чтобы определить скорость реакции в данный момент времени t, необходимо взять бесконечно малый интервал времени dt, иными словами, истинная скорость реакции определяется первой производной количества вещества по времени:
v = 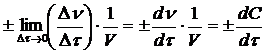 (5.2)
(5.2)
Для гетерогенной реакции, протекающей на границе раздела между веществами, единицей реакционного пространства является единица площади S поверхности раздела фаз. Выражения для средней и истинной скорости реакции по данному веществу имеют следующий вид:
vср.= 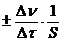 ; (5.3)
; (5.3)
v= 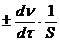 . (5.4)
. (5.4)
Скорость химической реакции зависит от многих факторов. Рассмотрим влияние некоторых из них.
Прежде всего, скорость химической реакции зависит от природы реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс. Этот закон формулируется для простых реакций, то есть реакций, протекающих в одну стадию, или для отдельных элементарных стадий сложных химических реакций:
 скорость реакции при заданной температуре пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам в уравнении реакции.
скорость реакции при заданной температуре пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам в уравнении реакции.
Для простой реакции вида
аА + вВ→продукты реакции
этот закон выражается уравнением
v = k(CA)a×(CB)b (5.5)
Это выражение называются кинетическими уравнениями. Коэффициент пропорциональности k называется константой скорости реакции, его величина зависит от природы веществ, температуры, присутствия катализатора, но не зависит от концентрации.
В большинстве случаев химическая реакция представляет собой сложный многостадийный процесс, и уравнение реакции отражает материальный баланс, а не действительный ход процесса. Поэтому закон действующих масс не может быть применен ко всему процессу в целом. Иногда зависимость скорости реакции от концентрации веществ вообще не может быть описана степенной функцией вида (5.5).
Для характеристики кинетики экспериментально изучаемых реакций вводят понятие порядка реакции. Порядок реакции по данному веществу (частный порядок) – это число, равное показателю степени, в которой концентрация этого вещества входит в кинетическое уравнение реакции. Частный порядок определяется экспериментально. Он может принимать целые, дробные, отрицательные значения, быть равным нулю. В общем случае частный порядок не равен соответствующему стехиометрическому коэффициенту в уравнении реакции, хотя иногда, по случайному совпадению, оказывается таким, каким его следовало бы ожидать на основании стехиометрии реакции.
В кинетике гетерогенных реакций существуют определенные особенности.
˗ В кинетические уравнения таких реакций не входят концентрации конденсированной фазы, поскольку реакция идет на поверхности раздела фаз, и концентрация конденсированной фазы остается постоянной.
˗ Гетерогенные реакции всегда представляют собой сложные процессы. Они включают не только стадии собственно химической реакции на поверхности, но и диффузионные стадии: подвод реагирующего вещества к поверхности, отвод от поверхности продуктов взаимодействия. Если скорость диффузии меньше скорости химической реакции, то именно диффузионные стадии будут определять скорость процесса. Скорость таких реакций возрастает при перемешивании.
˗ Удельная скорость собственно химического взаимодействия, отнесенная к единице поверхности, от площади поверхности не зависит. Однако если необходимо ускорить гетерогенный процесс в целом, прибегают к измельчению реагирующих веществ. Это приводит к увеличению поверхности контакта, уменьшению протяженности диффузионных путей.
Скорость большинства химических реакций возрастает при повышении температуры. Для реакций, протекающих со средними скоростями, в не очень больших интервалах температур выполняется приближенное эмпирическое правило Вант-Гоффа: при повышении температуры на 100 скорость реакции увеличивается в 2 – 4 раза.
Математически это можно записать так:
v2 = v1× 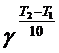 , (5.6)
, (5.6)
где v1 и v2 – скорости реакции при начальной Т1 и конечной Т2 температурах соответственно;
g – температурный коэффициент скорости реакции.
Температурный коэффициент скорости показывает, во сколько раз увеличится скорость реакции при повышении температуры на 100.
Более точно влияние температуры на скорость химической реакции выражается уравнением Аррениуса для константы скорости простой реакции или элементарной стадии сложного процесса:
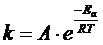 , (5.7)
, (5.7)
где А – предэкспоненциальный множитель;
R – газовая постоянная;
Т – абсолютная температура;
e – основание натурального логарифма;
Еа – энергия активации.
Уравнение Аррениуса применимо также ко многим (но не всем) сложным реакциям. В этих случаях энергию активации называют кажущейся.
В ходе реакции система проходит через переходное состояние (активированный комплекс). Активированный комплекс имеет более высокую энергию, чем исходные вещества и продукты реакции. Энергия активации представляет собой энергию, необходимую для образования активированного комплекса.
Одним из методов влияния на скорость реакции является катализ, который осуществляется при помощи катализаторов – веществ, изменяющих скорость химической реакции вследствие многократного участия в промежуточном химическом взаимодействии с реагентами, но после каждого цикла промежуточного взаимодействия восстанавливающих свой химический состав. Катализатор в конечные продукты реакции не входит. Как правило, вводится в небольших количествах по сравнению с исходными веществами.
Катализатор открывает новые пути процесса через переходные состояния с его участием, причем эти пути характеризуются меньшей энергией активации, чем некаталитическая реакция. Это приводит к увеличению скорости процесса.
Снижение энергии активации является определяющей, но не единственной причиной увеличения скорости реакции в присутствии катализатора. Катализатор может вызывать увеличение предэкспоненциального множителя в уравнении Аррениуса. По теории активированного комплекса предэкспоненциальный множитель зависит от энтропии образования переходного состояния, которая может увеличиваться в присутствии катализатора.
Катализатор не изменяет теплового эффекта реакции.
Различают положительный катализ, приводящий к ускорению реакции, и отрицательный, уменьшающий скорость реакции. В последнем случае, в силу избирательности (селективности), катализатор ускоряет ранее наиболее медленные стадии сложного процесса, тем самым исключая один из возможных без него путей процесса. В результате реакция замедляется или практически полностью подавляется.
Замедлять химические реакции могут также вещества, называемые ингибиторами, но механизм их действия несколько иной.
Различают гомогенный и гетерогенный катализ. При гомогенном катализе реагирующие вещества и катализатор образуют одну фазу, между ними отсутствует поверхность раздела. При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах, реакция идет на поверхности катализатора.
5.2 Методика проведения опытов
5.2.1 Опыт №1. Зависимость скорости реакции от концентрации реагирующих веществ
Изучение зависимости скорости реакции от концентрации проводится на примере реакции разложения тиосерной кислоты, которая образуется при приливании к раствору тиосульфата натрия раствора серной кислоты. При этом протекают следующие процессы:
H2SO4 + Na2S2O3 = H2S2O3 + Na2SO4
H2S2O3 = H2SO3 + S¯
H2SO3 = H2O + SO2
Скорость процесса определяется скоростью самой медленной второй стадии, которая и будет изучаться.
Суммарное уравнение процесса:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S¯
В ходе реакции наблюдается помутнение раствора, вызванное образованием суспензии серы.
5.2.1.1 В одну пробирку с темной полоской внизу налить 3мл 0,25М раствора тиосульфата натрия (Na2S2O3), в другую – 3мл 0,25М раствора серной кислоты. Быстро прилить кислоту в пробирку с тиосульфатом натрия, встряхнуть ее содержимое и начать отсчет времени. Когда темная полоска станет незаметна на просвет, отметить условное время окончания реакции Dt.
5.2.1.2 Проделать аналогичные опыты, различающиеся только концентрацией тиосульфата натрия в растворе, она последовательно уменьшается. Для этого в пробирку с темной полоской помещают:
а) 2 мл 0,25М раствора тиосульфата натрия и 1 мл дистиллированной воды;
б) 1 мл 0,25М раствора тиосульфата натрия и 2 мл дистиллированной воды.
5.2.1.3 Полученные данные занести в таблицу 5.1.
Таблица 5.1 – Результаты опыта
| Объем, мл | Общий объем V, мл | Концентрация H2S2O3, моль/л | Dt, с | 1/Dt, с-1 | ||
| I пробирка | II пробирка | |||||
| Na2S2O3 | H2O | H2SO4 | ||||
| 3 2 1 | 0 1 2 | 3 3 3 | 6 6 6 | |||
5.2.1.4 Вычислить величины 1/Dt, которые пропорциональны скорости реакции, а также молярную концентрацию H2S2O3 в растворе по формуле
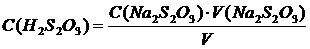 , (5.8)
, (5.8)
где C(Na2S2O3) – молярная концентрация исходного раствора тиосульфата натрия, моль/л;
V(Na2S2O3) – объем тиосульфата натрия, мл;
V – общий объем смеси, мл.
5.2.1.5 На основании полученных данных построить график зависимости скорости реакции, характеризуемой величиной 1/Dt от начальной концентрации тиосерной кислоты.
5.2.1.6 Сделать вывод о зависимости скорости реакции от концентрации реагирующих веществ.
5.2.2 Опыт №2. Зависимость скорости реакции от природы реагирующих веществ
5.2.2.1 Соберите прибор в соответствии с рисунком 5.1. Для этого нужно укрепить в штативе вертикально пробирку с газоотводной трубкой, свободный конец которой опустить в кристаллизатор с водой. Другую пробирку необходимо доверху заполнить водой. Закрыв отверстие пробирки пальцем, перевернуть ее вверх дном и опустить в кристаллизатор с водой. Под водой осторожно отпустить палец. Конец газоотводной трубки подвести к отверстию пробирки.
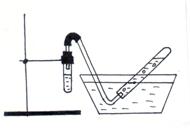
Рисунок 5.1 – Прибор для сбора газа над водой
5.2.2.2 Пробирку с газоотводной трубкой на 2/3 объема заполнить 0,1М раствором уксусной кислоты, затем внести туда две гранулы цинка. Закрыть пробирку пробкой с газоотводной трубкой, конец которой подвести к отверстию пробирки, заполненной водой. С помощью секундомера определить время заполнения пробирки газом.
5.2.2.3 Вылить уксусную кислоту из пробирки с газоотводной трубкой, достать из нее цинк, промыть его и высушить фильтровальной бумагой. С гранулами цинка провести опыт, аналогичный предыдущему, используя вместо уксусной кислоты 0,1М раствор соляной кислоты.
5.2.2.4 Написать уравнения протекающих реакций. Сравнить скорости взаимодействия уксусной и соляной кислоты одинаковых концентраций с цинком. Объяснить наблюдаемые явления.
5.2.3 Опыт №3. Зависимость скорости гетерогенного процесса от величины поверхности контакта реагирующих веществ
Взять два приблизительно одинаковых кусочка мела (0,2 – 0,3г). Один из них растереть пестиком на листе бумаги, порошок пересыпать в пробирку. В другую пробирку поместить второй кусочек мела. В обе пробирки одновременно добавить по 1мл концентрированной соляной кислоты. Наблюдать за ходом реакции в обеих пробирках. Написать уравнение реакции. Сделать вывод о зависимости скорости гетерогенного процесса от величины поверхности.
5.2.4 Опыт №4. Зависимость скорости реакции от температуры
5.2.4.1 В одну пробирку с темной полоской налить 2мл раствора тиосульфата натрия, в другую – 2мл раствора серной кислоты. Растворы находятся при комнатной температуре. Измерить эту температуру, результат записать в таблицу 5.2.
5.2.4.2 Слить вместе содержимое пробирок, встряхнуть. Определить условное время окончания реакции аналогично тому, как это было сделано в опыте 5.2.1. Записать результат в таблицу 5.2.
5.2.4.3 В две пробирки с темными полосками налить по 2мл тех же растворов. Поместить пробирки на 3 – 5 минут в стакан с водой, нагретой до температуры, на 100С более высокой, чем комнатная. Температуру в стакане поддерживать постоянной, по мере необходимости подливая горячую воду.
5.2.4.4 Слить содержимое пробирок вместе, встряхнуть. Поместить пробирку со смесью обратно в стакан с водой заданной температуры. Следить за помутнением содержимого пробирки. Определить условное время реакции, записать его в таблицу 5.2.
5.2.4.5 Повторить опыт при температуре, на 10 градусов выше, чем предыдущая. Данные записать в таблицу 5.2.
Таблица 5.2 – Результаты опыта
| № опыта | Температура t, 0С | Время Dt, с | 1/Dt, с-1 | g |
| 1 2 3 |
5.2.4.6 По данным таблицы 5.2 построить график зависимости скорости реакции, характеризуемой величиной 1/Dt от температуры. Сделать вывод о зависимости скорости реакции от температуры. Рассчитать температурный коэффициент скорости данной реакции g.
5.2.5 Опыт №5. Зависимость скорости реакции от присутствия катализатора
5.2.5.1 Каталитическое действие ионов Cu2+
В пробирку с темной полоской прилить 2мл раствора тиосульфата натрия. В другую пробирку столько же раствора серной кислоты и 1 каплю раствора сульфата меди (II). Слить содержимое пробирок вместе, встряхнуть. Условное время окончания реакции определить аналогично опытам 5.2.1 и 5.2.4.
Повторить описанные действия для 3 и 5 капель раствора сульфата
меди (II). Сделать вывод о зависимости скорости реакции от концентрации ионов Cu2+.
5.2.5.2 Каталитическое разложение пероксида водорода
В две пробирки прилить по 3 мл 3% раствора пероксида водорода. В одну из пробирок добавить на кончике шпателя порошок MnO2. В какой пробирке разложение пероксида водорода идет быстрее? Подтвердить выделение кислорода в пробирке с катализатором при помощи тлеющей лучинки.
Записать уравнение реакции. Гетерогенный или гомогенный катализ имеет место в данном случае?
5.3 Примеры решения задач
Пример 1
Во сколько раз возрастет скорость реакций:
1) C + 2H2 = CH4
2) 2NO + Cl2 = 2NOCl
при увеличении давления в системе в три раза?
Решение
Увеличение давления в системе в три раза эквивалентно увеличению концентраций каждого из газообразных компонентов в три раза. В соответствии с законом действующих масс запишем кинетические уравнения для каждой реакции.
1) Углерод представляет собой твердую фазу, а водород газовую. Скорость гетерогенной реакции не зависит от концентрации твердой фазы:
v = k[H2]2.
Пусть начальная концентрация водорода равнялась х, тогда v1 = kх2. После увеличения давления концентрация водорода стала 3х, а скорость реакции после увеличения давления v2 = k(3х)2 = 9kх2.
v1 /v2 = 9kx2 / kx2 = 9
Скорость реакции возрастет в 9 раз.
2) Кинетическое уравнение гомогенной реакции: v = k[NO]2×[Cl].
Пусть начальная концентрация NO равна х, а начальная концентрация
Сl2 равна у, тогда
v1 = kx2y; v2 = k(3x)23y = 27kx2y; v2/v1 = 27.
Скорость реакции возрастет в 27 раз.
Пример 2
Температурный коэффициент скорости реакции равен 2,8. На сколько градусов была повышена температура, если время протекания реакции сократилось в 124 раза?
Решение
В соответствии с правилом Вант-Гоффа
v1 = v2× 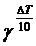 .
.
Время реакции t есть величина, обратно пропорциональная скорости, тогда v2/v1 = t1/t2 = 124.
t1t2 = 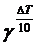 = 124
= 124
Прологарифмируем последнее выражение:
lg( 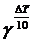 ) = lg124;
) = lg124;
DТ/10×lgg= lg124
DT = 10×lg124 / lg2,8 » 470.
Температура была повышена на 470.
Пример 3
При повышении температуры с 100С до 400С скорость реакции возросла в 8 раз. Чему равна величина энергии активации реакции?
Решение
Отношение скоростей реакции при различных температурах равно отношению констант скорости при тех же температурах и равно 8. В соответствии с уравнением Аррениуса
k2 / k1 = A× 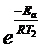 / A
/ A 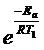 = 8
= 8
Так как предэкспоненциальный множитель и энергия активации практически не зависят от температуры, то
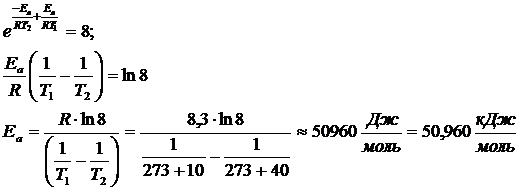
5.4 Требования к уровню подготовки студентов
˗ Знать понятия: скорость реакции, средняя и истинная скорость гомогенной и гетерогенной реакции, молекулярность и порядок реакции.
˗ Знать факторы, от которых зависит скорость реакции, закон действующих масс, особенности кинетики гетерогенных реакций, правило Вант-Гоффа, уравнение Аррениуса.
˗ Иметь представление об активированном комплексе, энергии активации.
˗ Знать понятия: катализ и катализаторы, гомогенный и гетерогенный катализ, положительный и отрицательный катализ, каталитические яды и промоторы, селективность катализаторов.
˗ Иметь представление о сущности каталитического действия.
˗ Уметь производить расчеты с использованием закона действующих масс, правила Вант-Гоффа, уравнения Аррениуса.
5.5 Задания для самоконтроля
5.5.1 Зависит ли скорость растворения железа в соляной кислоте от степени его измельчения? Ответы как «да», так и «нет» считаются неправильными.
5.5.2 Допишите уравнения приведенных ниже реакций и, опираясь на знания о соотношении их скоростей при комнатной температуре, укажите, для какой реакции энергия активации будет больше. Что нужно сделать, чтобы понизить энергию активаций?
1) AgNO3 + NaCl → ¼
2) N2 + H2 →¼
5.5.3 Во сколько раз возрастет скорость реакций:
1) CO2 + C = 2CO;
2) 2N2O = 2N2 + O2;
3) 2NO + O2 = 2NO2
при увеличении давления в системе в 4 раза?
5.5.4 Начальные концентрации Н2 и I2 в реакции второго порядка
H2 + I2 = 2 HI
равны 0,3 моль/л и0,2 моль/л соответственно. Константа скорости данной реакции при 5080С равна 0,16 л/(моль×мин). Вычислить скорость реакции при той же температуре в момент времени, когда прореагирует 0,1 моль/л I2.
5.5.5 Сколько времени потребуется для завершения реакции при 300С, если при 700С она заканчивается за 40 с? Температурный коэффициент скорости реакции равен 2.
5.5.6 Во сколько раз возрастет скорость реакции при повышении температуры с 20 до 600С, если энергия активации равна 135 кДж/моль?
5.5.7 Как изменится скорость тримолекулярной реакции
SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2
при уменьшении концентрации FeCl3 в растворе в 4 раза?
5.5.8 Какова величина температурного коэффициента скорости реакции, если при увеличении температуры на 40 градусов скорость реакции увеличилась в 20 раз?
5.5.9 Как изменится скорость гетерогенной реакции
С (т.) +2H2 (г.) → CH4 (г.)
при уменьшении давления в 2 раза?
5.5.10 Как изменится скорость реакции при понижении температуры на 40 градусов, если температурный коэффициент скорости реакции равен двум?
5.5.11 Как изменится скорость реакции второго порядка
2NO2 (г.) → 2NO (г.) + O2 (г.)
при уменьшении давления в системе в 3 раза?
5.5.12 При 400С реакция заканчивается за 10 минут. За какое время закончится эта реакция при 800С, если температурный коэффициент скорости реакции равен двум?
5.6 Список рекомендуемой литературы
5.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с.
5.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
5.6.3 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, 2008. 240 с.
Лабораторная работа №6
Дата добавления: 2018-05-13; просмотров: 351; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
