Опыт №1. Приготовление раствора с заданной массовой долей соли
Получите у преподавателя задание и рассчитайте, сколько граммов соли и миллилитров воды потребуется для приготовления раствора заданной концентрации. Расчеты проводятся аналогично Примеру 1 в разделе 7.3.
Покажите расчеты преподавателю и получите разрешение на проведение опыта.
Взвесьте на технохимических весах нужную массу соли и высыпьте ее в коническую колбу на 250 мл. Отмерьте цилиндром необходимый объем воды и влейте его в колбу с солью. Перемешивайте содержимое колбы до полного растворения соли.
Перелейте в цилиндр приготовленный раствор. При помощи ареометра измерьте его плотность rэкс.. Найдите по таблице 7.1 плотность раствора rтаб., соответствующую заданной концентрации.
Вычислите относительную ошибку опыта:

Рассчитайте молярную концентрацию, молярную концентрацию эквивалента, моляльную концентрацию и титр приготовленного раствора.
Результаты опыта и расчетов сведите в таблицу 7.2.
Таблица 7.2 – Результаты опыта
| Формула соли | Vр-ра, мл | w% | Масса соли, г | Vводы, мл | rтаб., г/см3 | rэкс., г/см3 | С(Х) | С(1/zХ) | b(X) | T(X) |
7.2.2 Опыт №2. Приготовление раствора с заданной массовой долей из более концентрированного раствора
В качестве более концентрированного раствора используется раствор, приготовленный в опыте 7.2.1.
Получите у преподавателя задание. Определите плотность заданного раствора по таблице 7.1. Рассчитайте объем более концентрированного раствора соли и объем воды, необходимые для приготовления раствора заданной концентрации, в соответствии с Примером 2 в разделе 7.3.
|
|
|
Покажите расчеты преподавателю и получите разрешение на выполнение опыта.
Отмерьте цилиндром рассчитанный объем более концентрированного раствора соли и долейте водой до необходимого объема.
Приготовленный раствор тщательно перемешайте, переливая из цилиндра в колбу и обратно. При помощи ареометра измерьте плотность раствора rэкс..
Вычислите относительную ошибку опыта аналогично опыту 7.2.1.
Результаты опыта сведите в таблицу 7.3.
Таблица 7.3 – Результаты опыта
| w% | V, мл | r, г/см3 | |||||
| Исходного раствора | Заданного раствора | Исходного раствора | Заданного раствора | Воды | Исходного раствора | Заданного раствора | |
| rтаб. | rэкс. | ||||||
7.2.3 Опыт №3. Приготовление раствора заданной молярной или нормальной концентрации из твердого вещества и воды
Получите у преподавателя задание (объем и концентрация раствора). Рассчитайте массу вещества, необходимую для приготовления раствора заданной концентрации. Проверьте расчеты у преподавателя.
|
|
|
Для приготовления раствора следует пользоваться мерной колбой, так как процесс растворения многих веществ сопровождается существенным изменением объема.
Взвесьте на технохимических весах рассчитанную навеску вещества. Пересыпьте вещество через воронку в мерную колбу. Оставшиеся на воронке частицы смойте в колбу небольшим количеством дистиллированной воды. Прибавляйте в мерную колбу воду до тех пор, пока до метки не останется 1 – 2 см. Затем воду добавляют из пипетки по каплям до тех пор, пока нижний край мениска не коснется метки на горлышке мерной колбы, при этом метка должна находиться на уровне глаз наблюдателя. Колбу плотно закрывают пробкой и перемешивают содержимое, несколько раз переворачивая сосуд вверх дном. Пробку при этом следует придерживать.
7.3 Примеры решения задач
Пример 1
Рассчитать массу CuSO4 и объем воды, необходимые для приготовления
130 мл 8% раствора этой соли. Рассчитать молярную, моляльную, нормальную концентрации и титр раствора. Значения плотности взять из таблицы 7.1.
Решение
 ,
,
m(р-ра)= r×V
В соответствии с данными таблицы 7.1, плотность 8% раствора CuSO4 равна 1,084 г/cм3 (г/мл).
|
|
|
m(CuSO4)=  =11,37 (г)
=11,37 (г)
m(H2O)=m(р-ра)-m(CuSO4)= r×V - m(CuSO4)=1,084×130-11,37=129,55(г).
Так как при комнатной температуре плотность воды близка к 1г/см3, то масса воды, выраженная в граммах, численно равна ее объему в мл. Итак, объем воды равен 129,55 мл » 130 мл.
Рассчитаем молярную концентрацию раствора:
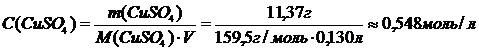

Нормальная концентрация:
 .
.
Моляльная концентрация:


Титр раствора:


Пример 2
Какой объем 8% раствора сульфата меди (II) и какой объем воды требуется для приготовления 110 мл 2% раствора соли?
Решение
Задачи этого типа, а также задачи на приготовление растворов заданной массовой доли из двух исходных растворов различных концентраций можно решить, используя правило смешения. Для этого друг под другом записываются процентные концентрации исходных растворов (для чистой воды концентрация соли равна нулю), а правее между ними процентная концентрация заданного раствора. В направлении диагоналей из большей концентрации вычитают меньшую и записывают результат:


 8 2
8 2

 2
2
 0 6
0 6
Числа 2 и 6 показывают, что для приготовления 110 мл 2% раствора необходимо взять 2 весовые части 8% раствора и 6 весовых частей воды.
Найдем массу 110 мл 2% раствора:
|
|
|
m(2% р-ра)=V(2% р-ра)×r(2% р-ра)= 110 × 1,019 = 112,1 (г).
Найдем массу одной весовой части 2% раствора (всего их 2+6=8):
112,1 : 8 = 14,01 (г).
m(8% р-ра) = 14,01 × 2 = 28,02 (г),
V(8% р-ра) = 
V(H2O)=V(2% р-ра) – V(8% р-ра)= 110 – 25,8 = 84,2 (мл).
Итак, для приготовления 110 мл 2% раствора сульфата меди (II) потребуется 25,8 мл 8% раствора и 84,2 мл воды.
7.4 Требования к уровню подготовки студентов
˗ Знать способы выражения концентрации растворов.
˗ Уметь определять плотность раствора при помощи ареометра.
˗ Уметь пользоваться таблицами зависимости плотности растворов от массовой доли растворенного вещества.
˗ Уметь производить расчеты, необходимые для приготовления растворов заданной концентрации, выраженной различными способами.
˗ Уметь готовить растворы заданной концентрации из сухого вещества и воды; из более концентрированного раствора и воды.
˗ Уметь находить массу или количество растворенного вещества, исходя из концентрации раствора.
˗ Уметь производить расчеты, связанные с переходом от одного способа выражения концентрации раствора к другому.
7.5 Задания для самоконтроля
7.5.1 Сколько граммов гидроксида калия нужно растворить в 600 мл воды для получения 16% раствора?
7.5.2 Какой объем 4% раствора хлорида кальция (плотность в таблице 7.1) требуется для взаимодействия с 120 мл 0,1М раствора AgNO3?
7.5.3 Определите массовую долю растворенного вещества в 2,64н. растворе серной кислоты. Плотность раствора серной кислоты равна 1,080 г/мл.
7.5.4 Какие объемы 12% раствора и 3% раствора хлорида натрия нужно смешать для получения 120 мл 8% раствора? При решении задачи воспользоваться данными таблицы 7.1.
7.5.5 Какой из перечисленных растворов содержит 0,27 моль растворенного вещества в 300 мл воды:
а) раствор CuSO4 с моляльной концентрацией 0,0009 моль/кг;
б) раствор K2SO4 с моляльной концентрацией 0,27 моль/кг;
в) раствор ZnCl2 с моляльной концентрацией 0,081 моль/кг;
г) раствор Al2(SO4)3 с моляльной концентрацией 0,9 моль/кг?
7.5.6 Какова величина нормальной концентрации водного раствора хлорида алюминия, если массовая доля растворенного вещества составляет 0,02? Плотность раствора 1,0164 г/см3.
7.5.7 В трех литрах какого из перечисленных растворов содержится
2,4 моль растворенного вещества:
а) 0,8 М раствор NH4Cl;
б) 1,2 М раствор CaCl2 ;
в) 7,2 М раствор NaOH;
г) 1,25 М раствор H2SO4?
7.5.8 Какова величина моляльной концентрации водного раствора ортофосфорной кислоты, если массовая доля растворенного вещества составляет 0,06?
7.5.8 Какая масса хлорида калия растворена в 180 граммах воды, если процентная концентрация по массе составляет 10%?
7.5.9 Какова величина титра водного раствора хлорида натрия, если массовая доля растворенного вещества составляет 0,1? Плотность раствора равна 1,0707 г/см3.
7.5.10 Какова величина мольной доли сульфата меди (II) в водном растворе, если массовая доля растворенного вещества составляет 0,12?
7.5.11 Какая масса серной кислоты содержится в двух литрах раствора, титр которого равен 0,08 г/см3?
7.6 Список рекомендуемой литературы
7.6.1 Коровин Н.В. Общая химия: Учебник для технических направ. и спец. вузов. – М.: Высш. шк., 2009. – 557 с.
7.6.2 Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И.Ермакова. – М.: Интеграл-Пресс, 2010. – 728 с.
7.6.3 Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/ Под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс,
2008. – 240 с.
7.6.4 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. –
288 с.
Лабораторная работа №8
Дата добавления: 2018-05-13; просмотров: 1411; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
