Вычислить тепловой эффект и изменение энергии Гиббса при 298 K для реакции в водном растворе
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего образования
Санкт-Петербургский горный университет
Кафедра физической химии
ФИЗИЧЕСКАЯ ХИМИЯ
Методические указания для самостоятельной работы для студентов направления подготовки бакалавриата 05.06.03 «Экология и природопользование»
Санкт-Петербург
2018
Домашние задания
Общие рекомендации
В процессе изучения дисциплины студент должен выполнить 6 домашних заданий. Номер варианта домашнего задания и сроки сдачи определяются преподавателем. График выполнения домашних заданий студент получает у лектора потока в начале семестра.
Решения задач должны быть кратко и точно обоснованы. При решении задач следует приводить весь ход решения и математические преобразования. Каждая работа аккуратно оформляется. Для замечаний преподавателя нужно оставить достаточно широкие поля (не менее трех сантиметров). Обязательно дать номер варианта, номер задачи, полное и краткое условия задачи. Задачи приводятся в том порядке, в котором они указаны в задании. Работы должны быть датированы, подписаны студентом и представлены преподавателю для проверки.
Если домашняя работа не зачтена, то нужно исправить решение в соответствии с указаниями преподавателя, и подать работу на повторную проверку. Исправления следует выполнять в конце работы под заголовком «Работа над ошибками», указывая номер исправляемого задания.
|
|
|
Расчет термодинамических параметров химических реакций
Краткие теоретические сведения
Согласно закону Гесса тепловой эффект реакции не зависит от пути процесса, а определяется только начальным и конечным состояниями системы при условии, что давление и объем в течение всего процесса остаются постоянными, а температура начала и конца процесса одинакова.
Из закона Гесса следует уравнение расчета теплового эффекта химической реакции:
 ,
,
где ν – стехиометрический коэффициент; индекс i относится к исходным веществам, индекс k – к продуктам реакции.  – тепловой эффект образования вещества, приведенный к стандартным условиям при температуре Т.
– тепловой эффект образования вещества, приведенный к стандартным условиям при температуре Т.
За стандартные условия принято состояние вещества в чистом виде при давлении 1 атм. Стандартное состояние вещества отмечается верхним индексом «о». Тепловые эффекты образования веществ для температуры 298 K приводятся в справочной литературе.
При расчете тепловых эффектов химических реакций, протекающих в водных растворах, следует учитывать диссоциацию химических соединений. Для этого следует перейти от молекулярного уравнения реакции к сокращенному ионному уравнению. При составлении ионного уравнения реакции нужно учитывать, что малорастворимые соединения, слабые электролиты (кислоты, основания), оксиды, газообразные вещества на ионы не диссоциируют. Для тех химических соединений, которые диссоциируют в растворе, в расчетах нужно использовать стандартные теплоты образования соответствующих ионов, а для тех, которые не диссоциируют – стандартные теплоты образования соединений.
|
|
|
Зависимость теплового эффекта реакции от температуры описывается уравнением
 ,
,
Под интегралом находится зависимость теплоемкости от температуры, которая выражается уравнением:
 ,
,
Коэффициенты 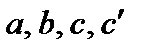 определяют из эксперимента или на основании молекулярно-статистических расчетов и приводят в справочной литературе.
определяют из эксперимента или на основании молекулярно-статистических расчетов и приводят в справочной литературе.  ,
,  и
и  (или
(или  для органических соединений) вычисляют по закону Гесса.
для органических соединений) вычисляют по закону Гесса.
Для определения направления протекания процесса пользуются величиной энергии Гиббса  . Энергия Гиббса складывается из изменения энтальпии процесса и так называемого энтропийного фактора:
. Энергия Гиббса складывается из изменения энтальпии процесса и так называемого энтропийного фактора:
 ,
,
где  – изменение энтропии.
– изменение энтропии.
Если ΔG < 0, то считается, что процесс термодинамически возможен.
|
|
|
Для изолированных систем энтропия является одним из критериев возможности протекания процесса.
Для расчета изменения энтропии в ходе химической реакции применим закон Гесса:
 ,
,
где ν – стехиометрический коэффициент; индекс i относится к исходным веществам, индекс k – к продуктам реакции. 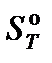 – энтропия образования вещества, приведенная к стандартным условиям при температуре Т.
– энтропия образования вещества, приведенная к стандартным условиям при температуре Т.
Зависимость изменения энтропии химической реакции от температуры описывается уравнением:
 .
.
Примеры решения задач
Пример 1. Вычислить тепловой эффект и изменение энергии Гиббса реакции
K2SO4(aq) + 2AgNO3(aq) = 2KNO3(aq) + Ag2SO4(s),
протекающей в водном растворе, при 298 K.
Решение. Для решения задачи следует перейти от молекулярного уравнения реакции к сокращенному ионному уравнению. При составлении ионного уравнения реакции следует учитывать, что малорастворимые соединения, слабые электролиты (кислоты, основания), оксиды, газообразные вещества на ионы не диссоциируют.
1. Составить полное ионное уравнение для этой реакции, учитывая, что хлорид серебра относится к малорастворимым соединениям (осадок):
 .
.
2. Сократив одинаковые компоненты по обе стороны уравнения, получить сокращенное ионное уравнение:
|
|
|
 .
.
3. Составить таблицу справочных данных, необходимых для расчета:
| Компонент | Ag2SO4(s) | 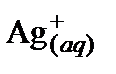
| 
|
 , кДж/моль , кДж/моль
| −715,88 | 105,75 | −909,26 |
 , кДж/моль , кДж/моль
|
4. Составить уравнение для расчета теплового эффекта реакции и выполнить необходимые вычисления:

5. Составить уравнение для расчета изменения энергии Гиббса реакции и выполнить необходимые вычисления

Пример 2.Вычислить изменение энергии Гиббса реакции
4NH3(g) + 5O2(g) = 6H2O(g) + 4NO(g)
при 298 K.
Решение. 1. Составить таблицу справочных данных, необходимых для расчета:
| Компонент | NH3(g) | O2(g) | H2O(g) | NO(g) |
 , кДж/моль , кДж/моль
| −45,94 | 0 | −241,81 | 91,26 |
 , Дж·моль−1·K−1 , Дж·моль−1·K−1
| 192,66 | 205,04 | 188,72 | 210,64 |
2. Составить уравнение для расчета теплового эффекта реакции и выполнить необходимые вычисления:

3. Составить уравнение для расчета изменения энтропии реакции в соответствии с законом Гесса и выполнить необходимые вычисления:

4. Вычислить изменение энергии Гиббса, учитывая разность в размерности теплового эффекта и энтропии:

Пример 3. Вычислить изменение энергии Гиббса при 850 K для реакции
4NH3(g) + 5O2(g) = 6H2O(g) + 4NO(g).
Решение. 1. Составить таблицу справочных данных, необходимых для расчета:
| Компонент | NH3(g) | O2(g) | H2O(g) | NO(g) |
 , кДж/моль , кДж/моль
| −45,94 | 0 | −241,81 | 91,26 |
 , Дж·моль−1·K−1 , Дж·моль−1·K−1
| 192,66 | 205,04 | 188,72 | 210,64 |
| a, Дж·моль−1·K−1 | 29,80 | 31,46 | 30,00 | 29,58 |
| b·103, Дж·моль−1·K−1 | 25,48 | 3,39 | 10,71 | 3,85 |
| c’·10−5, Дж·моль−1·K−1 | −1,67 | −3,77 | 0,33 | −0,59 |
2. Пользуясь законом Гесса, найти изменение коэффициентов теплоемкости в ходе процесса:



3. Вычислить тепловой эффект реакции при 850 K:

4. Вычислить изменение энтропии реакции при 850 K:


5. Вычислить изменение энергии Гиббса, учитывая размерности теплового эффекта и энтропии:

Задачи для решения
Вычислить тепловой эффект и изменение энергии Гиббса при 298 K для реакции в водном растворе
Реакции надо уравнять (окислительно-восстановительные реакции надо опознать и применить метод полу-реакций).
Дата добавления: 2018-05-09; просмотров: 3453; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
