Уравнение состояния реальных газов.
Закон соответственных состояний.
Отсутствие теоретически обоснованного единого уравнения состояния реального газа привело к выводу большого количества эмпирических и полуэмпирических уравнений состояния, справедливых для отдельных газов в ограниченном диапазоне изменения состояния. Чем точнее уравнение, тем больше индивидуальных констант оно содержит. Так, в уравнении состояния Ван-дер-Ваальса содержится две константы, а в более точном уравнении Бенедикта, Веба и Рубина восемь констант. Сложность этих уравнений создает трудности для инженерных расчетов. Поэтому в инженерных расчетах часто пользуются уравнением состояния Клапейрона с поправочным коэффициентом z:

где z – коэффициент сжимаемости.
Коэффициент сжимаемости учитывает отклонение объема реального газа от объема идеального (для идеального газа z=1). Коэффициент сжимаемости является функцией давления, температуры и природы газа. Он обычно определяется экспериментальным путем. Для многих газов построены графики коэффициента сжимаемости. При отсутствии экспериментальных данных коэффициент сжимаемости определяется по номограммам в зависимости от приведенных температуры и давления (Тпр, Рпр) газа или в зависимости от давления, температуры и относительной плотности по воздуху, а также по формулам, рекомендованным в отраслевых нормах проектирования:

где 
|
|
|
Для обобщения данных по коэффициентам сжимаемости различных газов был использован принцип соответственных состояний, сформулированный Ван-дер-Ваальсом, который утверждал, что «критическое состояние является действительно одинаковым или соответственным состоянием для всех веществ».
Степень удаления от критической точки определяется с помощью приведенных параметров:
приведенного давления 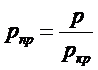 ,
,
приведенной температуры  ,
,
приведенного объема  ,
,
где Рпр, Tпр и wпр ; P, T и w; Ркр, Tкр и wкр – соответственно приведенные, абсолютные и критические параметры газа.
Критическим давлением называется такое давление, при котором и выше которого никаким повышением температуры нельзя испарить жидкость. Критическая температура – это такая температура, при которой и выше которой ни при каком повышении давления нельзя конденсировать пар.
Согласно закону соответственных состояний Ван-дер-Ваальса приведенный объем является для любых систем универсальной функцией приведенных температуры и давления. Уравнение состояния, записанное в виде j( pпр, Tпр, wпр)=0 , называется приведенным. Оно не содержит индивидуальных констант вещества. Состояния вещества, в которых они имеют одинаковые Рпр и Tпр, называются соответственными. Вещества, подчиняющиеся закону соответственных состоянии, называются термодинамически подобными.
|
|
|
Дальнейшее развитие закона соответственных состояний позволило установить критерии термодинамического подобия различных веществ. Такими критериями оказались принадлежность веществ к одному и тому же типу химических соединений, общий тип молекул, образующих эти вещества (полярные, неполярные, симметричные, несимметричные и т. п.) и равенство коэффициентов сжимаемости этих веществ в критической точке (zк).
С помощью закона соответственных состояний были построены обобщенные графики коэффициентов сжимаемости для отдельных групп термодинамически подобных веществ, в частности для углеводородных газов.
Для определения коэффициента z при данных Р и Т надо знать критические параметры данного газа, вычислить по ним Рпр и Tпр и снять с графика соответствующее им значение z (Рис.2.3.1).
Смеси газов
Природные газы представляют собой смесь газов. Главную долю этой смеси обычно составляет метан. Для проведения термодинамических и гидравлических расчетов необходимо определять свойства смеси газов по характеристике индивидуальных составляющих. Рассмотрим некоторые основные показатели смеси газов.
|
|
|
Одной из важнейших характеристик смеси является ее состав. Он задается массовыми или молярными концентрациями компонентов.
Массовой концентрацией i-го компонента смеси газов х, называется отношение количества этого компонента (газа) в единицах массы mi к количеству смеси m:
 .
.
По закону сохранения энергии материи масса смеси равна сумме масс составляющих компонентов:
 .
.
Очевидно, что
 .
.
Молярной концентрацией i-гокомпонента yi называется отношение числа киломолей компонента ni к числу киломолей смеси n:
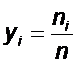 ;
;
 ;
;
где mi – масса компонента газовой смеси;
μi – молекулярная масса.
Сумма числа киломолей всех компонентов смеси газов равна числу киломолей смеси:
 .
.
Сумма молярных концентраций всех компонентов смеси газа:

Этими соотношениями задается газовая смесь.
Средняя молекулярная масса смеси mср является условной величиной. Ее часто называют кажущейся молекулярной массой смеси. Она равна отношению массы смеси к числу ее молей, по аналогии с молекулярной массой чистого вещества, для которого:
 .
.
Если массу смеси выразить через массу отдельных компонентов, получим:
|
|
|
 .
.
Таким образом, среднемолекулярная масса смеси газов равна сумме произведения относительной молекулярной массы на молярную концентрацию компонента. Если раскрыть значение числа молей, то можно получить следующее соотношение:
 .
.
Средняя молекулярная масса смеси газов выражается через массовую концентрацию и относительную молекулярную массу компонентов.
Массовые и молярные концентрации находятся в определенных соотношениях
 ,
,
отсюда

или
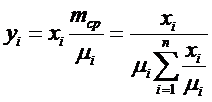
Для расчета газовой смеси надо знать величину газовой постоянной смеси Rсм , которая находится из соотношения:
 ,
,  .
.
Отсюда расчетное уравнение для определения газовой постоянной смеси будет:
 ,
,
Так как 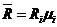 , поделив числитель и знаменатель на
, поделив числитель и знаменатель на 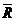 , получим:
, получим:
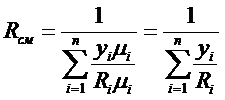 .
.
Смеси идеальных газов являются также идеальными газами.
Основным законом смеси идеальных газов является закон Дальтона, который основан на предположении, что каждый компонент ведет себя в газовой смеси так, как будто он один при температуре смеси занимает весь объем смеси; развиваемое при этом давление компонента называется парциальным.
В этом случае уравнение состояния компонента газовой смеси будет:
 .
.
Так как  , получаем:
, получаем:
 .
.
для всей смеси оно запишется в виде:

Разделив первое уравнение на второе, получим:
 .
.
Отсюда
 .
.
Парциальное давление компонента смеси равно произведению его молярной концентрации на полное давление смеси.
Закон Дальтона гласит: сумма парциальных давлений компонентов газовой смеси равна полному давлению смеси.
Действительно,
 .
.
При анализе газов обычно определяют объем каждого компонента смеси при одинаковых заданных давлении Р и температуре Т. В этом случае состав смеси задают объемными концентрациями  . Объемной концентрацией называется отношение приведенного объема данного компонента при Р и T смеси к объему всей смеси, находящейся при тех же Р и Т:
. Объемной концентрацией называется отношение приведенного объема данного компонента при Р и T смеси к объему всей смеси, находящейся при тех же Р и Т:
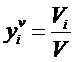 .
.
Значения Vi и V находим из уравнения состояния для компонента и смеси, записанных для одинаковых значений Р и Т.
 ,
,  .
.
После подстановки Vi и V в уравнение находим, что
 ,
,
отсюда
 ,
,
то есть для смесей идеальных газов объемная концентрация равна молярной.
Из соотношения вытекает, что для идеального газа справедливо уравнение
 ,
,
являющееся выражением закона Амага.
Таким образом, для идеального газа справедливо соотношение:
 .
.
При давлениях выше 1 МПа природные газы нельзя рассматривать как смеси идеальных газов.
Для реальных газов
 .
.
Таким образом, понятие объемной концентрации для реальных газов не имеет физического и расчетного смысла.
В расчетах, связанных со смесями реальных газов, используется уравнение состояния с коэффициентом сжимаемости:
 .
.
Обобщение данных по коэффициентам сжимаемости различных реальных газовых смесей производится с помощью закона соответственных состоянии. Однако, в отличии от чистых газов, соответственные состояния определяются не по фактическим критическим параметрам смесей, а по среднемольным критическим давлениям и температурам. Эти среднемольные свойства называются псевдокритическими давлением и температурой смеси:
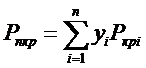 ;
;
 .
.
Значения Рпкр и Tпкр используются для вычисления приведенных параметров Рпр и Tпр смеси:
 и
и  .
.
Так как закон соответственных состояний справедлив только для отдельных групп термодинамически подобных веществ, для природных газов и для попутных нефтяных газов составлены разные обобщенные графики коэффициента сжимаемости. Они построены по данным многочисленных экспериментальных определений Р - w - Т соотношений различных газов.
Влажность газов
Газ, транспортируемый по распределительным газопроводам, может содержать некоторое количество влаги. Однако, наличие влаги в газе может привести к коррозии трубопроводов, арматуры и приборов, к образованию гидратов и концентратов. Влажный газ может быть представлен как смесь любого газа с парами любой жидкости или как газовая смесь, в которой один из газов является паром, близким к состоянию насыщения. При оценке влажного газа условно принимается, что перегретый водяной пар является идеальным газом. Поэтому к влажному газу применимы законы идеального газа.
Абсолютной влажностью газа называется количество водяного пара в единицах массы, содержащегося в единице количества газа. В связи с этим различают:
массовую абсолютную влажность d=mп/mг, где mп— количество водяного пара; mг -количество газа;
объемную абсолютную влажность dv = mп/V, где V — объем газа.
Относительной влажностью называется отношение фактически содержащегося количества водяного пара к максимально возможному при определенных условиях: j = mп/ms, где ms— максимально возможное (в единицах массы) количество пара, которое может находиться в газе при данных температуре и давлении.
Относительную влажность можно выразить следующим образом:
 ,
,
где rп – плотность пара; rs – плотность насыщенного пара.
Влажный газ называется насыщенным, когда он содержит максимально возможное количество пара при данных температуре и давлении.
Соотношения для смеси газа и водяных паров как смеси идеальных газов можно получить из уравнения состояния
 ;
;
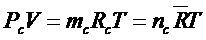 ,
,
где Рп – парциальное давление пара; тп и тс – массапара и смеси; Рс – давление смеси газа; Rn и Rс – газовая постоянная пара и смеси; R – универсальная газовая постоянная; nп и nс – число киломолей пара и смеси; Т – абсолютная температура смеси.
Парциальное давление паров
 ,
,
где уп — молярная концентрация водяного пара. Откуда Рп = Рсyп. Если считать газ и пар идеальными, то давление водяных паров можно выразить через объемную концентрацию
 .
.
Относительная влажность определяется так же, как и отношение парциального давления водяного пара Рп в газе к давлению насыщенного пара Рs при той же температуре:

Теплоемкость газов
При тепловых расчетах газопроводов необходимо знать и учитывать теплоемкость газа. Удельной теплоемкостью газа называется количество теплоты, которое необходимо сообщить единице массы (или объема) газа, чтобы температура его в данном процессе изменилась на 1°С. Теплоемкость газа зависит от характера протекаемого процесса. Наибольшее распространение в термодинамических расчетах получили теплоемкости двух простейших процессов: при постоянном давлении и при постоянном объеме. В каком-либо определенном процессе изменения состояния газа количество теплоты, необходимое для нагревания 1 кг газа на 1 К при данном давлении, зависит от абсолютной температуры газа. Количество теплоты оказывается различным при разных температурах газа. При данной температуре газа количество теплоты, необходимое для нагревания 1 кг газа на 1 К, зависит от давления. Для городских газопроводов теплоемкость газов изменяется в узких пределах, поэтому ее можно принимать постоянной.
Для идеальных газов справедливо соотношение (закон Майеpa):
 ,
,
где Сp – удельная теплоемкость при постоянном давлении; Сv – удельная теплоемкость при постоянном объеме; R — газовая постоянная. Таким образом, если известна удельная теплоемкость при постоянном давлении, можно определить теплоемкость при постоянном объеме.
Удельные теплоемкости при постоянном давлении и постоянном объеме идеальных газов являются функцией только одной температуры, т. е. зависят только от температуры. Теплоемкость газовых смесей вычисляют по правилу аддитивности
 ,
,
где yi – мольная доля компонентов в смеси.
Вязкость газов
При движении вязких жидкостей и газов наблюдаются касательные напряжения (т. е. напряжения внутреннего трения). Такое явление обусловлено молекулярной структурой газа и жидкости. Внутреннее трение газов и жидкостей характеризуется коэффициентом вязкости.
Напряжение внутреннего трения между двумя слоями прямолинейно движущегося вязкого газа согласно закону Ньютона пропорционально отнесенному к единице длины изменению скорости по нормали к направлению движения:
 ,
,
где s — напряжение внутреннего трения; m — динамический или абсолютный коэффициент вязкости; v — линейная скорость газа; п — расстояние по нормали к направлению линейной скорости газа.
Наряду с динамическим коэффициентом вязкости широко используется кинематический коэффициент вязкости n, который равен отношению динамического коэффициента вязкости m к плотности газа r:
 .
.
Динамический коэффициент вязкости определяется работой, которую необходимо произвести при относительном течении вязкого газа для единицы объемного расхода. Кинематический коэффициент вязкости определяется работой, которую необходимо совершить при относительном движении вязкого газа для единицы массового расхода.
В условиях городских распределительных газопроводов (давление не более 1,3 МПа) динамический коэффициент вязкости мало зависит от давления.
Динамический коэффициент вязкости в зависимости от температуры газа выражается по формуле Сатерленда:
 ,
,
где m – динамический коэффициент вязкости при температуре газа T; m0 – динамический коэффициент вязкости при 00С; Т – абсолютная температура газа, К; с – постоянная Сатерленда:
| Метан………………… | 162 | изо-Бутан………………… | 368 | |
| Этан…………………... | 252 | н-Пентан…………………. | 382 | |
| Пропан……………….. | 373 | Этилен……………………. | 225 | |
| н-Бутан……………….. | 377 | Пропилен………………… | 322 |
Кинематический коэффициент вязкости в зависимости от температуры и давления выразится формулой:
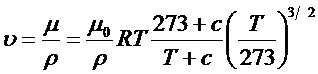 .
.
Вязкость газовых смесей идеальных газов допускается определять по формуле:
 ,
,
где yi - молярная концентрация компонентов в смеси.
Теплопроводность газов.
Теплопроводность углеводородных газов – это способность передачи теплоты между непосредственно соприкасающимися частицами тела, обусловленная движением молекул или атомов вещества:
 ,
,
где q – тепловой поток, проходящий через единицу поверхности за единицу времени; λ – коэффициент теплопроводности, характеризующий способность газов проводить теплоту; dT/dn — градиент температур.
Коэффициент теплопроводности можно найти, используя кинетическую теорию газов. По этой теории значения критерия Прандтля Рr являются функцией отношения теплоемкостей

и не зависят для данного газа от давления и температуры. Например, зная Cp, находим Cv из зависимости Cр - Cv = R, а затем, рассчитав Рr, при известной вязкости m определяем λ. Поскольку вязкость в пределах умеренного давления почти не изменяется, то и λ также мало зависит от давления. Зависимость теплопроводности от температуры получается из определения критерия Прандтля:
 .
.
Используя уравнение Сатерленда для отношения m=m0 при температурах Т и Т0, получим:
 .
.
Таким образом, при повышении температуры теплопроводность увеличивается. Часто пересчет ведут по формуле:
 ,
,
где λ – коэффициент теплопроводности при температуре Т; λ0 – коэффициент теплопроводности газа при нормальных условиях; п – постоянная, зависящая от состава газа.
Теплопроводность многокомпонентных газовых смесей можно определить на основе кинетической теории газов, используя упрощенное уравнение:

Дата добавления: 2018-05-09; просмотров: 1500; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
