Термодинамические и физические свойства газов.
Параметры состояния.
В качестве меры количества вещества принимается масса вещества в состоянии покоя.
Основными термодинамическими параметрами состояния являются удельный объем  (или мольный объем
(или мольный объем  ), абсолютное давление Р и абсолютная температура T.
), абсолютное давление Р и абсолютная температура T.
Удельным объемом называется объем единицы массы газа. Масса единицы объема называется плотностью ρ. Очевидно,
 ,
,  ,
,  ,
,
где V и m - объем и масса газа.
Относительная плотность по воздуху:

В системе СИ удельный объем  измеряется в м3/кг, а плотность - в кг/м3.
измеряется в м3/кг, а плотность - в кг/м3.
Объем кмоля газа или мольный объем  связан с удельным объемом следующим соотношением:
связан с удельным объемом следующим соотношением:
 , м3/кмоль,
, м3/кмоль,
где m - молекулярная масса газа.
Число молей вещества n:

Для характеристики состояния газов используется понятие абсолютного давления Р, которое представляет собой давление газов на стенки трубопроводов и сосудов. Абсолютное давление является параметром состояния газа.
Абсолютное давление численно равно силе F, действующей на единицу площади ¦ поверхности тела перпендикулярно к последней:

При равномерном распределении сил:

Для определения результирующих усилий, приложенных к стенкам трубопроводов, используют понятие «избыточное давление» Ризб, которое представляет собой разность между абсолютным давлением газа Р и барометрическим давлением среды Рбар: Ризб=Р-Рбар или разность между барометрическим давлением и абсолютным давлением (когда Рбар>Рабс:Рвак=Рбар-Р, где Рвак – давление, показываемое вакуумметром).
|
|
|
Избыточное давление используют для характеристики газовых приборов, измерения давления в газопроводах низкого, среднего и высокого давлений и при расчетах на прочность. В гидравлических расчетах газопроводов применяют абсолютное давление. Давление в системе СИ измеряется в паскалях: Па=н/м2.
Температура является мерой нагретости тела. Температура есть единственная функция состояния тел, определяющая направление самопроизвольного теплообмена между телами. Когда температура тел одинакова, между ними отсутствует теплообмен, и тела находятся в тепловом равновесии.
В технике для измерения температур применяется международная стоградусная температурная шкала с обозначением t°C. В этой шкале (шкала Цельсия) интервал температур от точки плавления льда до точки кипения воды при атмосферном давлении разбит на 100 равных частей - градусов.
Абсолютная температура Т измеряется по термодинамической абсолютной шкале температур, которая характеризуется тем, что ее нулевая точка представляет собой наинизшую термодинамически возможную температуру. Эта точка называется абсолютным нулем температуры. Он равен –273,16 °С. Единицей измерения абсолютной термодинамической температуры является градус Кельвина (К).
|
|
|
Между температурой по термодинамической температурной шкале, выраженной в °К, и °С имеется соотношение:
T=t+273,16.
Состояние термодинамической системы в данный момент определяется тремя параметрами: Р, w и Т.
Массовым расходом газа называется масса газа, проходящая через поперечное сечение потока в единицу времени (для стационарного режима газопровода):
 ,
,
где т – масса газа (за время t); t – время, в течение которого через данное сечение проходит газ.
Объемным расходом газа называется количество газа в единицах объема, проходящее через сечение потока в единицу времени:
 ,
,
где V — объем газа; t — время, в течение которого через рассматриваемое сечение проходит Vгаза. Заметим, что
М = Q r.
Объем и объемный расход газа относят к определенным условиям (температуре к давлению). В расчетах систем газоснабжения используют понятие объемного расхода при температуре 0°С и 101 325 Па (нормальные условия) и понятие объемного расхода газа при температуре 20 °С и давлении 101 325 Па (стандартные условия). Перерасчет объемного расхода газа Q при реальных условиях Ри Т к нормальным условиям производятся по формуле:
|
|
|
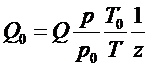 ,
,
где z - коэффициент сжимаемости.
Все расчеты систем газоснабжения согласно СНиП 42-01-2002 «Газораспределительные системы» ведутся для нормальных условий.
Линейная скорость газа определяется как объемный расход газа в условиях потока (температура, давление) через единицу поперечного сечения потока
v = Q/F,
где v — линейная скорость газа в газопроводе; Q — объемный расход газа в условиях потока (температура, давление); F — площадь поперечного сечения потока.
Законы идеальных газов
В расчетах распределительных газопроводов систем газоснабжения широко используется учение об идеальных газах. Законы идеальных газов весьма просты, однако они достаточно хорошо характеризуют поведение и свойства реальных газов для невысоких давлений и не совсем низких температур. Эти законы тем лучше описывают свойства реальных газов, чем дальше они находятся от областей насыщения и критического состояния.
Идеальными газами называются газы, у которых молекулы представляют собой материальные точки, и между молекулами отсутствуют силы взаимодействия. При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и с известным допущением могут рассматриваться как газы идеальные.
|
|
|
Законы идеальных газов были установлены в XVII – XIX столетиях исследователями, изучавшими экспериментальным путем поведение газов при давлениях, близких к атмосферному.
Закон Бойля-Мариотта. Устанавливает зависимость между давлением и удельным объемом газа при постоянной температуре:
p1/p2 = w2/w1 или p1w1 = p2w2.
Закон Бойля-Мариотта, описывающий физическое состояние идеальных газов, формулируется следующим образом: произведение абсолютного давления и удельного объема идеального газа при постоянной температуре сохраняет неизменную величину:
pw= const при t=idem.
Отметим, что idem – переменная величина, сохраняющая в рассматриваемом процессе неизменное значение; const – постоянная величина.
Закон Гей-Люссака. Определяет изменение удельного объема идеального газа в зависимости от температуры при постоянном давлении. Относительное расширение идеальных газов при нагревании под неизменным давлением (p = idem) прямо пропорционально повышению температуры:
 .
.
При t0 = 0°С, w = w0(1 +a0t), где w — удельный объем газа при температуре t и давлении Р; w0 - удельный объем газа при температуре 0°С и том же давлении Р; a0 – температурный коэффициент объемного расширения идеальных газов при 0°С, сохраняющий то же значение при всех давлениях и одинаковый для всех идеальных газов. Температурный коэффициент объемного расширения идеальных газов  .
.
При постоянном давлении все газы имеют один и тот же коэффициент расширения. При нагревании на 1°С газы расширяются при неизменном давлении примерно на 1/273 часть того объема, какой они занимают при 0°С.
Уравнение Клапейрона получается путем сопоставления законов Бойля–Мариотта и Гей–Люссака. Оно используется в виде:

или  ,
,
где R – газовая постоянная идеального газа;
T– абсолютная температура газа;
Р – абсолютное давление;
w – удельный объем газа;
r – плотность газа.
Если умножить левую часть уравнения состояния на количество газа в единицах массы (т. е. m), то получим уравнение состояния для любого количества газа:
 ,
,
где V - полный объем газа.
Газовая постоянная R - есть работа расширения единицы количества газа (1 кг) при нагревании его на 1 0С при постоянном давлении (р = idem).
3акон Авогадро. Может быть сформулирован как чисто опытный закон: объем одного киломоля идеального газа не зависит от природы газа и вполне определяется параметрами физического состояния газа (давлением и температурой):

При изучении химических реакций с участием газообразных веществ Гей-Люссак установил, что объемы вступивших в реакцию газов относятся друг к другу, а также к объемам получающихся газообразных продуктов, как простые целые числа.
Для объяснения простых отношений между объектами реагирующих газов Авогадро высказал гипотезу, которая впоследствии была подтверждена экспериментальными данными. Эта гипотеза стала называться законом Авогадро: в равных объемах различных газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул илиобъем одного киломоля идеального газа не зависит от природы газа, а определяется только параметрами его физического состояния (т.е.температурой и давлением).
Киломолем, или килограмм-молекулой, называется число килограммов вещества, равное его молекулярной массе (тm). Выражение объема 1 кмоль идеальных газов по уравнению Клапейрона

По закону Авогадро правая часть последнего выражения не зависит от природы газа. Поэтому произведение молекулярной массы тm и газовой постоянной R не зависит от природы газа и является универсальной постоянной идеальных газов: mmR = 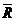 = const. Уравнение состояния для 1 кмоль идеального газа
= const. Уравнение состояния для 1 кмоль идеального газа
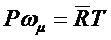 ,
,
где wm - объем 1 кмоль идеального газа (молярный объем);
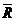 - универсальная газовая постоянная идеальных газов.
- универсальная газовая постоянная идеальных газов.
Универсальная постоянная 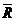 идеальных газов - есть работа расширения 1 кмоль идеального газа при нагревании на 1°С при постоянном давлении. В настоящее время принята следующая расчетная универсальная постоянная идеальных газов:
идеальных газов - есть работа расширения 1 кмоль идеального газа при нагревании на 1°С при постоянном давлении. В настоящее время принята следующая расчетная универсальная постоянная идеальных газов:  = 8314,3 Н×м/(кмоль×К) = 8,3143 кДж/(кмоль×К). Молярный объем идеальных газов при температуре t= 0°С и давлении Р = 101 325 Па (при нормальных условиях).
= 8314,3 Н×м/(кмоль×К) = 8,3143 кДж/(кмоль×К). Молярный объем идеальных газов при температуре t= 0°С и давлении Р = 101 325 Па (при нормальных условиях).

Расчетные значения удельных газовых постоянных идеальных газов определяются по универсальной газовой постоянной:

Уравнения состояния идеального газа:
для 1 кмоля 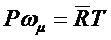 ,
,
для n кмолей  .
.
Эти уравнения называются уравнениями Клапейрона - Менделеева.
Закон Джоуля. Внутренняя энергия идеального газа зависит только от температуры и не зависит от его объема.
u=u(T);  .
.
Дата добавления: 2018-05-09; просмотров: 2388; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
