Коррозия металлов. Основные виды, их характеристика. Методы защиты металлов от коррозии.
Ме содержащие примеси, при контакте с водой на его поверхности образуются микрогальванические элементы. При этом более активный Ме разрушается, а электроны переходят к менее активному Ме, на котором идёт восстановление среды.
1)Химическая коррозия. это процесс взаимодействия Ме с коррозионной средой, при котором окисл Ме и восстан окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены.
2)Электрохимическая коррозия. процесс взаимодействия Ме с коррозионной средой (раствором эл-лита), при котором ионизация атомов Ме и восстан окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
3) Биологическая коррозия. Вызывается жизнед-ю простейших микроорганизмов, бактерий, вирусов. Поражает ту Ме поверхность,где уже имеются продукты хим коррозии. Биокоррозия усиливает хим коррозию.
При выборе покрытия надо учит ,в каких усл находится Ме. Для декор вида: Cr,Ag,Ni,Au. Если Ме в воде,то: Цинкование, смолы, резину. Различают анодное и катодное покрытие(оцинкованное Fe в кисл среде. цинк-анод,железо котод). Оксидирование-обработка поверхности Ме. Фосфорирование - проц образ на поверхности Ме защитной плёнки, сост из нераств фосфатов.
30) Электролиз-совокупность ОВР, происход при прохождении электрич. тока через электролит с погруженными в него электродами. При плавлении происх термохим-я диссоциация соли: NaCl=  Если погрузитьв распл-ую соль 2 графитовых электрода и подкл к источн тока, то в элект-де начнётся напр-ое движеие ионов и на эл-де будут протекать след реакции: I)восстан
Если погрузитьв распл-ую соль 2 графитовых электрода и подкл к источн тока, то в элект-де начнётся напр-ое движеие ионов и на эл-де будут протекать след реакции: I)восстан  до Ме Na на отриц катоде(
до Ме Na на отриц катоде(  +е->Na). II) окисление
+е->Na). II) окисление 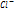 ,до газообразного хлора на «+» электроде(
,до газообразного хлора на «+» электроде( 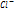 -е ->0,5
-е ->0,5  ). Суммарная реакция: NaCl=Na+0.5
). Суммарная реакция: NaCl=Na+0.5 
|
|
|
Катодные проц.:
1)If раствор соли имеет нейт среду, то воост те Ме у которых потенциал >-041В они восстан-ся.(от Fe и до конца по ряду напр)
2)от Li до Al никогда Ме не восстан.будет идти воостан воды  +2OH.
+2OH.
3)
-если раствор разбавл,то восстан вода. –если концентрированный,то Ме.
Электролиз соли с активным анодом. Анодные процессы.
Электролиз водного раствора CuSO4 с анодом из неочищенной меди. Стандартный потенциал меди Cu/Cu2+  =+0,337 В, т. е.>, чем потенциал процесса восстан молекул воды E0=–0,83 В.Поэтому при электролизе нейтр раствора CuSO4 на катоде происходит разряд ионов
=+0,337 В, т. е.>, чем потенциал процесса восстан молекул воды E0=–0,83 В.Поэтому при электролизе нейтр раствора CuSO4 на катоде происходит разряд ионов  и выделение меди.На аноде протекает противоположный процесс — окисление Сu,т к потенциал меди < потенц окисления воды,а тем более – потенциала окисления иона
и выделение меди.На аноде протекает противоположный процесс — окисление Сu,т к потенциал меди < потенц окисления воды,а тем более – потенциала окисления иона  . Т о, при электролизе CuSO4 на катоде осаждается чистая медь – происходит восстан катионов меди из раствора, а примеси остаются в растворе, и одновременно – растворение (окисление) металла анода. Этот случай электролиза применяется для очистки Ме. А(+):Cu+2e=
. Т о, при электролизе CuSO4 на катоде осаждается чистая медь – происходит восстан катионов меди из раствора, а примеси остаются в растворе, и одновременно – растворение (окисление) металла анода. Этот случай электролиза применяется для очистки Ме. А(+):Cu+2e=  K(+):
K(+):  +2e=
+2e= 
|
|
|
Аноды: а)Инертные. Не подв-ся окисл(графитные,угольные,платина)
1-если в растворе есть бескисл. анионы,то происх окисл
2-если есть кислородсодерж. анионы,то происх окисл воды 2 
б)Активные. Электрод которого подверг окислению.он сделан из Ме(Ni,Ag,Cu)
32) S-элементы, их общая характеристика. Электронное строение атомов и их свойства. Распространённость в природе.S-элементы- элементы гл подгруппы,все явл Ме (кроме Н и гелия). Ме 1а группы-щелочные,т к их оксидыпри взаимодействии с водой образуют сильные основания(МеОН). Эти Ме на внешнем слое имею 1 эл-он.легко отдают его,при этом превр-ся в однозарядный катион; (n-1)  (n-1)
(n-1)  ;сильные восстан, т к атомы легко теряют свой электрон. В природе встреч только в соединении; самые распр Na и K.Элементы 1а группы явл. Реакционно способными с Ме.
;сильные восстан, т к атомы легко теряют свой электрон. В природе встреч только в соединении; самые распр Na и K.Элементы 1а группы явл. Реакционно способными с Ме.
№ периода соот-ет числу энергетич уровней атомов, заполняемых электронами.Поэтому s-элементы имеются во всех периодах,р-элементы - во втором и последующих, d-элементы - в четвертом и последующих и f-элементы - в 6 и 7 пер-х. У элементов главн подгрупп заполн или s-подуровни, или р-подуровни внешних уровней. У элем-в побочных подгрупп заполн-ся d-подуровень 2ого снаружи уровня. Кислород явл самым распр-ым элементом в земной коре, Н – самый распр-ный элемент во Вселенной. Из каждых 100 атомов, встреч-ся во Вселенной, 90 – атомы водорода. Из-за высокой хим активности s-элем в природе в свободном виде не встреч.Важное значение имеет реакция имеет реакц взаимодействия  c
c 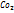 для реген-и возд в изолир помещениях.
для реген-и возд в изолир помещениях.
|
|
|
Дата добавления: 2018-05-02; просмотров: 181; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
