Составление уравнений окислительно-восстановительных реакций
Метод электронного баланса- метод нахождения коэффициентов в уравнениях ОВР, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции: KMnO4 + HCl =KCl + MnCl2 + Cl2 + H2O
2. Проставляют степени окисления над знаками элементов, которые меняются: KMn+7O4 + HCl-1 = KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем: Mn+7 + 5ē = Mn+2 ; 2Cl-1 - 2ē = Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
| Mn+7 + 5ē = Mn+2 | 2 |
| 2Cl-1 - 2ē = Cl20 | 5 |
2Mn+7 + 10Cl-1 = 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции: 2KMn+7O4 + 16HCl-1 = 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
Электрохимические процессы. Возникновение двойного эл слоя на границе металл-раствор.
Двойной элект-ий слой два весьма близких друг к другу слоя электрических зарядов разного знака, но с одинаковой поверхностной плотностью, возникающие на границе раздела двух фаз.
рассмотрим систему в которой 2 электрода находятся в растворах собственных ионов. Пример: гальванический элемент Даниэля-Якоби. Он сост из медной пластины погр в раствор CuS  ,и цинковой пластины, погр в раствор ZnS
,и цинковой пластины, погр в раствор ZnS  .Электроды отделены пористой перегородкой.на поверхности цинковой пластины возникает ДЭС и усиливается равновесие Zn ó
.Электроды отделены пористой перегородкой.на поверхности цинковой пластины возникает ДЭС и усиливается равновесие Zn ó 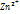 +2e. В результате возникает электродный потенциал цинка. На пов-то медной пластины возникает двойной эл-ий слой и устан равновесие Cu ↔
+2e. В результате возникает электродный потенциал цинка. На пов-то медной пластины возникает двойной эл-ий слой и устан равновесие Cu ↔  , поэтому возникает электродный потенциал меди. При соединении цинка с медью Ме проводником,электроны переходят от цинка к меди. Равновесие на Zn электроде сместится вправо,равновесие на Cu электроде сместится влево произойдёт разряд ионов меди.
, поэтому возникает электродный потенциал меди. При соединении цинка с медью Ме проводником,электроны переходят от цинка к меди. Равновесие на Zn электроде сместится вправо,равновесие на Cu электроде сместится влево произойдёт разряд ионов меди.
|
|
|
27) Электродным потенциалом электрода εэ называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода,электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают «+», если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. иногда электродный потенциал определяют как "разность потенциалов на границе электрод – раствор", т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны). Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста(здесь F – постоянная Фарадея, z – заряд иона):
|
|
|
 В уравнении Нернста ε° – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом. Стандартный электродный потенциал - это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях (298К, 101кП). Ряд стандартных электродных потенциалов служит для сравнительной характеристики свойств атомов и ионов металлов в растворе.
В уравнении Нернста ε° – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом. Стандартный электродный потенциал - это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях (298К, 101кП). Ряд стандартных электродных потенциалов служит для сравнительной характеристики свойств атомов и ионов металлов в растворе.
|
|
|
28) Гальванический элемент -химический источник электрического тока. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. В состав гальванического элемента входят два разнородных электрода (один - содержащий окислитель, другой - восстановитель), контактирующие с электролитом. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Гальванические элементы бывают солевые и щелочные. аккумуляторы-никель кадмиевые ,никель метал гидридные, свинцовые, литий ионные, литий полимерные, серебряно-цинковые. ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов.  Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов –Zn и Cu пластин,помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически :Zn / Zn2+ // Cu2+ / Cu
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов –Zn и Cu пластин,помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически :Zn / Zn2+ // Cu2+ / Cu
|
|
|
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом: Zno ––> Zn2+ + 2е- ; Сu2+ + 2е- ––> Сuo
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления – катодом. При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением: Сu2+ + Zno ––> Сuo + Zn2+
Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента. ЭДС гальванического элемента 
Дата добавления: 2018-05-02; просмотров: 180; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
