Классификация дисперсных систем
I з-н термодинамики.
Теплота, переданная системе, затрачивается на возрастание внутренней энергии и на совершение работы. Q=ΔU+A U-внутр. энергия, А–работа.
H-энтальпия (функция состояния)– это энергосодержание системы, включающее внутреннюю энергию и работу.[Дж]
Процесс расширения газа при постоянном давлении  .
.
Процесс расширения газа при изохарических условиях(постоянном объёме) 
2,3)Экзотермическая р-я  (теплота выделяется)
(теплота выделяется)
Эндотермическая р-я  (теплота поглощается)
(теплота поглощается)
Закон Гесса
Тепловой эффект х.р. не зависит от путей процесса, т.е. от числа и характера промежуточных стадий, а зависит от природы и состояния исходных веществ и продуктов реакции.
Теплота образования.  обр. – это тепловой эффект в реакции образования 1-го моль соединения из простых вещ-в в стандартных условиях.
обр. – это тепловой эффект в реакции образования 1-го моль соединения из простых вещ-в в стандартных условиях.
Теплота сгорания.  сг. – это тепловой эффект в реакции сжигания 1-го моль вещ-ва до простых продуктов в стандартных условиях.
сг. – это тепловой эффект в реакции сжигания 1-го моль вещ-ва до простых продуктов в стандартных условиях.
Следствия закона Гесса
1) 
2) 
3) 
 простых веществ=0
простых веществ=0
II з-н термодинамики.
Теплота самопроизвольно не может переходить от холодного тела к горячему.
Энтропия(S) – мера беспорядка
S растёт:
1) При расширении гозов
2) При повышении 
3) В ходе хим. взаимодействия, идущего с 
S рассчитывается:
1) По определению Клаузиса
2) По закону Гесса 
В самопроизвольном процессе 
В равновесии 
В несамопроизвольном 
G – энергия Гиббса
|
|
|

𝛥 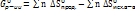
В самопроизвольном процессе 
В равновесии 
В несамопроизвольном 
6) Скорость хр. – изменение концентрации реагир. веществ в еденицу времени [моль/л]

Скорость зависит от:
1) Природы реагир. веществ
2) Концентрации реагир. веществ (если концентрации реагир. веществ =1, то k(константа скорости р-ии) = скорости х.р.)
3) t
4) присутствия катализатора
Закон действующих масс (ЗДМ)
Зависимость между V и С (концентрацией): скорость х.р. при постоянной t прямопропорциональна произведению С реагир. веществ возведения в степень их стехиометрических коэффициентов.
7) Влияние t на скорость х.р.
Правило Вант-Гофа:
При увеличении t на каждые 10⁰С скорость увеличивается в 2-4 раза 
 – нач. скорость
– нач. скорость
 – скорость реакции
– скорость реакции
 - температурный коэффициент
- температурный коэффициент
Энергия активации
Взаимодействие происходит между теми молекулами, которые обладают избыточной энергией, т.е. энергией активации. Молекулы облад. такой энергией наз-ся активные. 
Активированный комплекс – это неустойчивое соединение, состоящее из 4х атомов, где старые связи уже ослаблены и начинают образоваться новые в молекуле А-В
Расстояние между атомами > чем в исходных молекулах, поэтому комплекс обладает повышенной энергией, т.е. энергией активации (время сущ-я 10-13сек.), а его распад приводит к образованию продуктов реакции.
|
|
|
Скорость реакции зависит от числа активных молекул. При повышении t увеличивается число активных молекул и растёт скорость реакции.
8)Катализ – это изменение скорости реакции под влиянием катализаторов, к-рые остаются неизменными по количеству и хим. составу.
Стадии: 1) А+К=АК (промежут. соединение); 2) АК+В=АВ+К (К-регенирируется)
Каждая из стадий катализа идёт с меншей ЕА, скорость увеличивается.
Ингибитор – катализатор, для уменьшения скорости. Антиоксидант – ингибитор, замедляющий окисление.
Катализ бывает гомогенный и гетерогенный. Гомогенный К –катализатор и реагир. Вещ-ва нах-ся в одной фазе и процесс идёт по всему объёму. (SO2(г)+1/2О2(г)=SO3(г)). Стадии: 1)NO+1/2O2=NO2; 2)NO2+SO2=SO3+NO. Гетерогенный К – катализатор и реагенты находятся в разных фазах, процесс идёт на пов-ти катализатора. CO(г)+3Н2(г)=Ni=CH4(г)+Н2О(г)
9) Равновесие в системе устанавливается при определённых значениях С, t, Р, изменить параметры значит вывести из состояния равновесия.
Принцип Ле-Шателье
Если находящаяся в равновесии система подвергается внешнему воздействию, то равновесие смещается в направлении, которое способствует ослаблению данного воздействия
|
|
|
Или иначе: на любое воздействие система отвечает противодействием.
N2(г)+3Н2(г)↔2NH3(г), ΔН<0
1) При увеличении концентрации исходящих веществ (H2 и N2) равновесие смещается в сторону прямой реакции и наоборот (уменьшается – в сторону обратной)
2) При > t равновесие смещается в сторону эндотермической реакции (ΔН<0 – обратной, ΔН>0 – прямой)
3) При > P равновесие смещается в сторону < объёма
10) Если в каком либо вещ-ве распределено в виде очень мелких частиц другое вещ-во, то этодисперсная система. Раствор – это однородная, гомогенная система, состоящая как минимум из 2х компонентов.
Различают: дисперсную фазу (распределяемое вещ-во), дисперсную среду.
Классификация дисперсных систем
1) По фазовому состоянию (Г/Г, Ж/Г, Т/Г, Г/Ж, Ж/Ж, Т/Ж, Г/Т, Ж/Т, Т/Т)
2) В зависимости от размера частиц д.ф (грубодисперсные, тонкодисперсные, молекулярно-дисперсные)
Раствор занимает промежуточное положение между механической смесью и химическим соединением, т.к. при смешивании изменяется объём, идёт выделение или поглощение энергии, во многих р-рах обр-ся сольваты (либо гидраты), но при образовании раствора е соблюдается закон эквивалентов.
|
|
|
Концентрация - это содержание растворённого вещ-ва в единице массы или объёма р-ра или раствориеля. Концентрации бывают:
1) Массовая доля (процентная) ω=m1/m∙100%
m1 – масса растворённого вещ-ва [г]
m – масса раствора [г], m=V∙ρ
2) Молярная концентрация (молярность) – сколько растворённого вещ-ва содержится в литре раствора. Сm=n/V=m1/M∙V
n – кол-во вещ-ва
М – молярная масса [г/моль]
V – объём [л]
3) Молярная концентрация эквивалента – показ. кол-во эквивалентов растворённого вещ-ва, содерж. в 1 л р-ра [моль/л] СН=m1/MЭ∙V
MЭ – моляр. масса эквивалента р-ного вещ-ва [г/моль]
MЭ для кислот =MK ; MЭ для оснований = числу гидроксильных групп; MЭ для солей = МС
4) Молярная концентрация – кол-во растворённого вещ-ва сост. в 1 кг растворителя [моль/кг] Cm =n/m, где m – масса р-рителя, n – кол-во растворённого вещ-ва [моль]
11) Неэлектролиты – р-ры, непроводящие электр. ток.
Чем больше концентрация раствора, т.е. меньше молекул растворителя, то меньше P насыщенного пара. Р1 = k1∙N1
I закон Рауля
Давление насыщенного пара над раствором = его давлению над чистым растворителем умноженное на мольную долю растворителя. P1 = P0∙N1
P1 – давление насыщ. пара над раствором
Р0 – давление насыщ. пара над чистым растворителем
N1 – мольная доля растворителя
N2 – мольная доля растворённого вещ-ва
t кипения раствора выше t кипения чистого вещ-ва, t замерзания раствора ниже, чем t замерзания чистого растворителя.
II закон Рауля
Повышение t кипения и понижение t замерзания прямо пропорциональны молярной концентрации раствора.
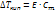 ;
;  где
где  ;
; 
Сm – молярн. концентрация [моль/кг]
Е – эбуллиоскопич. постоянная
К – приоскопич. Постоянная

12) Осмос – это односторонняя диффузия, возникающая в р-рах при наличии полупроникаемой перегородки, которая пропускает молекулы р-ля, но не пропускает молекулы растворённого вещества. Осмотическое давление Р=СRT, где С-концентрация, Т-температура р-ра, R-универсальная газовая постоянная. Схема осмоса: где а-сахарный раствор, b-вода
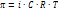
i – изотонический коэффициент раствора
13) Растворы электролитов. Степень и константа электрической диссоциации.
Электоролиты – растворы, которые проводят электрический ток.
Электролитическая диссоциация – это распад молекул, растворённых электролитов на ионы под действием молекул растворителя.
Диссоиация проходит в 3 этапа:
1) Гидротация. При растворении электролита диполи воды окружают молекулы растворённого вещества.
2) Ионизация. Полярные молекулы растворённого вещества становятся ионами.
3) Диссоциация
Сущность современной теории эл. дисс.
1) Электролиты диссоциируют на ионы: катионы+, анионы-.
2) При растворении образуются гидротир. ионы
3) Диссоциация – обратимый процесс, с распадом на ионы, протекающий с соединением ионов.

 (альфа) – степерь диссоциации
(альфа) – степерь диссоциации
Электролиты бывают 1) слабые <3% (H2S,NH4OH,CH3COOH); 2) сильные >30% (HCl,HNO3,NaOH)
Константа диссоциации(=конст. равновесия)CH3COOH  CH3COO- +H+
CH3COO- +H+

14) С помощью теории электролитической диссоциации дают определения кислот, оснований и солей. Кислоты - электролиты, при диссоциации которых в качестве катионов образуются только катионы Н:Н3РО4  Н++Н2РО-4(1 ступень);Н2РО-4
Н++Н2РО-4(1 ступень);Н2РО-4  Н+ +НРO2-4 (2 ступень);НРО2-4
Н+ +НРO2-4 (2 ступень);НРО2-4  Н+ PОЗ-4 (3 ступень). Основания - электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например: KOH
Н+ PОЗ-4 (3 ступень). Основания - электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. Например: KOH  K+ + OH; NH4OH
K+ + OH; NH4OH  NH+4 + OH- . Щелочи-основания, растворимые в воде. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН и Са(ОН)2, Ва(ОН)2, а также NН4ОН. Большинство оснований в воде малораствор. Кислотность оснований определяется числом его гидроксогрупп. Например Са(ОН)2 - двухкислотное,Fе(ОН)3 – трехкислотное. Амфотерныеэлектролиты – которые при диссоциации одновременно образуют катионы Н, и гидроксидионы. К ним относятся: вода, гидроксиды цинка, хрома и ряд других веществ. Н2O
NH+4 + OH- . Щелочи-основания, растворимые в воде. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН и Са(ОН)2, Ва(ОН)2, а также NН4ОН. Большинство оснований в воде малораствор. Кислотность оснований определяется числом его гидроксогрупп. Например Са(ОН)2 - двухкислотное,Fе(ОН)3 – трехкислотное. Амфотерныеэлектролиты – которые при диссоциации одновременно образуют катионы Н, и гидроксидионы. К ним относятся: вода, гидроксиды цинка, хрома и ряд других веществ. Н2O  Н+ + ОН-. Соли - электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония ( NH+4) и анионы кислотных остатков. Например: (NH4)2SO4
Н+ + ОН-. Соли - электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония ( NH+4) и анионы кислотных остатков. Например: (NH4)2SO4  2NH+4 + SO2-4; Na3PO4
2NH+4 + SO2-4; Na3PO4  3Na+ + PO3-4
3Na+ + PO3-4
Основность кислоты определяется числом катионов водорода. Так, НCl, HNO3-одноосновные кислоты образуется 1 катион водорода; Н2S, Н2SO4 – двухосновные. Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим
 Для очень слабых электролитов при α < 1 это уравнение упрощается:
Для очень слабых электролитов при α < 1 это уравнение упрощается: 
 Это соотношение называют законом разбавления Оствальда.
Это соотношение называют законом разбавления Оствальда.
15) Ио́нное произведение воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах. Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует H2O ↔ H+ + OH−. Константу диссоциации воды можно вычислить по формуле:  . C повышением t диссоциация воды увеличивается, следовательно, растёт K, при понижении t — наоборот.
. C повышением t диссоциация воды увеличивается, следовательно, растёт K, при понижении t — наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+] > 10-7 моль/л, в нейтральных [Н+] = 10-7 моль/л, в щелочных [Н+] < 10-7 моль/л.
Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным ателем и обозначая ее рН: pН = -lg[Н+].
В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных pH > 7.
16) Гидролиз солей– взаимодействие ионов соли с НОН, приводящее к образованию молекул слабого электролита. Различают 4 варианта гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания: (K2SiO3, Na2CO3)
Na2CO3 + НОH = NaHCO3 + NaOH ; CO32− + H2O = HCO3− + OH−
(раствор имеет щелочн реакцию, реакция протекает обратимо, рН > 7)
2. Гидролиз соли сильной кислоты и слабого основания(нерастворимы): (FeCl2, Al2(SO4)3, Mg (NO3 )2 )
CuCl2 + НОH = CuOHCl + HCl ; Cu2+ + Н2О = CuOH+ + Н+
(раствор имеет кислую реакцию, реакция обратимая рН раствора < 7)
3. Гидролиз соли слабой кислоты и слабого основания:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S ; 2Al3+ + 3S2− + 6Н2О = 2Al(OH)3(  ) + ЗН2S(
) + ЗН2S(  )
)
(Гидролиз в этом случае протекает практически полностью, так как 2 продукта гидролиза уходят из сферы реакции в виде осадка или газа).
4. Соль сильной кислоты и сильного основания(KBr, NaCl, NaNO3) не подвергается гидролизу, и раствор нейтрален.
Степень гидролиза - отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hГИДР); α = (cГИДР/cОБЩ)·100 %
где cГИДР — число молей гидролизованной соли, cОБЩ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Влияние условий на степень полноты гидролиза. Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то в соответствии с законом действующих масс можно сместить это равновесие за счет введения в раствор кислоты или основания. Прибавление кислоты вызывает усиление гидролиза по аниону; гидролиз по катиону усиливается в присутствии щелочи. Если к раствору добавить кислоту, гидролиз усилится. Если добавить основание, равновесие сместится влево – гидролиз подавлен.
17) Поверхностные явления— совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз. Самопроизвольные поверхностные явления происходят вследствие уменьшения поверхностной энергии системы. К поверхностным явлениям, связанным с уменьшением общей пов-сти, относят: 1) капиллярные явления. 2)Коалесценция - слияние капель в эмульсиях при их непосредств. контакте. 3) Спекание мелких твердых частиц в порошках. 4) Изотермич. перегонка - увеличение объема крупных капель за счет уменьшения мелких. Самопроизвольные поверхностные явления, в к-рых изменяется поверхностное натяжение: 1) Коагуляция-слипание мелких твердых частиц в золях, суспензиях в крупные агрегаты с послед. разрушением системы и образованием коагуляц. осадков разл. структуры.3) Адгезия - прилипание жидкости к тверд. телу вследствие понижения своб. поверхностной энергии. 4) Адсорбция-увеличен концентрац в-ва на границе раздела фаз.
Сорбция - поглощение твердым телом или жидкостью какого-либо вещества из окружающей среды.Виды: Абсорбция - объёмное слияние двух веществ, находящихся в разных агрегатных состояниях(напр. жидкости, абсорбирующиеся твёрдыми телами или газами, газы, абсорбирующиеся жидкостями и т.д.).Процесс поглощения, идет по всему объему сорбента; Адсорбция - физическое сцепление ионов и молекул на поверхности тела другого состояния (напр. реагенты адсорбируются к целой поверхности катализатора); Хемосорбция— поглощение одного вещества др. в результате обратимой хим. реакции. Поглощение сопровождается хим.взаимодействием.
18) Адсорбция на границе жидкий раствор-газ. Этот вид адсорбции заключается в том, что растворенное в жидкости в-во концентрируется на пов-ти жидкого раствора на границе с газом.Особенности таких систем:поверхность жидкости однородна, а следовательно, равноценна для адсорбции;молекулы адсорбтива (растворенного в-ва) могут свободно передвигаться по пов-ти жидкости под действием теплового движения, т.е. они не закреплены жестко с каким-то одним участком пов-ти;можно пренебречь силовым полем газовой фазы, так как силы взаимодействия в газе пренебрежимо малы.
Уравнение адсорбции Гиббса. Процесс адсорбции обусловлен снижением поверхностного натяжения. Очевидно, чем в большей степени ПАВ(Поверхностно-активные вещества) снижает поверхностное натяжение, тем большей должна быть его адсорбция. Дж. Гиббс вывел важное уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:  C- молярная концентрация в растворе, Т - температура, при которой происходит адсорбция, R - газовая постоянная(=8,31
C- молярная концентрация в растворе, Т - температура, при которой происходит адсорбция, R - газовая постоянная(=8,31  107Дж/моль
107Дж/моль  К),
К),  - изменение поверхностного натяжения раствора при изменении концентрации.
- изменение поверхностного натяжения раствора при изменении концентрации.
19) Адсорбция газов твердыми адсорбентами. На поверхности твердых тел при их контакте с газом происходит «+» адсорбция, т.е. в условиях равновесия концентрация газа на пов-ти выше, чем в объеме системы. Особенности: 1. Адсорбция происходит не на всей пов-ти, а лишь на активных центрах.2. Адсорбция кинетически обратима - наряду с адсорбцией газа происходит его десорбция. Адсорбционное равновесие устанавливается очень быстро. Молекула газа считается адсорбированной, если она находится в поверхностном слое в течение определенного времени.Величина адсорбции газа на твердом адсорбенте зависит от: t; концентрации (равновесного давления) газа в поверхностн слое; природы твердого тела; природы газа.
Адсорбция растворенных в-в твердыми адсорбентами-самопроизвольное концентрирование растворенного в-ва вблизи пов-ти твердого адсорбента.При рассмотрении адсорбции газов и паров на твердом адсорбенте исходят из того, что в начальный момент пов-ть адсорбента свободна, а затем по мере увеличения давления газа постепенно заполняется адсорбтивом. При адсорбции из раствора пов-ть адсорбента всегда полностью занята молекулами растворителя и растворенного вещества. Растворенное вещество может адсорбироваться, только вытесняя с пов-ти молекулы растворителя.
Зависимость адсорбции от концентрации адсорбата может иметь разную форму. Наиболее часто для описания процессов используют уравнение Лэнгмюра  и Фрейндлиха
и Фрейндлиха  , где
, где  ,моль/г;
,моль/г;  - константа адсорбционного равновесия;
- константа адсорбционного равновесия;  -концентрация растворенного в-ва,моль/дм3; Кф и n-константы, зависящие от природы растворенного в-ва и t.
-концентрация растворенного в-ва,моль/дм3; Кф и n-константы, зависящие от природы растворенного в-ва и t.
20) Дисперсная система (ДС) — это смесь из двух или более веществ, которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Все ДС состоят из сплошной фазы- дисперсионной среды, и прерывистой фазы(частиц)-дисперсной фазы Системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, а с неодинаковыми по размеру частицами — полидисперсными. Как правило, окружающие нас реальные системы полидисперсны.. В зависимости от размера частиц ДС делят на:1.Взвеси(суспензии, эмульсии),размер частиц 1000нм;2.Коллоидные системы(золи), размер частиц от 1 до 500 нм. В зависимости от природы дисперсионной среды, золи подразделяют на твёрдые золи,аэрозоли(золи с газообразной дисперсионной средой) и лиозоли (золи с жидкой дисперсионной средой).Основные виды золей: дым (взвесь твёрдых частиц в газе), туман (взвесь жидких частиц в газе), суспензия (взвесь твёрдых частиц в жидкости), эмульсия (раствор жидкости в жидкости), пена (раствор газа в жидкости или твёрдом теле), гель (раствор жидкости в твёрдом теле), сплав (раствор твёрдого тела в твёрдом теле). Коллоидные системы, состоящие из частиц диспергированного вещества, способных свободно перемещаться в жидкой дисперсионной среде совместно с адсорбированными на их поверхности молекулами или ионами 3 компонента (стабилизатора), называют лиозолями.
21) Коллоидные растворы могут быть получены либо путем конденсации молекул и ионов истинных растворов, либо дальнейшим раздроблением частиц дисперсной фазы грубодисперсных систем. Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования. Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов – в-в, препятствующих процессу самопроизвольного укрупнения коллоидных частиц. Дисперсионные методыоснованы на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Коллоидные растворы можно получать также и методом хим. конденсации, основанном на проведении химических реакций, сопровождающихся образованием нерастворимых или малорастворимых в-в. Золи могут быть получены также в результате реакций ионного обмена, в результате которых выделяется нерастворимая соль, образующая при определенных условиях коллоидный раствор.
22) Строение мицеллы :
FeCl3+3NaOH= Fe(OH)3  +3NaCl
+3NaCl
{[mFe(OH)3] · n Fe3+· 3(n-x) Cl-}3+ · 3x Cl-
ядро ПОИ противоионыдиффузн.слой
адсорбцирнный слой
Основой мицеллы является нерастворимое в-во. На пов-ти агрегата адсорбируются потенциалопределяющие ионы (ПОИ). Далее находится адсорбционный слой ионов, заряженных противоположно потенциалопределяющим ионам – плотный слой противоионов. Ядро коллоидной частицы вместе с адсорбционным слоем противоионов называется гранулой. Далее следует диффузный слой противоионов, имеющий размытое пространственное строение. Мицелла в целом электронейтральна.
23) Под устойчивостью коллоидной системы понимают постоянство во времени ее состояния и основных свойств: дисперсности, равномерного распределения частиц дисперсной фазы в объеме дисперсионной среды и характера взаимодействия между частицами. Виды устойчивости дисперсных систем: кинетическая и агрегативная. Кинетическая устойчивость позволяет системе сохранять равномерное распределение частиц в объеме. Основными условиями этой устойчивости являются высокая дисперсность и участие частиц дисперсной фазы в броуновском движении. Агрегативная устойчивость – это устойчивость по отношению к слипанию частичек коллоидной системы в более крупные агрегаты. При нарушении агрегативной устойчивости происходит коагуляция. Коагуляция-процесс слипания частиц с образованием крупных агрегатов. В результате коагуляции система теряет свою кинетическую устойчивость, так как частицы становятся слишком крупными и не могут участвовать в броуновском движении, выражается в образовании осадка. Причины коагуляции: изменение t; действие электрического поля; механическое воздействие; добавление электролитов.
Коагуляция начинается при определенной концентрации электролита в растворе, которая называется порогом коагуляции. Порог коагуляции – минимальное количество электролита. Является относительной характеристикой устойчивости золя по отношению к данному электролиту. Чем выше заряд иона, тем ниже порог коагуляции и тем меньше нужно электролита для коагуляции. Порог коагуляции зависит от природы дисперсной фазы, концентрации ее в коллоидной системе, скорости прибавления электролита, интенсивности перемешивания, присутствия других веществ и др.
24) Окислительно-восстановительные реакции. Любая ОВР состоит из процессов окисления и восстановления. Окисление- отдача электроном в-вом, т.е повышение степени окисления элемента. (Zn0-2e=Zn2+).Восстановители- в-ва ,отдающие свои электроны в процессе реакции(Zn0). Восстановление- смещение электронов к веществу или понижение степени окисления элемента.(Cu2++2e=Cu0).Окислитель- в-во, принимающее электроны (Cu2+). Окисление и восстановление взаимосвязаны. В ходе ОВР восстановитель отдает свои электроны окислителю. Межмолекулярные реакции- реакции, в которых окислители и восстановители собой различные в-ва. (Н2S + Cl2 → S + 2HCl). Внутримолекулярные в-ва- реакции, в которых окис-ли и восст-ли атомы одной и той же молекулы. (NH4NO3 → N2O + 2H2O).
Степень окисления — вспомогательная условная величина для записи процессов окисления, восстановления и ОВР, численная величина электрического заряда, приписываемого атому в молекуле. Степень окисления соответствует заряду иона или формальному заряду атома в молекуле :Na+1Cl-1,С+2О-2. Алгебраическая сумма степеней окисления атомов в молекуле всегда равна нулю. Степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи в молекуле.
25) Восстановители - в-ва ,отдающие свои электроны в процессе реакции окисления. Окислитель - вещество, принимающее электроны в реакции восстановления. Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Важнейшие окислители: галогены, MnO2; азотная к-та (HNO3); серная к-та (H2SO4) концентрир.; оксид меди(II) (CuO); оксид свинца(IV) (PbO2); Ag2O; пероксид Н (H2O2); (FeCl3); анод при электролизе. Важнейшие восстановители: Ме; Н; уголь; сероводород (H2S);оксид серы (IV) (SO2);сернистая к-та H2SO3 и ее соли; азотистая к- та HNO2;аммиак NH3; (NO);катод при электролизе.
Дата добавления: 2018-05-02; просмотров: 181; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
