Задача. Вычисление массовой доли элемента в соединении, формула которого приведена.
Вычислите массовую долю железа в оксиде железа (III).
Массовой долей элемента в соединении называют отношение атомной массы элемента в соединении (с учётом всех атомов) к относительной молекулярной массе соединения.
Относительная молекулярная масса оксида железа (III) будет равна:
Мr (Fe2O3) = 2∙ 56 + 3∙ 16 = 160
Тогда,
W (Fe) = 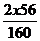 = 0, 7 = 70%
= 0, 7 = 70%
Ответ: массовая доля железа в оксиде железа(III) ровна 70%.
Билет №11
Опыт. Выделение поваренной соли из ее смеси с речным песком.
Поваренная соль - хлорид натрия – хорошо растворима в воде, а речной песок в воде не растворим. Эти вещества не взаимодействуют друг с другом, поэтому при добавлении воды к данной смеси поваренная соль растворяется в воде, а песок оседает на дно. Для полного отделения песка от раствора прибегают к фильтрованию – раствор пропускают через пористую фильтрованную бумагу, которая задерживает частицы песка. Раствор поваренной соли выпаривают – удаляют воду. Остаются белые кристаллы поваренной соли – получили чистую поваренную соль.
Билет №12
Опыт. Получение собирания водорода. Доказательство наличия водорода в пробирке.
Водород – бесцветный газ, без вкуса и запаха, мало растворим в воде. Это самый лёгкий газ.
В лаборатории водород получают действием на цинк раствором соляной кислоты. Происходит реакция
Zn + 2HCI = ZnCI2 + H2↑
Выделяющийся газ собирают методом вытеснения воздуха в сосуд, расположенный вверх дном.
|
|
|
Водород горючий газ, с воздухом он образует взрывчатые смеси. Обращаться с водородом нужно очень осторожно.
Для определения наличия водорода горящую лучинку преподносят к отверстию пробирки, громко лающий звук означает, что в пробирке был не чистый водород, а его смесь с воздухом. Тихий едва слышный хлопок означает, что водород чистый. При этом протекает реакция:
2 H2 + O2 = 2 H2O
Билет №13
Задача. Вычисление массы исходного вещества, если известно количество вещества одного из продуктов реакции.
Вычислите массу фосфора, необходимую для получения трех моль оксида фосфора (V).
Запишем уравнение реакции:
4P + 5O2 = 2P2O5
Для получения двух моль оксида фосфора требуется четыре моль фосфора, значить для получения трёх моль оксида необходимо взять фосфор количеством 6 моль. Найдём массу этого количества фосфора:
M = √ (P) ∙ M (P) = 6∙ 31 = 186г
Ответ: 186 г фосфора
Билет №14
Задача. Вычисление количества вещества (или объема) газа, необходимого для реакции с определенным количеством вещества (или объемом) другого газа.
Какой объём водорода теоретически должен вступить в реакцию с 5 моль азота, если предположить, что выход продукта 100%.
|
|
|
Запишем уравнение реакции:
3H2 + N2 = 2 NH3
Из него следует, что 3 моль водорода реагирует с одним моль азота.
Следовательно, с 5 моль азота в реакцию должно вступить в три раза больше водорода, то есть 15 моль.
Ответ: 15 моль водорода.
Билет №15
Опыт. Распознавание соли угольной кислоты среди трех предложенных солей.
Соли угольной кислоты – карбонаты и гидрокарбонаты – при действии на них более сильных кислот разлагаются с выделением углекислого газа.
CaCO3 + 2HCI = CaCI2 + H2О + CO2↑
Выделяющийся углекислый газ не поддерживает горение, при опускании в сосуд с углекислым газом горящая лучинка тухнет.
При пропускании углекислого газа через прозрачный раствор известковой воды происходит её помутнение, реакция имеет вид
Ca (OH)2 + CO2 = Ca CO3 ↓+ H2O
В осадок выпадает карбонат кальция.
Билет №16
Опыт. Проведение реакций, подтверждающих свойства гидроксида кальция.
Гидроксид кальция или гашеная известь, представляет белый порошок, мало растворимый в воде. Насыщенный водный раствор гидроксида кальция называют известковой водой. Гидроксид кальция – щелочь, поэтому в водном растворе присутствует в форме ионов Ca2+ и OH-.
|
|
|
Известковая вода меняет окраску индикатора, капли бесцветного раствора фенолфталеина она окрашивает в малиновый цвет.
Известковая вода мутнеет при действии углекислого газа:
Ca (OH)2 + CO2 = Ca CO3 ↓+ H2O
Это вызвано образованием белого осадка карбоната кальция.
Кислоты нейтрализуют известковую воду, при предварительном внесении в раствор фенолфталеина, в результате реакции окраска исчезнет.
Ca (OH)2 + 2HCI = CaCI2 + 2H2O
При кипячении гидроксида кальция с раствором соды выпадает осадок
Ca (OH)2 + Na2CO3 = CaCO3 ↓+ 2NaOH
Билет №17
Дата добавления: 2018-05-02; просмотров: 561; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
