Задача. Вычисление объема полученного газа, если известна масса исходного вещества.
Найти объём газа, выделяющегося при действии соляной кислоты на 5,4 г алюминия.
Для решения задачи запишем уравнение реакции
2AI + 6 HCI = 2AICI3 + 3H2↑
Для ответа на вопрос задачи нужно рассчитать количество вещества исходного соединения, разделив его массу (данную в условии) на молярную массу
√ = 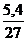 =0,2 моль
=0,2 моль
Из коэффициентов в уравнении реакции следует, что два моль алюминия выделяют из соляной кислоты 3 моль водорода, следовательно, 0,2 моль алюминия способны выделить 0,3 моль водорода. Рассчитаем объем водорода, для этого умножим количество вещества на молярный объем идеального газа ( при нормальный условиях Vm равен 22,4 л):
V = √∙Vm = 22, 4 ∙ 0, 3 = 6,72 л
Ответ: 6, 72 л водорода.
Билет №6
Опыт. Получение и собирание аммиака.
Аммиак NH3 – бесцветный газ с характерным резким запахом, легче воздуха, прекрасно растворим в воде (в одном объёме воды растворяется примерно 700 объёмов аммиака).
Для получения аммиака в лаборатории смешивают в ступке порошок хлорида аммония NH4CI с гидроксидом кальция Ca (OH)2, хорошо перемешивают и насыпают в пробирку. Пробирку устанавливают горизонтально, закрывают пробкой с газоотводной трубкой, другой конец которой вставляют в сосуд расположенный вверх дном. Проверив прибор на герметичность, начинают нагрев. Постепенно идёт химическая реакция
|
|
|
Ca (OH)2 + 2NH4CI = CaCI2 + 2NH3↑ + 2H2O
О наличии аммиака в сосуде можно судить по появлению окраски фильтровальной бумаге, смоченной раствором фенолфталеина, которую преподносят к отверстию сосуда с аммиаком, появляется характерная малиновая окраска.
Билет №7
Задача. Вычисление количества вещества (или объема) газа, необходимого для реакции с определенным количеством вещества (или объемом) другого газа.
Какой объём водорода вступает в реакцию с 0,5 моль азота, если предположить, что синтез аммиака протекает при 100% выходе.
Запишем уравнение реакции:
3H2 + N2 = 2NH3
Из уравнения следует, что 3 моль водорода реагируют с 1 моль азота. Следовательно, с 5 моль азота в реакцию теоретически должно вступить в три раза больше водорода, то есть 15 моль.
Билет №8
Опыт. Проведение реакций, подтверждающих качественный состав предложенной соли, например, сульфата меди (II).
Для подтверждения качественного состава соли, нужно провести качественные реакции на катион и анион, входящие в её состав. Сульфат меди(II) – соль образована катионами меди и сульфат – ионами.
Для определения иона меди к раствору соли добавляют раствор щелочи, например, гидроксид натрия, выпадает синий осадок гидроксида меди(II).
|
|
|
Сu SO4 + 2 Na OH = Cu (OH)2 ↓ + Na2SO4
Cu2+ + 2 OH- = Cu (OH)2 ↓
Реагентом на сульфат – ион служат растворимые соли бария, которые с сульфат – ионами образуют белый кристаллический осадок сульфата бария, нерастворимый в кислотах.
CuSO4 + BaCI2 = BaSO4 ↓ + 2 NaCI
Ba2+ + SO 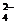 = BaSO4 ↓
= BaSO4 ↓
Билет №9
Задача. Вычисление массы продукта реакции, если для его получения взят раствор с определенной массовой долей исходного вещества.
Вычислите массу осадка карбоната кальция, который образуется при действии на 200г 5%- ного раствора хлорида кальция избытком раствора карбоната натрия.
Сначала найдём массу хлорида кальция, который содержится в 200 г 5% - ного раствора:
M (CaCI2) = W∙m (раствора) = 0, 05 ∙ 200 = 10г
Найдём количество вещества хлорида кальция. Для этого разделим его массу на молярную массу:
√ =  =
=  =0. 09 моль
=0. 09 моль
Запишем уравнение реакции:
Ca CI2 + Na2CO3 = Ca CO3 + 2 Na CI
Из одного моля хлорида кальция образуется один моль карбоната кальция, значит из 0, 09 моль хлорида кальция образуется 0, 09 моль карбоната кальция.
Найдём массу карбоната кальция:
M (Ca CO3) = √ (Ca CO3) ∙M (Ca CO3) = 0, 09∙ 100 = 9г
|
|
|
Ответ: 9г карбоната кальция.
Билет №10
Дата добавления: 2018-05-02; просмотров: 1196; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
