Опыт. Проведение реакций, подтверждающих химические свойства
Хлороводородной кислоты.
Хлороводородная (соляная) кислота - это водный раствор газа хлороводорода. Это сильная одноосновная кислота, полностью диссоциированная на ионы водорода и хлорид - ионы:
H Cl →H+ + Cl-
Подобно другим кислотам, соляная кислота проявляет все реакции, характерные для ионов водорода, т.е. окрашивает растворы индикаторов (лакмуса – в красный цвет метилоранжа – в красный цвет), реагирует:
1) с активными металлами Mg + 2H Cl = Mg Cl2 + H2↑
в ионном виде: Mg + 2Н+= Mg2+ + H2↑
2) с основными оксидами, Cu O + 2H Cl = Cu Cl2 + H2O,
в ионном виде: Cu O + 2Н+= Сu2+ + H2O
3) с основаниями KOH + H Cl = K Cl + H2O
в ионном виде: OH- + H+ = H2O
4) с солями Na2CO3 + 2HCl =2 Na Cl + H2O
в ионном виде: CO 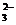 +2H+ = CO2↑+ H2O
+2H+ = CO2↑+ H2O 
Особенностью соляной кислоты, отличающей ее от других сильных кислот,
является ее способность реагировать с солями серебра с образованием белого творожистого осадка хлорида, нерастворимого в кислотах.
AgNO3 + HCL = Ag CI ↓ + HNO3
Билет №2
Задача. Вычислите массовую долю хлорида натрия в растворе, при растворении 2г поваренной соли в 198г воды.
Рассчитываем массу раствора: m раствора = m (растворенного вещества) + m (воды) = 198 + 2 = 200г
Находим массовую долю растворённого вещества:
W = 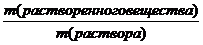 =
=  = 0, 01 = 1%
= 0, 01 = 1%
Ответ: массовая доля поваренной соли составляет 1%
Билет №3
Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
|
|
|
Найдите количество вещества серебра, которое образуется при разложении нитрата серебра массой 1,7 г.
Для решения задачи запишем уравнение реакции и расставим коэффициенты:
2 Ag NO3 = 2Ag + 2NO2 ↑ + O2↑
Найдём количество вещества нитрата серебра, поделив его массу на молярную массу:
М(AgNO3) = 108 + 14 + 48 = 170 г/ моль
√ =  =
= 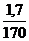 = 0. 01моль
= 0. 01моль
По уравнению реакции из 2 моль нитрата серебра образуется 2 моль серебра, т.е. серебра образуется по молям ровно столько, сколько было взято нитрата. Соответственно, из 0,01 моль нитрата серебра мы получим 0,01 моль серебра.
Ответ: 0,01 моль.
Билет №4
Опыт. Получение и собирание кислорода. Доказательство наличия кислорода в сосуде.
Кислород – бесцветный газ, без вкуса и запаха, поддерживает горение и дыхание. Для получения кислорода в лаборатории используют нагревание некоторых веществ, богатых кислородом, например, бертолетовой соли K Cl O4, перманганата калия K MnO4. Разложение перманганата калия проводят в приборе, состоящем из сухой пробирки и Г – образной газоотводной трубки. В пробирку насыпают небольшое количество перманганата калия и укрепляют ее горизонтально, так чтобы дно располагалось чуть выше отверстия. В отверстие пробирки вставляют пробку с изогнутой под углом газоотводной трубкой, конец которой опускают в банку, служащую для сбора газа. Кислород тяжелее воздуха, поэтому его собирают в сосуд, расположенный дном вниз.
|
|
|
Можно собирать кислород и методом вытеснения воды, т.к. он плохо растворим в воде. Проверив на герметичность, начинают нагревание, постепенно перманганат разлагается, происходит реакция
2 K Mn O4 = K2 Mn O4 + Mn O2 + O2↑
в результате которой выделяется кислород, который заполняет банку.
О наличии в банке кислорода можно судить по воспламенению тлеющей лучинки, которую подносят к отверстию банки. В присутствии кислорода тлеющая лучинка вспыхивает.
Билет №5
Дата добавления: 2018-05-02; просмотров: 1534; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
