Глава 2. Кинетическая теория газов
§6. Основные положения молекулярно кинетической теории (МКТ)
вещества и ее опытное обоснование
1. Основные положения МКТ вещества включают в себя следующие утверждения:
а. Все тела состоят из мельчайших частиц – атомов и молекул;
б. Атомы и молекулы находятся в состоянии непрерывного движения. Движение это является вечным, не прекращающимся ни при каких условиях;
в. Молекулы разных веществ по-разному взаимодействуют между собой. Это взаимодействие зависит от типа молекул и от расстояния между ними.
Качественные опытные доказательства молекулярно-кинетического строения вещества наблюдаются уже в повседневной практике людей. Некоторые из них называл еще Демокрит в 5 веке до н.э. По-видимому, он первым четко сформулировал идею дискретного строения вещества.
а. Растворимость твердых тел и жидкостей в жидкостях. Например, соль и сахар растворяются в воде, вода и мед растворяются друг в друге и т.д.
б. Распространение запахов, пыли и дыма в воздухе. Взаимная смешиваемость газов.
в. Сжимаемость и неограниченная расширяемость газов.
г. Температурное изменение объема тел.
Эти факты легко объяснить, если принять, что вещество состоит из мелких движущихся частиц, между которыми есть промежутки. Тогда взаимное смешивание есть проникновение частиц одного вещества в промежутки между частицами другого, а изменение объема тел есть результат изменения расстояний между частицами тел.
Гораздо труднее объяснить эти факты, если предположить, что тела состоят из некой материи, непрерывно заполняющей пространство.
Количественные опытные доказательства. Вплоть до начала 19 века идея дискретности строения вещества оставалась лишь гениальной догадкой. Было не ясно, что представляют собой эти частицы вещества (на латыни corpusculum – тельце), каковы их размеры, в чем проявляется их движение и какова мера его интенсивности, как частицы взаимодействуют друг с другом, и т.д.
В начале 19 века открываются законы, которые вносят в идею дискретности первые количественные представления. До середины 19 века приоритет в развитии атомистики принадлежал химии.
а. Закон постоянства состава (Жозеф Пруст, 1808).Это один из основных законов химии. Он утверждает: каждое определенное химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов.
Например, вода содержит только водород и кислород, спирт – водород, кислород и углерод, и т.д.
б. Закон кратных отношений (Джон Дальтон, 1803): если два простых вещества образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся в этих соединениях как простые числа.
Например, кислород и водород образуют между собой два соединения: воду H2O и перекись водорода H2O2. Если эти вещества разложить с помощью электролиза, то оказывается, что массы водорода и кислорода относятся между собой в H2O как 1 : 8, а в H2O2 – как 1 : 16. Отношение масс кислорода, приходящихся на единицу массы водорода, равно в соединениях H2O и H2O2 8 : 16 = 1 : 2.
С открытием этого закона разделяются понятия «атом» и «молекула». Под молекулой стали понимать стабильную структуру, состоящую из простых частиц – атомов, находящихся в определенном количественном соотношении. Все молекулы химически чистого вещества построены одинаково.
в. Закон объемных отношений (Жозеф Гей-Люссак, 1808): объемы газов, вступающих в химические реакции друг с другом, а так же объемы получающихся химических соединений в газообразном состоянии, при одних и тех же температуре и давлении относятся между собой как небольшие целые числа.
Например, при сжигании двух объемов водорода в одном объеме кислорода получается один объем водяного пара (при тех же температуре и давлении).
Из законов кратных отношений Дальтона и объемных отношений Гей-Люссака напрашивается вывод, который был сделан Амедео Авогадро.
г. Закон Авогадро, 1811:в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Развитие химической атомистики. С открытием законов Гей-Люссака и Авогадро появилась возможность определения пропорций не только между атомами в молекулах химических соединений, но и в молекулах простых веществ.
Например, исследуя образование хлористого водорода HCl, Гей-Люссак установил, что при соединении одного объема водорода с одним объемом хлора получается не один объем хлористого водорода согласно схеме H+Cl®HCl, а два объема.
Опираясь на закон Авогадро, противоречие можно разрешить допущением, что молекулы водорода и хлора содержат по два атома.
H2 + Cl2 ® 2HCl
1 об.+1 об. = 2 об.
В 1808 году Дальтон публикует первую таблицу масс простых веществ, приходящихся на 1 г водорода в химических соединениях
| H | C | N | O | P |
| 1 | 5 | 5 | 7 | 9 |
В 1814 году швед Йенс Берцелиус опубликовал подобную таблицу отношений для 41 элемента и предложил обозначать атомы элементов начальными буквами их греческих и латинских названий. В большинстве измерений точность, достигнутая Берцелиусом, составляла 3-4 знака, его результаты мало отличались от современных.
| C | N | O | S | Cl | Cu | Pb |
| 12,12 | 14,18 | 16,00 | 32,16 | 35,47 | 63,4 | 207,4 |
Позднее эти числа стали называть, в теперешней терминологии, молярной массой веществ. Число молекул в молярной массе всех веществ одинаково и составляет NA– число Авогадро. Современное значение NA=(6,02252 ± 0,00028)×1023 моль-1.
Постепенно приходит понимание, что вещество можно измерять не только массой, но и количеством молей. Физическая величина, измеряемая числом молей, называется количеством вещества. Единица количества вещества – моль содержит число Авогадро 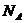 частиц.
частиц.
Формально количеством вещества можно измерять любые дискретные системы с очень большим числом частиц. Смысл моля тот же, что и в выражениях «дюжина», «сотня», «десяток» и т.д. Разница лишь количественная.
Проблемы физической атомистики к середине 19 века. Несмотря на значительные успехи химической атомистики, в целом представления об атомах и молекулах как физических объектах природы оставалось вплоть до середины 19 века еще очень неопределенным. Были неизвестны размеры и форма молекул, скорости и характер их движения в телах, а самое главное, не было ясно, как связаны их массы и скорости движения с макро-характеристиками вещества, такими как температура, теплоемкость и другие. Как движутся молекулы в газах, жидкостях и твердых телах?
В середине 19 века появляются первые теоретические и практические исследования по физической кинетике газов – тел с наиболее простым по сравнению с жидкостями и твердыми телами строением. А, кроме того, многочисленными опытами физические свойства газов были исследованы к тому времени наиболее полно.
Дата добавления: 2018-04-15; просмотров: 533; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
